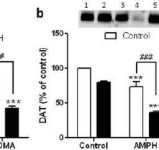
Мефедронът (4-метилметакатинон) е β-кетоамфетаминов стимулант, наркотик за злоупотреба, с близки структурни и механични прилики с метамфетамина. Едно от най-мощните действия, свързани с мефедрона, е способността му да стимулира освобождаването на допамин (DA) и да блокира обратното му поемане чрез взаимодействието си с допаминовия транспортер (DAT). Въпреки че мефедронът не причинява токсичност на DA нервните окончания, неговата способност да служи като блокер на DAT би могла да осигури защита срещу невротоксичност, предизвикана от метамфетамин, подобно на други инхибитори на DAT. За да се провери тази възможност, мишките са третирани с мефедрон (10, 20 или 40 mg/kg) преди всяко инжектиране на невротоксичен режим на метамфетамин (4 инжекции от 2,5 или 5,0 mg/kg през интервал от 2 часа). Целостта на DA нервните окончания на стриатума беше оценена чрез измерване на нивата на DA, DAT и тирозин хидроксилаза. Умерената до тежка DA токсичност, свързана с различните дози метамфетамин, не е предотвратена от нито една доза мефедрон, а всъщност е значително засилена. Хипертермията, причинена от комбинираното лечение с мефедрон и метамфетамин, е същата като наблюдаваната след прием на всяко от двете лекарства самостоятелно. Мефедронът също така засилва невротоксичните ефекти на амфетамина и MDMA върху DA нервните окончания. За разлика от тях номифензинът предпазва от невротоксичност, предизвикана от метамфетамин. Тъй като мефедронът увеличава невротоксичността на метамфетамина, настоящите резултати предполагат, че той взаимодейства с DAT по начин, различен от този на другите типични инхибитори на DAT. Сравнително безвредните ефекти на самия мефедрон върху DA нервните окончания прикриват потенциално опасно взаимодействие с лекарствата, които често се употребяват съвместно с него, водещо до повишена невротоксичност.
Мефедронът (4-метилметакатинон) е производно на катинона и структурен аналог на метамфетамина и 3,4-метилендиокси-метамфетамина (MDMA). Мефедронът е една от психоактивните съставки на "солите за вана" заедно с други съединения като метилон, бутилон и 3,4-метилендиоксипировалерон (MDPV). β-кетоамфетамините се употребяват с нарастващи темпове, което се дължи в немалка степен на силно ограничената наличност на прекурсори, необходими за синтеза на метамфетамин и MDMA в тайните лаборатории, и на съответното намаляване на тяхната чистота (Winstock et al. 2011b, Brunt et al. 2011). Тъй като злоупотребата с β-кетоамфетамини продължава да се увеличава, списъкът с техните неблагоприятни ефекти се разширява, като включва сърдечносъдови усложнения, възбуда, безсъние, психоза и депресия (Schifano et al. 2011, Prosser and Nelson 2012).
Като химически родственици на метамфетамина и MDMA не е изненадващо, че β-кетоамфетамините имат много от същите ефекти като тези първи наркотици върху централната нервна система. Например тези наркотици блокират транспортерите на допамин (DA) и серотонин (5-HT) (съответно DAT и SERT) (Cozzi и др. 1999 г., Rothman и др. 2003 г., Fleckenstein и др. 2000 г., Lopez-Arnau и др. 2012 г.) и стимулират освобождаването на моноамини in vitro (Kalix и Glennon 1986 г., Gygi и др. 1997 г., Rothman и др. 2003 г.) и in vivo (Gygi и др. 1997 г., Kehr и др. 2011 г.). Меткатинонът предизвиква трайно намаляване на активността на триптофан хидроксилазата и тирозин хидроксилазата (TH) и изчерпване на DA и 5-НТ (Gygi et al. 1997, Gygi et al. 1996, Sparago et al. 1996). Проучванията с ПЕТ-изображения при абстинентни употребяващи метатинон разкриват намалена плътност на стриатичния DAT, което предполага загуба на DA терминали (McCann et al. 1998). Едновременното стимулиране на освобождаването на DA и инхибирането на неговото усвояване отразяват критичните елементи, лежащи в основата на невротоксичността, свързана с метамфетамина (Kuhn et al. 2008, Yamamoto and Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Ние (Angoa-Perez et al. 2012) и други (Baumann et al. 2012, Hadlock et al. 2011) наскоро проучихме възможността мефедронът да предизвиква невротоксичност като метамфетамина и MDMA. Изненадващо, мефедронът не е токсичен за DA нервните окончания на стриатума (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Въпросът дали мефедронът уврежда нервните окончания на 5-HT остава нерешен, тъй като едно проучване документира положителни ефекти (Hadlock et al. 2011), а друго е отрицателно (Baumann et al. 2012). В светлината на относително благоприятния ефект на мефедрона върху DA нервните окончания и като се имат предвид свойствата му като DAT блокер, ние предположихме, че той всъщност би могъл да защити DA невронната система от невротоксичните ефекти на метамфетамина, както е известно, че се случва с други DAT блокери като амфонеловата киселина (Pu et al. 1994, Schmidt and Gibb 1985, Marek et al. 1990) и номифензина (Poth et al. 2012). В настоящия доклад съобщаваме, че мефедронът значително засилва невротоксичността на метамфетамина. Този ефект се разпростира и върху амфетамина и MDMA - наркотици, които често се употребяват съвместно с мефедрон (Feyissa and Kelly 2008, Schifano et al. 2011). Тези изненадващи резултати поставят злоупотребата с мефедрон в нова светлина и придават спешност на признаването на това фино и опасно свойство на този β-кетоамфетамин.
Материали и методи
Наркотици и реактиви
Мефедроновият хидрохлорид и 3,4-метилендиоксиметамфетаминът (MDMA) бяха получени от Програмата за снабдяване с наркотици на NIDA Research Resources. (+) Метамфетамин хидрохлорид, номифензин малеат, d-амфетамин сулфат, пентобарбитал, DA и всички буфери и HPLC реагенти са закупени от Sigma-Aldrich (St. Louis, MO, USA). Комплектите за анализ на белтъчини с бицинхонинова киселина са получени от Pierce (Rockford, IL, USA). Поликлоналните антитела срещу TH на плъхове са произведени, както е описано по-рано (Kuhn and Billingsley 1987). Моноклоналните антитела срещу DAT на плъхове бяха щедро предоставени от д-р Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA). HRP-конюгираните анти-IgG вторични антитела бяха предоставени от Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA).
Животни
Женски мишки C57BL/6 (Harlan, Indianapolis, IN, USA) с тегло 20-25 g по време на експеримента бяха настанени по 5 в клетка в големи клетки тип "кутия за обувки" в светло (12 часа светлина/тъмнина) и температурно контролирано помещение. Използвани са женски мишки, тъй като е известно, че те са много чувствителни към увреждане на невроните от невротоксичните амфетамини, и за да се запази съгласуваността с предишните ни изследвания на невротоксичността на метамфетамина (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). Мишките имаха свободен достъп до храна и вода. Институционалният комитет за грижи и използване на животни на Държавния университет Уейн одобри грижите за животните и експерименталните процедури. Всички процедури бяха в съответствие и с Ръководството на NIH за грижа и използване на лабораторни животни.
Фармакологични, физиологични и поведенчески процедури
Мишките бяха третирани с мефедрон по схема, наподобяваща пиянство, състояща се от 4 инжекции от 10, 20 или 40 mg/kg с интервал от 2 часа между всяка инжекция. Този режим на лечение, когато се използва за инжектиране на заместени амфетамини и производни на катинона, води до обширно увреждане на крайните части на DA нервите. Дозите мефедрон, използвани понастоящем, са показали преди това, че не са токсични за DA нервните окончания (Angoa-Perez et al. 2012). Мишките са третирани с метамфетамин (4Х 2,5 или 5 mg/kg), амфетамин (4Х 5 mg/kg) или MDMA (4Х 20 mg/kg) самостоятелно или в комбинация с мефедрон. Когато са третирани с две лекарства, мишките са получили инжекция с мефедрон 30 минути преди всяка от 4-те инжекции с метамфетамин, амфетамин или MDMA. Контролните мишки получават инжекции с физиологичен разтвор по същата схема, използвана за мефедрон самостоятелно или в комбинация с други амфетамини. Като контрол за ефектите на инхибитора на DAT върху токсичността на метамфетамина, мишките са третирани с номифензин (4Х 5 mg/kg) 30 минути преди всяко инжектиране на метамфетамин (4Х 5 mg/kg). Всички инжекции са направени по i.p. път. Мишките бяха умъртвени 2 дни след последното третиране с лекарството, когато невротоксичността, свързана с амфетамина, е достигнала максимума си. Телесната температура беше наблюдавана чрез телеметрия с помощта на имплантируеми температурни транспондери IPTT-300 на Bio Medic Data Systems, Inc (Seaford, DE, USA). Температурата се записваше неинвазивно на всеки 20 минути, като се започваше 60 минути преди първото инжектиране на METH и се продължаваше 9 часа след това с помощта на конзолната система DAS-5001 от Bio Medic.
Определяне на стриаталното съдържание на DA
Стриаталната тъкан беше разрязана двустранно от мозъка след третирането и съхранена при -80 °C. Замразените тъкани бяха претеглени и сонирани в 10 обема 0,16 N перхлорна киселина при 4°C. Неразтворимият протеин е отстранен чрез центрофугиране и DA е определен чрез HPLC с електрохимична детекция, както е описано по-рано за метамфетамин (Thomas et al. 2010, Thomas et al, 2009).
Определяне на нивата на протеините TH и DAT чрез имуноблотинг
Ефектите от третирането с лекарствата върху нивата на TH и DAT в стриатума бяха определени чрез имуноблотинг като индекс на токсичност за стриатумните DA нервни окончания. Мишките бяха умъртвени чрез обезглавяване след третиране и стриатумът беше разрязан двустранно. Тъканта е съхранявана при -80°C. Замразената тъкан е разрушена чрез сониране в 1% SDS при 95°C и неразтворимият материал е утаен чрез центрофугиране. Протеинът беше определен по метода на бицинхониновата киселина и равни количества протеин (70 μg/лан) бяха разграничени чрез SDS-полиакриламидна гел-електрофореза и след това електроблотирани върху нитроцелулоза. Блотовете бяха блокирани в Трис буфериран физиологичен разтвор, съдържащ Tween 20 (0,1 % v/v) и 5 % обезмаслено сухо мляко за 1 час при стайна температура. Първичните антитела срещу TH (1:1000) или DAT (1:1000) се добавят към блотовете и се оставят да се инкубират за 16 часа при 4°C. Блотовете се промиват 3 пъти в Трис-буфериран физиологичен разтвор, за да се отстранят нереагиралите антитела, и след това се инкубират с HRP-конюгирано анти-IgG вторично антитяло (1:4000) за 1 h при стайна температура. Имунореактивните ленти се визуализират чрез засилена хемилуминисценция и относителната плътност на TH- и DAT-реактивните ленти се определя чрез визуализация с Kodak Image Station (Carestream Molecular Systems, Rochester, NY, USA) и се определя количествено с помощта на софтуера ImageJ (NIH).
Анализ на данните
Бяха извършени двупосочни ANOVA за анализ на ефектите на дозата на метамфетамина спрямо мефедрона върху DA, DAT и TH. Ефектите на лекарствените третирания върху стриаталното съдържание на DA, TH и DAT бяха тествани за значимост чрез еднопосочен ANOVA, последван от тест за множествено сравнение на Tukey. Резултатите от третирането с лекарства върху температурата на ядрото на тялото във времето бяха анализирани с помощта на двупосочен ANOVA, последван от теста на Бонферони, за да се определи значимостта на разликите в температурата в отделните моменти след третирането. Разликите се считаха за значими, ако р < 0,05. Всички статистически анализи бяха извършени с помощта на GraphPad Prism версия 5.02 за Windows (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Отидете на:
Резултати
Ефекти на мефедрона върху индуцираната от метамфетамин невротоксичност
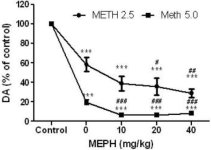
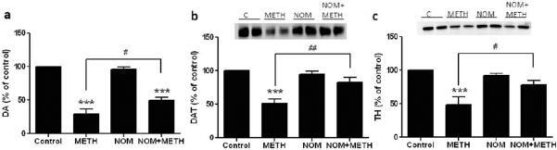
Мефедрон в дози (10, 20 или 40 mg/kg), за които е известно, че не предизвикват токсичност на DA нервните окончания (Angoa-Perez et al. 2012), е прилаган 30 минути преди всяко инжектиране на метамфетамин. Метамфетаминът беше приложен в дози, които причиняват умерено (4Х 2,5 mg/kg) или тежко (4Х 5 mg/kg) увреждане на DA нервните окончания на стриатума (Thomas et al. 2004, Thomas et al. 2010). Резултатите, представени на фиг. 1, показват, че основните ефекти на дозата метамфетамин (F1,40 = 66,60, p < 0,0001) и дозата мефедрон (F4,40 = 131,3, p < 0,0001) върху нивата на DA в стриатума са силно значими чрез двупосочен ANOVA. Основният ефект на мефедрона, даден в комбинация с 2,5 mg/kg (F4,22 = 35,96, p < 0,001) или 5,0 mg/kg метамфетамин (F4,17 = 953,9, p < 0,0001), също е силно значим чрез еднопосочен ANOVA. Всички третирания с която и да е от дозите метамфетамин ± мефедрон предизвикват значително по-голямо намаляване на DA в сравнение със съответната контрола (p < 0,0001 за всички). На фиг. 1 се вижда също, че дозите мефедрон от 20 (p < 0,01) и 40 mg/kg (p < 0,001) значително засилват изчерпващите ефекти на 2,5 mg/kg метамфетамин върху DA, докато всички дози мефедрон значително засилват ефектите на 5,0 mg/kg метамфетамин върху нивата на DA (p < 0,0001 за всички).
Фиг.1
Ефекти на мефедрона върху индуцираното от метамфетамин намаляване на стриатичния DA. Мишките са третирани с посочените дози мефедрон (MEPH) 30 мин. преди всяко инжектиране на 2,5 (-) или 5,0 mg/kg (■) метамфетамин (METH) и са умъртвени 2 г. по-късно за определяне на стриаталните нива на DA чрез HPLC. Данните са средни ± SEM за 5-7 мишки от група. Някои стълбчета за грешка са били твърде малки, за да надхвърлят размера на символите, и не се виждат. ***p < 0,001 спрямо контролите и #p < 0,01, ##p < 0,001 или ###p < 0,0001 спрямо съответната доза метамфетамин (тест за множествено сравнение на Tukey).
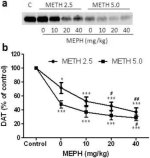
Фиг. 2а показва, че мефедронът значително увеличава индуцираното от метамфетамин намаляване на нивата на DAT, както е определено чрез имуноблотинг. Имуноблотовете бяха количествено оценени и в съгласие с резултатите за DA, основните ефекти на дозата метамфетамин (F1,92 = 9,48, p < 0,001) и дозата мефедрон (F4,92 = 37,56, p < 0,0001) върху нивата на DAT в стриатума бяха силно значими чрез двупосочен ANOVA (фиг. 2б). Основният ефект на мефедрона, даден в комбинация с 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) или 5,0 mg/kg метамфетамин (F4,39 = 24,84, p < 0,0001), също беше силно значим чрез еднопосочен ANOVA. Всички третирания с която и да е от дозите метамфетамин ± мефедрон предизвикват значително по-голямо намаляване на DAT в сравнение със съответната контрола (p < 0,01 за 2,5 mg/kg само метамфетамин; p < 0,0001 за всички останали третирания). Фиг. 2б показва също, че дозите мефедрон от 20 mg/kg (p < 0,01) и 40 mg/kg (p < 0,001) значително засилват намаленията на DAT, причинени от 2,5 mg/kg метамфетамин, докато само дозата мефедрон от 40 mg/kg значително засилва (p < 0,01) ефекта на 5,0 mg/kg метамфетамин върху намаленията на DAT.
Фиг.2
Ефекти на мефедрона върху индуцираните от метамфетамин намаления на стриатичния DAT. Мишките са третирани с посочените дози мефедрон (MEPH) 30 мин. преди всяко инжектиране на 2,5 (●) или 5,0 mg/kg (■) метамфетамин (METH) и са умъртвени 2 г. по-късно за определяне на стриаталните нива на DAT чрез имуноблотинг (а). Блотовете са количествено оценени с помощта на ImageJ и данните са средни ± SEM за 10-12 мишки от група (б). *p < 0,01 или ***p < 0,0001 спрямо контролата (C) и #p < 0,01 или ##p < 0,001 спрямо съответната доза метамфетамин (тест за множествено сравнение на Tukey).
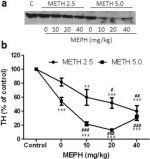
Фиг. 3а показва, че мефедронът значително увеличава индуцираното от метамфетамин намаляване на нивата на TH, както е определено чрез имуноблотинг. Имуноблотовете бяха количествено оценени и в съгласие с резултатите по-горе за DA и DAT, основните ефекти на дозата метамфетамин (F1,81 = 47,89, p < 0,0001) и дозата мефедрон (F4,81 = 63,57, p < 0,0001) бяха силно значими чрез двупосочен ANOVA (фиг. 3б). Основният ефект на мефедрона, даден в комбинация с 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) или 5,0 mg/kg метамфетамин (F4,49 = 99,16, p < 0,0001), също е силно значим чрез еднопосочен ANOVA. Всички третирания с която и да е от дозите на метамфетамин ± мефедрон предизвикват значително по-голямо намаляване на ТН в сравнение със съответната контрола (p < 0,001 за 2,5 mg/kg метамфетамин + 10 mg/kg мефедрон; p < 0,0001 за всички останали комбинации) с изключение само на 2,5 mg/kg метамфетамин, който не променя значително нивата на ТН (т.е. няма токсичност). Фиг. 3б показва също така, че дози мефедрон от 20 mg/kg (p < 0,01) и 40 mg/kg (p < 0,001) значително засилват намаляването на ТН, причинено от 2,5 mg/kg метамфетамин, и всичките три дози мефедрон значително (p < 0,0001) засилват ефекта на 5,0 mg/kg метамфетамин върху намаляването на ТН.
Фиг. 3
Ефекти на мефедрона върху индуцираните от метамфетамин намаления на стриатичния TH. Мишките са третирани с посочените дози мефедрон (MEPH) 30 мин. преди всяко инжектиране на 2,5 (●) или 5,0 mg/kg (■) метамфетамин (METH) и са умъртвени 2 г. по-късно за определяне на стриаталните нива на TH чрез имуноблотинг (а). Блотовете са количествено оценени с помощта на ImageJ и данните са средни ± SEM за 10-12 мишки от група (б). Някои стълбчета за грешка са били твърде малки, за да надхвърлят размера на символите, и не се виждат. **p < 0,001 или ***p < 0,0001 спрямо контролата (C) и #p < 0,01, ##p < 0,001 или ###p < 0,0001) спрямо съответната доза метамфетамин (тест за множествено сравнение на Tukey).
Ефекти на мефедрона върху предизвиканата от метамфетамин хипертермия
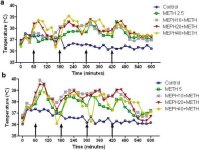
Мефедронът, подобно на метамфетамина, предизвиква значителна хипертермия (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Когато мефедронът се дава 30 мин. преди всяко инжектиране на метамфетамин, на фиг. 4 се вижда, че основните ефекти на дозите метамфетамин и мефедрон (F1,300 = 11,99, p < 0,0001) върху времето (F4,300 = 51,73, p < 0,0001) са силно значими чрез двупосочен ANOVA. Основните ефекти на мефедрон, приложен в комбинация с 2,5 mg/kg метамфетамин (F4,120 = 41,44, p < 0,0001, панел а) във времето (F30,120 = 3,84, p < 0,0001) или 5,0 mg/kg метамфетамин (F4,120 = 78,09, p < 0,0001, панел б) във времето (F30,120 = 9,98, p < 0,0001), също са силно значими чрез двупосочен ANOVA. Всички третирания с която и да е от дозите метамфетамин ± мефедрон се различават значително от съответните контроли (p < 0,0001 за всички третирания).
Фиг. 4
Ефекти на мефедрона върху индуцираната от метамфетамин хипертермия. Мишките са третирани с посочените дози мефедрон (MEPH) 30 минути преди всяко инжектиране на 2,5 (а) или 5,0 mg/kg (б) метамфетамин (METH). Температурата на ядрото се измерва на интервали от 20 минути чрез телеметрия, като се започва 60 минути преди първото инжектиране на метамфетамин. Четирите инжекции с метамфетамин са отбелязани със стрелките, разположени върху оста x. Данните са изразени като средна телесна температура на 6-8 мишки от група. SEM са винаги < 10 % от средната стойност и са пропуснати за по-голяма яснота.
Ефекти на мефедрона върху индуцираната от амфетамин и MDMA невротоксичност
За да се провери дали засилващите ефекти на мефедрона върху метамфетамина могат да се разпространят и върху други невротоксични амфетамини, мишките бяха третирани с този β-кетоамфетамин (20 mg/kg) плюс амфетамин (4X 5 mg/kg) или MDMA (4X 20 mg/kg) и резултатите са представени на фигура 5. Припомняме, че самият мефедрон не намалява стриаталните DA, DAT или TH (Angoa-Perez et al. 2012). Основният ефект на лекарството (F5,27 = 27,18, p < 0,0001) е силно значим чрез еднопосочен ANOVA за намаляване на DA (фиг. 5а). На фиг. 5а се вижда също, че всички третирания с амфетамин (p < 0,001) или MDMA (p < 0,001) самостоятелно или в комбинация с мефедрон (p < 0,0001 и за двете лекарства) значително понижават нивата на DA спрямо контролата. Мефедронът значително засилва намаленията на DA, причинени от амфетамин (p < 0,01) или MDMA (p < 0,01). Фиг. 5б показва подобни ефекти на комбинираното лечение с лекарства върху нивата на DAT в стриатума. Основният ефект на лекарството (F4,49 = 42,63, p < 0,0001) е силно значим чрез еднопосочен ANOVA за DAT. На фиг. 5б се вижда също, че при всички третирания с амфетамин или MDMA стойностите на DATAT са значително (p < 0,0001 за всички) по-ниски в сравнение с контролата. Мефедронът също значително увеличава намаленията на DAT, причинени от амфетамин или MDMA (p < 0,0001 и в двата случая). И накрая, фиг. 5в показва, че основният ефект на лекарството (F4,50 = 75,06, p < 0,0001) е силно значим чрез еднопосочен ANOVA за намаленията на ТХ. На фиг. 5в се вижда също така, че всички третирания с амфетамин или MDMA са били значително (p < 0,0001 за всички) по-ниски в сравнение с контролата. Мефедронът също така значително увеличава намаленията на TH, причинени от амфетамин или MDMA (p < 0,0001 и в двата случая)
Фиг. 5
Ефекти на мефедрона върху невротоксичността на DA нервните окончания, предизвикана от амфетамин или MDMA. Мишките са третирани с 20 mg/kg мефедрон (MEPH) 30 минути преди всяко инжектиране на 5,0 mg/kg амфетамин (AMPH) или 20 mg/kg MDMA и са умъртвени 2d след третирането за определяне на стриаталните нива на (a) DA чрез HPLC. (б) DAT и (в) TH бяха определени чрез имуноблотинг и блотовете бяха количествено оценени с помощта на ImageJ. Представителни имуноблотове за DAT и TH са включени като вложки съответно в панели (б) и (в), а третиранията за двата панела са обозначени с 1,5: контрола; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; и 8: MDMA + MEPH. Данните са средни ± SEM за 5-12 мишки във всяка група. **p < 0,001 или ***p < 0,0001 спрямо контролата и #p < 0,01 или ###p < 0,0001 спрямо AMPH или MDMA (тест за множествено сравнение на Tukey).
Ефекти на номифензин върху индуцираната от метамфетамин невротоксичност
Номифензинът, мощен блокер на DAT без известен потенциал за злоупотреба или невротоксичност, е тестван за способността му да предпазва от метамфетамин-индуцирана невротоксичност и за контраст с действието на мефедрона върху токсичността на DA нервните окончания, причинена от метамфетамин, амфетамин и MDMA. Резултатите на фиг. 6а показват, че основният ефект на лекарството (F3,16 = 63,39, p < 0,0001) върху нивата на DA е силно значим чрез еднопосочен ANOVA. Номифензинът самостоятелно не променя нивата на DA, но намалението, причинено от метамфетамин (p < 0,0001), е леко, но значително обърнато от номифензина (p < 0,01). Основният ефект на лекарството (F3,20 = 16,78, p < 0,0001) върху нивата на ДАТ е силно значим чрез еднопосочен ANOVA, както е показано на фиг. 6б. Номифензинът не променя нивата на DAT, но осигурява значителна защита (p < 0,001) срещу намаляването на стриаталния DAT, причинено от метамфетамин (p < 0,0001) в сравнение с контролата. И накрая, фиг. 6в показва, че основният ефект на лекарството (F3,15 = 14,10, p < 0,0001) върху нивата на ТХ е силно значим чрез еднопосочен ANOVA. Както се вижда за DA и DAT, намаляването на TH, причинено от метамфетамин (p < 0,0001), е слабо, но значително предотвратено от номифензин (p < 0,01).
Фиг. 6
Ефекти на номифензин върху невротоксичността на DA нервните окончания, предизвикана от метамфетамин. Мишките са третирани с 5,0 mg/kg номифензин (NOM) 30 мин. преди всяко инжектиране на 5,0 mg/kg метамфетамин (METH) и са умъртвени 2d по-късно за определяне на стриаталните нива на (а) DA чрез HPLC. (б) DAT и (в) TH бяха определени чрез имуноблотинг и блотовете бяха количествено оценени с помощта на ImageJ. Представителни имуноблотове за DAT и TH са включени като вложки в панели (б) и (в). Данните са средни плюс SEM за 5-7 мишки от група. ***p < 0,0001 спрямо контролата (С) и #p < 0,01 или ##p < 0,001 спрямо самия метамфетамин (тест за множествено сравнение на Tukey).
Обсъждане
Целта на настоящото проучване беше да се определи дали мефедронът ще предотврати токсичността на DA нервните окончания, причинена от метамфетамин. Въз основа на химическото му сходство с метамфетамина и MDMA първоначално се очакваше, че мефедронът ще окаже вредно въздействие върху DA невронната система. Няколко проучвания обаче почти едновременно установиха, че мефедронът не е токсичен за DA нервните окончания (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Въпросът дали това лекарство причинява увреждане на 5-HT невронната система остава открит. В едно проучване се съобщава за трайно намаляване на функцията на 5-HT нервните окончания (Hadlock et al. 2011), докато в друго се установява, че мефедронът не причинява увреждане (Baumann et al. 2012). Мефедронът взаимодейства с нервното окончание на DA по начин, който предполага, че той наистина стимулира освобождаването и блокира обратното поемане на DA чрез взаимодействието си с DAT. Ключов аспект на невротоксичния механизъм на действие на метамфетамина е способността му да получи достъп до DA нервните окончания чрез DAT и да наруши хомеостазата на DA (Sulzer 2011). Ако тази ранна стъпка в невротоксичната каскада на метамфетамина се предотврати чрез инхибиране на DAT, токсичността се предотвратява (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt and Gibb 1985). Предположихме, че мефедронът би могъл да има същото защитно свойство като другите инхибитори на DAT, но вместо това наблюдавахме значително засилване на токсичността. Това взаимодействие беше наблюдавано при използване на две различни дози метамфетамин, които причиняват умерено или тежко увреждане на DA нервните окончания (съответно 4Х 2,5 или 5,0 mg/kg). Този потенциращ ефект на мефедрона не се ограничава само до метамфетамина и се разпростира и върху амфетамина и MDMA - два наркотика, които често се употребяват съвместно с мефедрон и други β-кетоамфетамини (Feyissa and Kelly 2008, Schifano et al. 2011, Kelly 2011). Следователно въпреки факта, че мефедронът не причинява токсичност поне на DA нервните окончания на стриатума, той потенцира невротоксичните ефекти на други наркотици за злоупотреба. Това ново откритие би трябвало да постави злоупотребата с мефедрон в още по-остра светлина, тъй като липсата на присъща невротоксичност може да го направи да изглежда безобиден.
Хипертермията е често съобщаван остър неблагоприятен ефект от приема на метамфетамин (Greene et al. 2008) и β-кетоамфетамин при хора (Borek and Holstege 2012, Prosser and Nelson 2012). Подобно на метамфетамина, много от наркотиците, съдържащи β-кетоамфетамин, също предизвикват значително повишаване на температурата на ядрото при гризачи (Angoa-Perez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Въпреки че хипертермията, причинена от метамфетамина, може да допринесе за неговите морфологични и увреждащи невроните ефекти, не е задължително хипертермията да е пряката причина за тези ефекти (Kiyatkin and Sharma 2009). Регистрирахме температурата на ядрото на тялото при мишки, третирани с мефедрон и метамфетамин, и наблюдавахме, че комбинираното третиране не е повишило температурата над максималните увеличения, наблюдавани след употребата на всяко от двете лекарства самостоятелно. Метамфетаминът предизвика свързано с дозата повишаване на телесната температура и тази хипертермия беше инвариантна в целия тестван диапазон на дозите мефедрон. Всъщност спадът на телесната температура след инжектиране, наблюдаван след лечение с мефедрон (Angoa-Perez et al. 2012), се е запазил и при по-високите дози мефедрон плюс метамфетамин. Въпреки че предизвиканата от лекарството хипертермия не се е засилила при комбинирано лечение с лекарства, невротоксичните ефекти са били адитивни. Следователно, поне в настоящия случай, изглежда, че невротоксичните ефекти на метамфетамина могат да бъдат засилени от мефедрон по начин, който не зависи от хипертермията.
Мефедронът ясно инхибира функцията на DAT и блокира повторното поемане на DA in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). Мефедронът измества WIN-35,428 от мястото му на свързване върху DAT, което предполага, че той е конкурентен инхибитор на усвояването на DA (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). Силата на мефедрона в това отношение е много сходна с тази на метамфетамина (Cozzi et al. 1999) и MDMA (Escubedo et al. 2011). Не е известно дали мефедронът се транспортира от DAT, но метатинонът се транспортира (Cozzi and Foley 2003). Номифензинът и амфонеловата киселина, които се свързват с DAT и инхибират усвояването на DA, осигуряват значителна защита срещу невротоксичност, предизвикана от метамфетамин (Pu et al. 1994, Marek et al. 1990, Schmidt and Gibb 1985, Poth et al. 2012), а мишките, при които липсва DAT, са устойчиви на невроналната токсичност на метамфетамина (Fumagalli et al. 1998). Знанието, че мефедронът не е невротоксичен и е блокер на DAT, води до прогнозата, че той би трябвало да предотврати токсичността. В тази връзка тествахме номифензин като положителна контрола и потвърдихме, че той предпазва от индуцираното от метамфетамин изчерпване на DA, DAT и TH. Номифензинът също така инхибира норепинефриновия транспортер (Brogden et al. 1979), но това свойство не може да обясни настоящите резултати, тъй като повечето β-кетоамфетамини, включително мефедронът, инхибират норепинефриновия транспортер и блокират усвояването на норепинефрин (Kelly 2011, Rothman et al. 2003, Cozzi et al. 1999, Sogawa et al. 2011, Lopez-Arnau et al. 2012). Ролята на 5-HT невронната система в някои от фармакологичните действия на мефедрона е възможна в светлината на способността на това лекарство, подобно на MDMA (Yamamoto et al. 1995), да предизвиква изтичане на стриатален DA чрез взаимодействието си с 5-HT2A рецепторите (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). Хиперлокомоцията, причинена от мефедрон, зависи от ендогенния 5-HT (Lopez-Arnau et al. 2012) и това лекарство също така стимулира освобождаването на 5-HT и инхибира неговото усвояване in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) и in vivo (Baumann et al. 2012, Kehr et al. 2011). Въпреки това можем да изключим ролята на ендогенния 5-HT в DA невротоксичността поне на метамфетамина, като покажем, че мишки, генетично лишени от 5-HT, запазват чувствителността си към невротоксичност (Thomas et al. 2010).
Мефедронът би могъл да засили невротоксичността на метамфетамина по няколко възможни механизма. Първо, мефедронът би могъл да взаимодейства с VMAT, за да предизвика изтичане на DA в цитоплазмата на пресинаптичното нервно окончание. Третирането, което увеличава цитоплазмения пул (т.е. освобождаващия се от лекарството) DA, увеличава невротоксичността на метамфетамина (Thomas et al. 2008, Thomas et al. 2009, Schmidt et al. 1985). Този механизъм е малко вероятен, тъй като метатинонът взаимодейства слабо с VMAT (Cozzi et al. 1999). Второ, комбинацията от мефедрон плюс метамфетамин би могла да има синергичен ефект върху невесикуларното освобождаване на DA, но тази възможност също изглежда малко вероятна в светлината на резултатите, показващи, че третирането на DAT- или SERT-експресиращи CHO клетки с мефедрон плюс метамфетамин няма адитивен ефект върху освобождаването на DA или 5-HT (Sogawa et al. 2011). Трето, мефедронът може да взаимодейства с DAT по нов начин, който допринася за адитивната токсичност. Доказано е, че мефедонът в комбинация с метамфетамин предизвиква синергична цитотоксичност в CHO клетки, експресиращи DAT или SERT, но не и в CHO клетки от див тип, в които липсват транспортерите (Sogawa et al. 2011). Цитотоксичността, наблюдавана при култивираните клетки в тези изследвания (т.е. освобождаването на LDH), е много различна от увреждането на DA нервните окончания, причинено от метамфетамин, но този механизъм предполага интересна, но неопределена роля на DAT в засилената цитотоксичност. На последно място, мефедронът може да промени метаболизма на метамфетамина. Мефедронът се метаболизира предимно чрез N-деметилиране (Meyer and Maurer 2010), както и метамфетаминът и MDMA (Caldwell 1976). Подкрепа за този механизъм идва от демонстрацията, че метамфетаминът и MDMA взаимно потискат производството на съответните си първични метаболити и повишават плазмените нива на наркотиците над тези, наблюдавани след самостоятелно приложение на всеки от тях (Kuwayama и кол. 2012 г.). Дозите мефедрон, използвани понастоящем и в предишното ни проучване (Angoa-Perez et al. 2012), макар и високи, не са невротоксични и попадат в диапазона, с който злоупотребяват хората (McErath and O'Neill 2011). Следователно мефедронът би могъл да действа подобно на MDMA за повишаване на плазмените нива на метамфетамина, като инхибира неговия метаболизъм. За потвърждаване на тази последна възможност ще е необходим задълбочен фармакокинетичен анализ.
Злоупотребата с β-кетоамфетамини нараства с тревожни темпове и мефедронът понастоящем е един от най-често употребяваните наркотици след канабиса, MDMA и кокаина (Morris 2010, Winstock et al. 2011b). Освен това мефедронът предизвиква по-силно чувство на глад при хората в сравнение с MDMA (Brunt et al. 2011), а употребяващите, които смъркат мефедрон, го оценяват като по-пристрастяващ от кокаина (Winstock et al. 2011b). Мефедронът се употребява от хората по начин, подобен на натравяне (т.е. "stacking"), и често се приема с други наркотици, като канабис и амфетаминовите психостимуланти (Schifano et al. 2011 г., Fass et al. 2012 г., Winstock et al. 2011a, Kelly 2011 г., Torrance and Cooper 2010 г.). Мефедронът се среща все по-често в таблетки, продавани като MDMA (Brunt et al. 2011 г.), и употребата му вероятно ще надмине тази на MDMA, тъй като чистотата на последния наркотик продължава да спада (Brunt et al. 2011 г., Tanner-Smith 2006 г., Teng et al. 2006 г.). Въз основа на често срещаните модели на злоупотреба с мефедрон и други съставки на "солите за вана" е важно да се обмисли дали се натрупват допълнителни рискове за здравето на хората, когато тези наркотици се комбинират с амфетамини умишлено или неволно. Нашите резултати, показващи, че поне мефедронът значително засилва невротоксичността на DA нервните окончания на стриатума, причинена от метамфетамин, амфетамин и MDMA, разкриват особено опасно и неочаквано свойство на този β-кетоамфетамин.
Използвани съкращения
5-HT серотонин
DA допамин
DAT DA транспортер
MDMA 3,4-метилендиоксиметамфетамин
TH тирозин хидроксилаза
VMAT везикуларен моноаминов транспортер
Мефедронът (4-метилметакатинон) е производно на катинона и структурен аналог на метамфетамина и 3,4-метилендиокси-метамфетамина (MDMA). Мефедронът е една от психоактивните съставки на "солите за вана" заедно с други съединения като метилон, бутилон и 3,4-метилендиоксипировалерон (MDPV). β-кетоамфетамините се употребяват с нарастващи темпове, което се дължи в немалка степен на силно ограничената наличност на прекурсори, необходими за синтеза на метамфетамин и MDMA в тайните лаборатории, и на съответното намаляване на тяхната чистота (Winstock et al. 2011b, Brunt et al. 2011). Тъй като злоупотребата с β-кетоамфетамини продължава да се увеличава, списъкът с техните неблагоприятни ефекти се разширява, като включва сърдечносъдови усложнения, възбуда, безсъние, психоза и депресия (Schifano et al. 2011, Prosser and Nelson 2012).
Като химически родственици на метамфетамина и MDMA не е изненадващо, че β-кетоамфетамините имат много от същите ефекти като тези първи наркотици върху централната нервна система. Например тези наркотици блокират транспортерите на допамин (DA) и серотонин (5-HT) (съответно DAT и SERT) (Cozzi и др. 1999 г., Rothman и др. 2003 г., Fleckenstein и др. 2000 г., Lopez-Arnau и др. 2012 г.) и стимулират освобождаването на моноамини in vitro (Kalix и Glennon 1986 г., Gygi и др. 1997 г., Rothman и др. 2003 г.) и in vivo (Gygi и др. 1997 г., Kehr и др. 2011 г.). Меткатинонът предизвиква трайно намаляване на активността на триптофан хидроксилазата и тирозин хидроксилазата (TH) и изчерпване на DA и 5-НТ (Gygi et al. 1997, Gygi et al. 1996, Sparago et al. 1996). Проучванията с ПЕТ-изображения при абстинентни употребяващи метатинон разкриват намалена плътност на стриатичния DAT, което предполага загуба на DA терминали (McCann et al. 1998). Едновременното стимулиране на освобождаването на DA и инхибирането на неговото усвояване отразяват критичните елементи, лежащи в основата на невротоксичността, свързана с метамфетамина (Kuhn et al. 2008, Yamamoto and Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Ние (Angoa-Perez et al. 2012) и други (Baumann et al. 2012, Hadlock et al. 2011) наскоро проучихме възможността мефедронът да предизвиква невротоксичност като метамфетамина и MDMA. Изненадващо, мефедронът не е токсичен за DA нервните окончания на стриатума (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Въпросът дали мефедронът уврежда нервните окончания на 5-HT остава нерешен, тъй като едно проучване документира положителни ефекти (Hadlock et al. 2011), а друго е отрицателно (Baumann et al. 2012). В светлината на относително благоприятния ефект на мефедрона върху DA нервните окончания и като се имат предвид свойствата му като DAT блокер, ние предположихме, че той всъщност би могъл да защити DA невронната система от невротоксичните ефекти на метамфетамина, както е известно, че се случва с други DAT блокери като амфонеловата киселина (Pu et al. 1994, Schmidt and Gibb 1985, Marek et al. 1990) и номифензина (Poth et al. 2012). В настоящия доклад съобщаваме, че мефедронът значително засилва невротоксичността на метамфетамина. Този ефект се разпростира и върху амфетамина и MDMA - наркотици, които често се употребяват съвместно с мефедрон (Feyissa and Kelly 2008, Schifano et al. 2011). Тези изненадващи резултати поставят злоупотребата с мефедрон в нова светлина и придават спешност на признаването на това фино и опасно свойство на този β-кетоамфетамин.
Материали и методи
Наркотици и реактиви
Мефедроновият хидрохлорид и 3,4-метилендиоксиметамфетаминът (MDMA) бяха получени от Програмата за снабдяване с наркотици на NIDA Research Resources. (+) Метамфетамин хидрохлорид, номифензин малеат, d-амфетамин сулфат, пентобарбитал, DA и всички буфери и HPLC реагенти са закупени от Sigma-Aldrich (St. Louis, MO, USA). Комплектите за анализ на белтъчини с бицинхонинова киселина са получени от Pierce (Rockford, IL, USA). Поликлоналните антитела срещу TH на плъхове са произведени, както е описано по-рано (Kuhn and Billingsley 1987). Моноклоналните антитела срещу DAT на плъхове бяха щедро предоставени от д-р Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA). HRP-конюгираните анти-IgG вторични антитела бяха предоставени от Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA).
Животни
Женски мишки C57BL/6 (Harlan, Indianapolis, IN, USA) с тегло 20-25 g по време на експеримента бяха настанени по 5 в клетка в големи клетки тип "кутия за обувки" в светло (12 часа светлина/тъмнина) и температурно контролирано помещение. Използвани са женски мишки, тъй като е известно, че те са много чувствителни към увреждане на невроните от невротоксичните амфетамини, и за да се запази съгласуваността с предишните ни изследвания на невротоксичността на метамфетамина (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). Мишките имаха свободен достъп до храна и вода. Институционалният комитет за грижи и използване на животни на Държавния университет Уейн одобри грижите за животните и експерименталните процедури. Всички процедури бяха в съответствие и с Ръководството на NIH за грижа и използване на лабораторни животни.
Фармакологични, физиологични и поведенчески процедури
Мишките бяха третирани с мефедрон по схема, наподобяваща пиянство, състояща се от 4 инжекции от 10, 20 или 40 mg/kg с интервал от 2 часа между всяка инжекция. Този режим на лечение, когато се използва за инжектиране на заместени амфетамини и производни на катинона, води до обширно увреждане на крайните части на DA нервите. Дозите мефедрон, използвани понастоящем, са показали преди това, че не са токсични за DA нервните окончания (Angoa-Perez et al. 2012). Мишките са третирани с метамфетамин (4Х 2,5 или 5 mg/kg), амфетамин (4Х 5 mg/kg) или MDMA (4Х 20 mg/kg) самостоятелно или в комбинация с мефедрон. Когато са третирани с две лекарства, мишките са получили инжекция с мефедрон 30 минути преди всяка от 4-те инжекции с метамфетамин, амфетамин или MDMA. Контролните мишки получават инжекции с физиологичен разтвор по същата схема, използвана за мефедрон самостоятелно или в комбинация с други амфетамини. Като контрол за ефектите на инхибитора на DAT върху токсичността на метамфетамина, мишките са третирани с номифензин (4Х 5 mg/kg) 30 минути преди всяко инжектиране на метамфетамин (4Х 5 mg/kg). Всички инжекции са направени по i.p. път. Мишките бяха умъртвени 2 дни след последното третиране с лекарството, когато невротоксичността, свързана с амфетамина, е достигнала максимума си. Телесната температура беше наблюдавана чрез телеметрия с помощта на имплантируеми температурни транспондери IPTT-300 на Bio Medic Data Systems, Inc (Seaford, DE, USA). Температурата се записваше неинвазивно на всеки 20 минути, като се започваше 60 минути преди първото инжектиране на METH и се продължаваше 9 часа след това с помощта на конзолната система DAS-5001 от Bio Medic.
Определяне на стриаталното съдържание на DA
Стриаталната тъкан беше разрязана двустранно от мозъка след третирането и съхранена при -80 °C. Замразените тъкани бяха претеглени и сонирани в 10 обема 0,16 N перхлорна киселина при 4°C. Неразтворимият протеин е отстранен чрез центрофугиране и DA е определен чрез HPLC с електрохимична детекция, както е описано по-рано за метамфетамин (Thomas et al. 2010, Thomas et al, 2009).
Определяне на нивата на протеините TH и DAT чрез имуноблотинг
Ефектите от третирането с лекарствата върху нивата на TH и DAT в стриатума бяха определени чрез имуноблотинг като индекс на токсичност за стриатумните DA нервни окончания. Мишките бяха умъртвени чрез обезглавяване след третиране и стриатумът беше разрязан двустранно. Тъканта е съхранявана при -80°C. Замразената тъкан е разрушена чрез сониране в 1% SDS при 95°C и неразтворимият материал е утаен чрез центрофугиране. Протеинът беше определен по метода на бицинхониновата киселина и равни количества протеин (70 μg/лан) бяха разграничени чрез SDS-полиакриламидна гел-електрофореза и след това електроблотирани върху нитроцелулоза. Блотовете бяха блокирани в Трис буфериран физиологичен разтвор, съдържащ Tween 20 (0,1 % v/v) и 5 % обезмаслено сухо мляко за 1 час при стайна температура. Първичните антитела срещу TH (1:1000) или DAT (1:1000) се добавят към блотовете и се оставят да се инкубират за 16 часа при 4°C. Блотовете се промиват 3 пъти в Трис-буфериран физиологичен разтвор, за да се отстранят нереагиралите антитела, и след това се инкубират с HRP-конюгирано анти-IgG вторично антитяло (1:4000) за 1 h при стайна температура. Имунореактивните ленти се визуализират чрез засилена хемилуминисценция и относителната плътност на TH- и DAT-реактивните ленти се определя чрез визуализация с Kodak Image Station (Carestream Molecular Systems, Rochester, NY, USA) и се определя количествено с помощта на софтуера ImageJ (NIH).
Анализ на данните
Бяха извършени двупосочни ANOVA за анализ на ефектите на дозата на метамфетамина спрямо мефедрона върху DA, DAT и TH. Ефектите на лекарствените третирания върху стриаталното съдържание на DA, TH и DAT бяха тествани за значимост чрез еднопосочен ANOVA, последван от тест за множествено сравнение на Tukey. Резултатите от третирането с лекарства върху температурата на ядрото на тялото във времето бяха анализирани с помощта на двупосочен ANOVA, последван от теста на Бонферони, за да се определи значимостта на разликите в температурата в отделните моменти след третирането. Разликите се считаха за значими, ако р < 0,05. Всички статистически анализи бяха извършени с помощта на GraphPad Prism версия 5.02 за Windows (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Отидете на:
Резултати
Ефекти на мефедрона върху индуцираната от метамфетамин невротоксичност
Мефедрон в дози (10, 20 или 40 mg/kg), за които е известно, че не предизвикват токсичност на DA нервните окончания (Angoa-Perez et al. 2012), е прилаган 30 минути преди всяко инжектиране на метамфетамин. Метамфетаминът беше приложен в дози, които причиняват умерено (4Х 2,5 mg/kg) или тежко (4Х 5 mg/kg) увреждане на DA нервните окончания на стриатума (Thomas et al. 2004, Thomas et al. 2010). Резултатите, представени на фиг. 1, показват, че основните ефекти на дозата метамфетамин (F1,40 = 66,60, p < 0,0001) и дозата мефедрон (F4,40 = 131,3, p < 0,0001) върху нивата на DA в стриатума са силно значими чрез двупосочен ANOVA. Основният ефект на мефедрона, даден в комбинация с 2,5 mg/kg (F4,22 = 35,96, p < 0,001) или 5,0 mg/kg метамфетамин (F4,17 = 953,9, p < 0,0001), също е силно значим чрез еднопосочен ANOVA. Всички третирания с която и да е от дозите метамфетамин ± мефедрон предизвикват значително по-голямо намаляване на DA в сравнение със съответната контрола (p < 0,0001 за всички). На фиг. 1 се вижда също, че дозите мефедрон от 20 (p < 0,01) и 40 mg/kg (p < 0,001) значително засилват изчерпващите ефекти на 2,5 mg/kg метамфетамин върху DA, докато всички дози мефедрон значително засилват ефектите на 5,0 mg/kg метамфетамин върху нивата на DA (p < 0,0001 за всички).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/sywobkqrnd-jpg.47/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Фиг.1
Ефекти на мефедрона върху индуцираното от метамфетамин намаляване на стриатичния DA. Мишките са третирани с посочените дози мефедрон (MEPH) 30 мин. преди всяко инжектиране на 2,5 (-) или 5,0 mg/kg (■) метамфетамин (METH) и са умъртвени 2 г. по-късно за определяне на стриаталните нива на DA чрез HPLC. Данните са средни ± SEM за 5-7 мишки от група. Някои стълбчета за грешка са били твърде малки, за да надхвърлят размера на символите, и не се виждат. ***p < 0,001 спрямо контролите и #p < 0,01, ##p < 0,001 или ###p < 0,0001 спрямо съответната доза метамфетамин (тест за множествено сравнение на Tukey).
Фиг. 2а показва, че мефедронът значително увеличава индуцираното от метамфетамин намаляване на нивата на DAT, както е определено чрез имуноблотинг. Имуноблотовете бяха количествено оценени и в съгласие с резултатите за DA, основните ефекти на дозата метамфетамин (F1,92 = 9,48, p < 0,001) и дозата мефедрон (F4,92 = 37,56, p < 0,0001) върху нивата на DAT в стриатума бяха силно значими чрез двупосочен ANOVA (фиг. 2б). Основният ефект на мефедрона, даден в комбинация с 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) или 5,0 mg/kg метамфетамин (F4,39 = 24,84, p < 0,0001), също беше силно значим чрез еднопосочен ANOVA. Всички третирания с която и да е от дозите метамфетамин ± мефедрон предизвикват значително по-голямо намаляване на DAT в сравнение със съответната контрола (p < 0,01 за 2,5 mg/kg само метамфетамин; p < 0,0001 за всички останали третирания). Фиг. 2б показва също, че дозите мефедрон от 20 mg/kg (p < 0,01) и 40 mg/kg (p < 0,001) значително засилват намаленията на DAT, причинени от 2,5 mg/kg метамфетамин, докато само дозата мефедрон от 40 mg/kg значително засилва (p < 0,01) ефекта на 5,0 mg/kg метамфетамин върху намаленията на DAT.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/bfu3sx5dnr-jpg.4797/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Фиг.2
Ефекти на мефедрона върху индуцираните от метамфетамин намаления на стриатичния DAT. Мишките са третирани с посочените дози мефедрон (MEPH) 30 мин. преди всяко инжектиране на 2,5 (●) или 5,0 mg/kg (■) метамфетамин (METH) и са умъртвени 2 г. по-късно за определяне на стриаталните нива на DAT чрез имуноблотинг (а). Блотовете са количествено оценени с помощта на ImageJ и данните са средни ± SEM за 10-12 мишки от група (б). *p < 0,01 или ***p < 0,0001 спрямо контролата (C) и #p < 0,01 или ##p < 0,001 спрямо съответната доза метамфетамин (тест за множествено сравнение на Tukey).
Фиг. 3а показва, че мефедронът значително увеличава индуцираното от метамфетамин намаляване на нивата на TH, както е определено чрез имуноблотинг. Имуноблотовете бяха количествено оценени и в съгласие с резултатите по-горе за DA и DAT, основните ефекти на дозата метамфетамин (F1,81 = 47,89, p < 0,0001) и дозата мефедрон (F4,81 = 63,57, p < 0,0001) бяха силно значими чрез двупосочен ANOVA (фиг. 3б). Основният ефект на мефедрона, даден в комбинация с 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) или 5,0 mg/kg метамфетамин (F4,49 = 99,16, p < 0,0001), също е силно значим чрез еднопосочен ANOVA. Всички третирания с която и да е от дозите на метамфетамин ± мефедрон предизвикват значително по-голямо намаляване на ТН в сравнение със съответната контрола (p < 0,001 за 2,5 mg/kg метамфетамин + 10 mg/kg мефедрон; p < 0,0001 за всички останали комбинации) с изключение само на 2,5 mg/kg метамфетамин, който не променя значително нивата на ТН (т.е. няма токсичност). Фиг. 3б показва също така, че дози мефедрон от 20 mg/kg (p < 0,01) и 40 mg/kg (p < 0,001) значително засилват намаляването на ТН, причинено от 2,5 mg/kg метамфетамин, и всичките три дози мефедрон значително (p < 0,0001) засилват ефекта на 5,0 mg/kg метамфетамин върху намаляването на ТН.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/tggfrjpqru-jpg.4798/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Фиг. 3
Ефекти на мефедрона върху индуцираните от метамфетамин намаления на стриатичния TH. Мишките са третирани с посочените дози мефедрон (MEPH) 30 мин. преди всяко инжектиране на 2,5 (●) или 5,0 mg/kg (■) метамфетамин (METH) и са умъртвени 2 г. по-късно за определяне на стриаталните нива на TH чрез имуноблотинг (а). Блотовете са количествено оценени с помощта на ImageJ и данните са средни ± SEM за 10-12 мишки от група (б). Някои стълбчета за грешка са били твърде малки, за да надхвърлят размера на символите, и не се виждат. **p < 0,001 или ***p < 0,0001 спрямо контролата (C) и #p < 0,01, ##p < 0,001 или ###p < 0,0001) спрямо съответната доза метамфетамин (тест за множествено сравнение на Tukey).
Ефекти на мефедрона върху предизвиканата от метамфетамин хипертермия
Мефедронът, подобно на метамфетамина, предизвиква значителна хипертермия (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Когато мефедронът се дава 30 мин. преди всяко инжектиране на метамфетамин, на фиг. 4 се вижда, че основните ефекти на дозите метамфетамин и мефедрон (F1,300 = 11,99, p < 0,0001) върху времето (F4,300 = 51,73, p < 0,0001) са силно значими чрез двупосочен ANOVA. Основните ефекти на мефедрон, приложен в комбинация с 2,5 mg/kg метамфетамин (F4,120 = 41,44, p < 0,0001, панел а) във времето (F30,120 = 3,84, p < 0,0001) или 5,0 mg/kg метамфетамин (F4,120 = 78,09, p < 0,0001, панел б) във времето (F30,120 = 9,98, p < 0,0001), също са силно значими чрез двупосочен ANOVA. Всички третирания с която и да е от дозите метамфетамин ± мефедрон се различават значително от съответните контроли (p < 0,0001 за всички третирания).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/x0ik9hdwsw-jpg.4799/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Фиг. 4
Ефекти на мефедрона върху индуцираната от метамфетамин хипертермия. Мишките са третирани с посочените дози мефедрон (MEPH) 30 минути преди всяко инжектиране на 2,5 (а) или 5,0 mg/kg (б) метамфетамин (METH). Температурата на ядрото се измерва на интервали от 20 минути чрез телеметрия, като се започва 60 минути преди първото инжектиране на метамфетамин. Четирите инжекции с метамфетамин са отбелязани със стрелките, разположени върху оста x. Данните са изразени като средна телесна температура на 6-8 мишки от група. SEM са винаги < 10 % от средната стойност и са пропуснати за по-голяма яснота.
Ефекти на мефедрона върху индуцираната от амфетамин и MDMA невротоксичност
За да се провери дали засилващите ефекти на мефедрона върху метамфетамина могат да се разпространят и върху други невротоксични амфетамини, мишките бяха третирани с този β-кетоамфетамин (20 mg/kg) плюс амфетамин (4X 5 mg/kg) или MDMA (4X 20 mg/kg) и резултатите са представени на фигура 5. Припомняме, че самият мефедрон не намалява стриаталните DA, DAT или TH (Angoa-Perez et al. 2012). Основният ефект на лекарството (F5,27 = 27,18, p < 0,0001) е силно значим чрез еднопосочен ANOVA за намаляване на DA (фиг. 5а). На фиг. 5а се вижда също, че всички третирания с амфетамин (p < 0,001) или MDMA (p < 0,001) самостоятелно или в комбинация с мефедрон (p < 0,0001 и за двете лекарства) значително понижават нивата на DA спрямо контролата. Мефедронът значително засилва намаленията на DA, причинени от амфетамин (p < 0,01) или MDMA (p < 0,01). Фиг. 5б показва подобни ефекти на комбинираното лечение с лекарства върху нивата на DAT в стриатума. Основният ефект на лекарството (F4,49 = 42,63, p < 0,0001) е силно значим чрез еднопосочен ANOVA за DAT. На фиг. 5б се вижда също, че при всички третирания с амфетамин или MDMA стойностите на DATAT са значително (p < 0,0001 за всички) по-ниски в сравнение с контролата. Мефедронът също значително увеличава намаленията на DAT, причинени от амфетамин или MDMA (p < 0,0001 и в двата случая). И накрая, фиг. 5в показва, че основният ефект на лекарството (F4,50 = 75,06, p < 0,0001) е силно значим чрез еднопосочен ANOVA за намаленията на ТХ. На фиг. 5в се вижда също така, че всички третирания с амфетамин или MDMA са били значително (p < 0,0001 за всички) по-ниски в сравнение с контролата. Мефедронът също така значително увеличава намаленията на TH, причинени от амфетамин или MDMA (p < 0,0001 и в двата случая)
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/onvypkgxvn-jpg.4800/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Фиг. 5
Ефекти на мефедрона върху невротоксичността на DA нервните окончания, предизвикана от амфетамин или MDMA. Мишките са третирани с 20 mg/kg мефедрон (MEPH) 30 минути преди всяко инжектиране на 5,0 mg/kg амфетамин (AMPH) или 20 mg/kg MDMA и са умъртвени 2d след третирането за определяне на стриаталните нива на (a) DA чрез HPLC. (б) DAT и (в) TH бяха определени чрез имуноблотинг и блотовете бяха количествено оценени с помощта на ImageJ. Представителни имуноблотове за DAT и TH са включени като вложки съответно в панели (б) и (в), а третиранията за двата панела са обозначени с 1,5: контрола; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; и 8: MDMA + MEPH. Данните са средни ± SEM за 5-12 мишки във всяка група. **p < 0,001 или ***p < 0,0001 спрямо контролата и #p < 0,01 или ###p < 0,0001 спрямо AMPH или MDMA (тест за множествено сравнение на Tukey).
Ефекти на номифензин върху индуцираната от метамфетамин невротоксичност
Номифензинът, мощен блокер на DAT без известен потенциал за злоупотреба или невротоксичност, е тестван за способността му да предпазва от метамфетамин-индуцирана невротоксичност и за контраст с действието на мефедрона върху токсичността на DA нервните окончания, причинена от метамфетамин, амфетамин и MDMA. Резултатите на фиг. 6а показват, че основният ефект на лекарството (F3,16 = 63,39, p < 0,0001) върху нивата на DA е силно значим чрез еднопосочен ANOVA. Номифензинът самостоятелно не променя нивата на DA, но намалението, причинено от метамфетамин (p < 0,0001), е леко, но значително обърнато от номифензина (p < 0,01). Основният ефект на лекарството (F3,20 = 16,78, p < 0,0001) върху нивата на ДАТ е силно значим чрез еднопосочен ANOVA, както е показано на фиг. 6б. Номифензинът не променя нивата на DAT, но осигурява значителна защита (p < 0,001) срещу намаляването на стриаталния DAT, причинено от метамфетамин (p < 0,0001) в сравнение с контролата. И накрая, фиг. 6в показва, че основният ефект на лекарството (F3,15 = 14,10, p < 0,0001) върху нивата на ТХ е силно значим чрез еднопосочен ANOVA. Както се вижда за DA и DAT, намаляването на TH, причинено от метамфетамин (p < 0,0001), е слабо, но значително предотвратено от номифензин (p < 0,01).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/daczg9cwfv-jpg.4801/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Фиг. 6
Ефекти на номифензин върху невротоксичността на DA нервните окончания, предизвикана от метамфетамин. Мишките са третирани с 5,0 mg/kg номифензин (NOM) 30 мин. преди всяко инжектиране на 5,0 mg/kg метамфетамин (METH) и са умъртвени 2d по-късно за определяне на стриаталните нива на (а) DA чрез HPLC. (б) DAT и (в) TH бяха определени чрез имуноблотинг и блотовете бяха количествено оценени с помощта на ImageJ. Представителни имуноблотове за DAT и TH са включени като вложки в панели (б) и (в). Данните са средни плюс SEM за 5-7 мишки от група. ***p < 0,0001 спрямо контролата (С) и #p < 0,01 или ##p < 0,001 спрямо самия метамфетамин (тест за множествено сравнение на Tukey).
Обсъждане
Целта на настоящото проучване беше да се определи дали мефедронът ще предотврати токсичността на DA нервните окончания, причинена от метамфетамин. Въз основа на химическото му сходство с метамфетамина и MDMA първоначално се очакваше, че мефедронът ще окаже вредно въздействие върху DA невронната система. Няколко проучвания обаче почти едновременно установиха, че мефедронът не е токсичен за DA нервните окончания (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Въпросът дали това лекарство причинява увреждане на 5-HT невронната система остава открит. В едно проучване се съобщава за трайно намаляване на функцията на 5-HT нервните окончания (Hadlock et al. 2011), докато в друго се установява, че мефедронът не причинява увреждане (Baumann et al. 2012). Мефедронът взаимодейства с нервното окончание на DA по начин, който предполага, че той наистина стимулира освобождаването и блокира обратното поемане на DA чрез взаимодействието си с DAT. Ключов аспект на невротоксичния механизъм на действие на метамфетамина е способността му да получи достъп до DA нервните окончания чрез DAT и да наруши хомеостазата на DA (Sulzer 2011). Ако тази ранна стъпка в невротоксичната каскада на метамфетамина се предотврати чрез инхибиране на DAT, токсичността се предотвратява (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt and Gibb 1985). Предположихме, че мефедронът би могъл да има същото защитно свойство като другите инхибитори на DAT, но вместо това наблюдавахме значително засилване на токсичността. Това взаимодействие беше наблюдавано при използване на две различни дози метамфетамин, които причиняват умерено или тежко увреждане на DA нервните окончания (съответно 4Х 2,5 или 5,0 mg/kg). Този потенциращ ефект на мефедрона не се ограничава само до метамфетамина и се разпростира и върху амфетамина и MDMA - два наркотика, които често се употребяват съвместно с мефедрон и други β-кетоамфетамини (Feyissa and Kelly 2008, Schifano et al. 2011, Kelly 2011). Следователно въпреки факта, че мефедронът не причинява токсичност поне на DA нервните окончания на стриатума, той потенцира невротоксичните ефекти на други наркотици за злоупотреба. Това ново откритие би трябвало да постави злоупотребата с мефедрон в още по-остра светлина, тъй като липсата на присъща невротоксичност може да го направи да изглежда безобиден.
Хипертермията е често съобщаван остър неблагоприятен ефект от приема на метамфетамин (Greene et al. 2008) и β-кетоамфетамин при хора (Borek and Holstege 2012, Prosser and Nelson 2012). Подобно на метамфетамина, много от наркотиците, съдържащи β-кетоамфетамин, също предизвикват значително повишаване на температурата на ядрото при гризачи (Angoa-Perez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Въпреки че хипертермията, причинена от метамфетамина, може да допринесе за неговите морфологични и увреждащи невроните ефекти, не е задължително хипертермията да е пряката причина за тези ефекти (Kiyatkin and Sharma 2009). Регистрирахме температурата на ядрото на тялото при мишки, третирани с мефедрон и метамфетамин, и наблюдавахме, че комбинираното третиране не е повишило температурата над максималните увеличения, наблюдавани след употребата на всяко от двете лекарства самостоятелно. Метамфетаминът предизвика свързано с дозата повишаване на телесната температура и тази хипертермия беше инвариантна в целия тестван диапазон на дозите мефедрон. Всъщност спадът на телесната температура след инжектиране, наблюдаван след лечение с мефедрон (Angoa-Perez et al. 2012), се е запазил и при по-високите дози мефедрон плюс метамфетамин. Въпреки че предизвиканата от лекарството хипертермия не се е засилила при комбинирано лечение с лекарства, невротоксичните ефекти са били адитивни. Следователно, поне в настоящия случай, изглежда, че невротоксичните ефекти на метамфетамина могат да бъдат засилени от мефедрон по начин, който не зависи от хипертермията.
Мефедронът ясно инхибира функцията на DAT и блокира повторното поемане на DA in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). Мефедронът измества WIN-35,428 от мястото му на свързване върху DAT, което предполага, че той е конкурентен инхибитор на усвояването на DA (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). Силата на мефедрона в това отношение е много сходна с тази на метамфетамина (Cozzi et al. 1999) и MDMA (Escubedo et al. 2011). Не е известно дали мефедронът се транспортира от DAT, но метатинонът се транспортира (Cozzi and Foley 2003). Номифензинът и амфонеловата киселина, които се свързват с DAT и инхибират усвояването на DA, осигуряват значителна защита срещу невротоксичност, предизвикана от метамфетамин (Pu et al. 1994, Marek et al. 1990, Schmidt and Gibb 1985, Poth et al. 2012), а мишките, при които липсва DAT, са устойчиви на невроналната токсичност на метамфетамина (Fumagalli et al. 1998). Знанието, че мефедронът не е невротоксичен и е блокер на DAT, води до прогнозата, че той би трябвало да предотврати токсичността. В тази връзка тествахме номифензин като положителна контрола и потвърдихме, че той предпазва от индуцираното от метамфетамин изчерпване на DA, DAT и TH. Номифензинът също така инхибира норепинефриновия транспортер (Brogden et al. 1979), но това свойство не може да обясни настоящите резултати, тъй като повечето β-кетоамфетамини, включително мефедронът, инхибират норепинефриновия транспортер и блокират усвояването на норепинефрин (Kelly 2011, Rothman et al. 2003, Cozzi et al. 1999, Sogawa et al. 2011, Lopez-Arnau et al. 2012). Ролята на 5-HT невронната система в някои от фармакологичните действия на мефедрона е възможна в светлината на способността на това лекарство, подобно на MDMA (Yamamoto et al. 1995), да предизвиква изтичане на стриатален DA чрез взаимодействието си с 5-HT2A рецепторите (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). Хиперлокомоцията, причинена от мефедрон, зависи от ендогенния 5-HT (Lopez-Arnau et al. 2012) и това лекарство също така стимулира освобождаването на 5-HT и инхибира неговото усвояване in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) и in vivo (Baumann et al. 2012, Kehr et al. 2011). Въпреки това можем да изключим ролята на ендогенния 5-HT в DA невротоксичността поне на метамфетамина, като покажем, че мишки, генетично лишени от 5-HT, запазват чувствителността си към невротоксичност (Thomas et al. 2010).
Мефедронът би могъл да засили невротоксичността на метамфетамина по няколко възможни механизма. Първо, мефедронът би могъл да взаимодейства с VMAT, за да предизвика изтичане на DA в цитоплазмата на пресинаптичното нервно окончание. Третирането, което увеличава цитоплазмения пул (т.е. освобождаващия се от лекарството) DA, увеличава невротоксичността на метамфетамина (Thomas et al. 2008, Thomas et al. 2009, Schmidt et al. 1985). Този механизъм е малко вероятен, тъй като метатинонът взаимодейства слабо с VMAT (Cozzi et al. 1999). Второ, комбинацията от мефедрон плюс метамфетамин би могла да има синергичен ефект върху невесикуларното освобождаване на DA, но тази възможност също изглежда малко вероятна в светлината на резултатите, показващи, че третирането на DAT- или SERT-експресиращи CHO клетки с мефедрон плюс метамфетамин няма адитивен ефект върху освобождаването на DA или 5-HT (Sogawa et al. 2011). Трето, мефедронът може да взаимодейства с DAT по нов начин, който допринася за адитивната токсичност. Доказано е, че мефедонът в комбинация с метамфетамин предизвиква синергична цитотоксичност в CHO клетки, експресиращи DAT или SERT, но не и в CHO клетки от див тип, в които липсват транспортерите (Sogawa et al. 2011). Цитотоксичността, наблюдавана при култивираните клетки в тези изследвания (т.е. освобождаването на LDH), е много различна от увреждането на DA нервните окончания, причинено от метамфетамин, но този механизъм предполага интересна, но неопределена роля на DAT в засилената цитотоксичност. На последно място, мефедронът може да промени метаболизма на метамфетамина. Мефедронът се метаболизира предимно чрез N-деметилиране (Meyer and Maurer 2010), както и метамфетаминът и MDMA (Caldwell 1976). Подкрепа за този механизъм идва от демонстрацията, че метамфетаминът и MDMA взаимно потискат производството на съответните си първични метаболити и повишават плазмените нива на наркотиците над тези, наблюдавани след самостоятелно приложение на всеки от тях (Kuwayama и кол. 2012 г.). Дозите мефедрон, използвани понастоящем и в предишното ни проучване (Angoa-Perez et al. 2012), макар и високи, не са невротоксични и попадат в диапазона, с който злоупотребяват хората (McErath and O'Neill 2011). Следователно мефедронът би могъл да действа подобно на MDMA за повишаване на плазмените нива на метамфетамина, като инхибира неговия метаболизъм. За потвърждаване на тази последна възможност ще е необходим задълбочен фармакокинетичен анализ.
Злоупотребата с β-кетоамфетамини нараства с тревожни темпове и мефедронът понастоящем е един от най-често употребяваните наркотици след канабиса, MDMA и кокаина (Morris 2010, Winstock et al. 2011b). Освен това мефедронът предизвиква по-силно чувство на глад при хората в сравнение с MDMA (Brunt et al. 2011), а употребяващите, които смъркат мефедрон, го оценяват като по-пристрастяващ от кокаина (Winstock et al. 2011b). Мефедронът се употребява от хората по начин, подобен на натравяне (т.е. "stacking"), и често се приема с други наркотици, като канабис и амфетаминовите психостимуланти (Schifano et al. 2011 г., Fass et al. 2012 г., Winstock et al. 2011a, Kelly 2011 г., Torrance and Cooper 2010 г.). Мефедронът се среща все по-често в таблетки, продавани като MDMA (Brunt et al. 2011 г.), и употребата му вероятно ще надмине тази на MDMA, тъй като чистотата на последния наркотик продължава да спада (Brunt et al. 2011 г., Tanner-Smith 2006 г., Teng et al. 2006 г.). Въз основа на често срещаните модели на злоупотреба с мефедрон и други съставки на "солите за вана" е важно да се обмисли дали се натрупват допълнителни рискове за здравето на хората, когато тези наркотици се комбинират с амфетамини умишлено или неволно. Нашите резултати, показващи, че поне мефедронът значително засилва невротоксичността на DA нервните окончания на стриатума, причинена от метамфетамин, амфетамин и MDMA, разкриват особено опасно и неочаквано свойство на този β-кетоамфетамин.
Използвани съкращения
5-HT серотонин
DA допамин
DAT DA транспортер
MDMA 3,4-метилендиоксиметамфетамин
TH тирозин хидроксилаза
VMAT везикуларен моноаминов транспортер