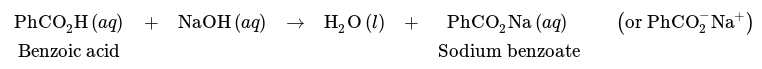G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,654
- Solutions
- 3
- Reaction score
- 2,732
- Points
- 113
- Deals
- 1
Θεωρία της εκχύλισης.
Ο όρος "εκχύλιση" αναφέρεται στη μεταφορά ένωσης(ων) από ένα στερεό ή υγρό σε διαφορετικό διαλύτη ή φάση. Όταν ένα φακελάκι τσαγιού προστίθεται σε ζεστό νερό, οι ενώσεις που είναι υπεύθυνες για τη γεύση και το χρώμα του τσαγιού εκχυλίζονται από το τσάι στο νερό. Ο καφές χωρίς καφεΐνη παρασκευάζεται με τη χρήση διαλυτών ή υπερκρίσιμου διοξειδίου του άνθρακα για την εξαγωγή της καφεΐνης από τους κόκκους καφέ. Στο εργαστήριο χημείας, συνηθέστερα χρησιμοποιείται η εκχύλιση υγρού-υγρού, μια διαδικασία που πραγματοποιείται σε διαχωριστικό χωνί. Ένα διάλυμα που περιέχει διαλυμένα συστατικά τοποθετείται στο χωνί και προστίθεται ένας μη αναμίξιμος διαλύτης, με αποτέλεσμα να δημιουργούνται δύο στρώματα που ανακινούνται μαζί. Είναι πιο συνηθισμένο το ένα στρώμα να είναι υδατικό και το άλλο οργανικός διαλύτης. Τα συστατικά "εκχυλίζονται" όταν μετακινούνται από το ένα στρώμα στο άλλο. Το σχήμα του διαχωριστικού χωνιού επιτρέπει την αποτελεσματική αποστράγγιση και το διαχωρισμό των δύο στρωμάτων.
Σχήμα 1. Σχηματική απεικόνιση της εκχύλισης

Οι ενώσεις μετακινούνται από το ένα υγρό στο άλλο ανάλογα με τη σχετική διαλυτότητά τους σε κάθε υγρό. Ένας γρήγορος οδηγός για τη διαλυτότητα είναι η αρχή "όμοιες διαλύονται όμοιες", που σημαίνει ότι οι μη πολικές ενώσεις πρέπει να εκχυλίζονται εύκολα σε μη πολικούς διαλύτες (και αντίστροφα). Οι ενώσεις που είναι υπεύθυνες για τη γεύση και το χρώμα του τσαγιού πρέπει να είναι πολικές αν εκχυλίζονται εύκολα σε ζεστό νερό. Όταν αφήνεται να εξισορροπηθεί μεταξύ δύο υγρών σε ένα διαχωριστικό χωνί, η πλειοψηφία μιας ένωσης συχνά καταλήγει στο στρώμα που είναι πιο διαλυτό.
Εικ.2

Διαδικασίες εκχύλισης βήμα προς βήμα.
Εκχύλιση υγρού-υγρού
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/threads/extraction.553/
Ενιαία εκχύλιση.
Οι εικόνες αυτής της ενότητας δείχνουν μια απλή εκχύλιση του κόκκινου μεθυλίου (έγχρωμη ένωση, Εικ. 3) από υδατικό διάλυμα (κάτω στρώμα) σε 25 ml οξικού αιθυλεστέρα (άνω στρώμα). Το υδατικό διάλυμα έχει αρχικά ροζ χρώμα, καθώς το ερυθρό του μεθυλίου εμφανίζεται κόκκινο σε όξινο διάλυμα (το υδατικό διάλυμα παρασκευάστηκε από 50 ml νερού, 5 σταγόνες 0,1MHCl και 5 σταγόνες 1% διαλύματος δείκτη ερυθρού του μεθυλίου). Το ερυθρό του μεθυλίου έχει μεγάλο συντελεστή κατανομής και εκχυλίζεται από το υδατικό στρώμα στο οξικό αιθυλεστέρα κατά τη διαδικασία αυτή.
Πρόοδος της εκχύλισης του ερυθρού του μεθυλίου (η έγχρωμη ένωση) από το όξινο υδατικό στρώμα (κάτω) στο οργανικό στρώμα (πάνω). Οι ανατροπές έγιναν αργά, ώστε να φαίνεται η εκχύλιση σταδιακά. Ακόμη και με ήπια ανάμιξη, το κόκκινο του μεθυλίου εκχυλίζεται γρήγορα.


Προετοιμάστε τη ρύθμιση (για μεμονωμένη εξαγωγή)
1. Προμηθευτείτε ένα διαχωριστικό χωνί (Εικ. 4 α).- α) Εάν το διαχωριστικό χωνί διαθέτει κρουνό από τεφλόν, συναρμολογήστε ξανά τον κρουνό, εάν είχε αποσυναρμολογηθεί για να στεγνώσει, τοποθετώντας τα μέρη με την κατάλληλη σειρά (Εικ. 4 β). Βεβαιωθείτε ότι το πώμα από τεφλόν είναι μέτρια σφιγμένο, ώστε να μπορεί ακόμη να περιστρέφεται εύκολα, αλλά δεν είναι τόσο χαλαρό ώστε να μπορεί να διαρρεύσει υγρό γύρω από την ένωση.
- β) Εάν χρησιμοποιείτε γυάλινο βάνδαλο (Εικ. 4 γ), πιθανότατα δεν χρειάζεται περαιτέρω προετοιμασία. Θα πρέπει να χρησιμοποιηθεί ένα πολύ λεπτό στρώμα γράσου για να σφραγιστεί ο κρουνός και να αποφευχθεί το πάγωμα. Εάν υπάρχουν τόσο γυάλινες όσο και τεφλόν στρόφιγγες, η τεφλόν είναι καλύτερη επιλογή, καθώς υπάρχει πάντα η πιθανότητα ο διαλύτης να διαλύσει το γράσο που χρησιμοποιείται με τις γυάλινες στρόφιγγες και να μολύνει το δείγμα.
- γ) Προμηθευτείτε επίσης ένα πώμα (από τεφλόν ή τριμμένο γυαλί) που να εφαρμόζει καλά στον άνω σύνδεσμο του χωνιού (Εικ. 4 α).
2. Τοποθετήστε το διαχωριστικό χωνί σε σφιγκτήρα δακτυλίου που είναι προσαρτημένος σε βάση δακτυλίου ή σε πλέγμα. Τα χωνιά σπάνε εύκολα, γι' αυτό μαξιλαρώστε το χωνί στον μεταλλικό σφιγκτήρα χρησιμοποιώντας κομμάτια σχισμένου ελαστικού ή πλαστικού σωλήνα (Εικ.4 δ).
Προσθέστε τα διαλύματα (για απλή εκχύλιση)
3. Πριν ρίξετε οτιδήποτε σε ένα διαχωριστικό χωνί, βεβαιωθείτε ότι το βουλωτήρι βρίσκεται στην "κλειστή" θέση, όπου το βουλωτήρι είναι οριζόντιο (Εικ. 5 α). Ως δικλείδα ασφαλείας, τοποθετείτε πάντα μια φιάλη Erlenmeyer κάτω από το διαχωριστικό χωνί πριν από την έκχυση (Εικ.5 β). Αυτό μπορεί να συγκρατήσει το υγρό σε περίπτωση που η στρόφιγγα μείνει κατά λάθος ανοιχτή ή αν η στρόφιγγα είναι χαλαρή και το υγρό διαρρεύσει ακούσια.
4. Χρησιμοποιώντας ένα χωνί, ρίξτε το υγρό που πρόκειται να εξαχθεί στο διαχωριστικό χωνί (Εικ. 5 β). Το διαχωριστικό χωνί δεν πρέπει ποτέ να χρησιμοποιείται με ζεστό ή θερμό υγρό. Ο αλεσμένος γυάλινος σύνδεσμος στην κορυφή ενός διαχωριστικού χωνιού είναι πιο επιρρεπής να κολλήσει στο πώμα, εάν υπήρχε υγρό στον σύνδεσμο σε κάποιο σημείο. Με το να ρίχνετε υγρό στο διαχωριστικό χωνί χρησιμοποιώντας ένα χωνί με κοντό στέλεχος αποφεύγετε να βραχεί ο σύνδεσμος, ώστε να είναι λιγότερο πιθανό να παγώσει κατά τη διάρκεια της ανάμιξης.
3. Πριν ρίξετε οτιδήποτε σε ένα διαχωριστικό χωνί, βεβαιωθείτε ότι το βουλωτήρι βρίσκεται στην "κλειστή" θέση, όπου το βουλωτήρι είναι οριζόντιο (Εικ. 5 α). Ως δικλείδα ασφαλείας, τοποθετείτε πάντα μια φιάλη Erlenmeyer κάτω από το διαχωριστικό χωνί πριν από την έκχυση (Εικ.5 β). Αυτό μπορεί να συγκρατήσει το υγρό σε περίπτωση που η στρόφιγγα μείνει κατά λάθος ανοιχτή ή αν η στρόφιγγα είναι χαλαρή και το υγρό διαρρεύσει ακούσια.
4. Χρησιμοποιώντας ένα χωνί, ρίξτε το υγρό που πρόκειται να εξαχθεί στο διαχωριστικό χωνί (Εικ. 5 β). Το διαχωριστικό χωνί δεν πρέπει ποτέ να χρησιμοποιείται με ζεστό ή θερμό υγρό. Ο αλεσμένος γυάλινος σύνδεσμος στην κορυφή ενός διαχωριστικού χωνιού είναι πιο επιρρεπής να κολλήσει στο πώμα, εάν υπήρχε υγρό στον σύνδεσμο σε κάποιο σημείο. Με το να ρίχνετε υγρό στο διαχωριστικό χωνί χρησιμοποιώντας ένα χωνί με κοντό στέλεχος αποφεύγετε να βραχεί ο σύνδεσμος, ώστε να είναι λιγότερο πιθανό να παγώσει κατά τη διάρκεια της ανάμιξης.
Ρίξτε μια ποσότητα του εκχυλιστικού διαλύτη στο διαχωριστικό χωνί, όπως υποδεικνύεται από τη διαδικασία (Εικ. 5 γ). Δεν είναι απαραίτητο να χρησιμοποιούνται ακριβείς ποσότητες διαλύτη για τις εκχυλίσεις και οι όγκοι μπορούν να μετρηθούν σε διαβαθμισμένο κύλινδρο. Εάν μια διαδικασία απαιτεί 20mL διαλύτη, είναι αποδεκτό να χρησιμοποιούνται κάθε φορά 20-25ml.
Ανάμειξη των διαλυμάτων (για απλή εκχύλιση)
6. Τοποθετήστε το πώμα στο χωνί και κρατήστε το χωνί έτσι ώστε τα δάχτυλα του ενός χεριού να καλύπτουν με ασφάλεια το πώμα, ενώ το άλλο χέρι να πιάνει τον πυθμένα του χωνιού (Εικ. 6 α).
7. Αναποδογυρίστε απαλά το χωνί (Εικ. 6 β) και αναδεύστε λίγο το μείγμα. Παρόλο που δεν είναι ασυνήθιστο να εισχωρήσει λίγο υγρό στον σύνδεσμο του γυαλιού εδάφους όταν αναποδογυρίζεται, αυτό θα πρέπει να είναι ελάχιστο. Εάν στάζει υγρό στα δάχτυλα ή στα γάντια σας όταν αναποδογυρίζετε το χωνί, το πώμα είναι πιθανώς λάθος μεγέθους.
Ανάμειξη των διαλυμάτων (για απλή εκχύλιση)
6. Τοποθετήστε το πώμα στο χωνί και κρατήστε το χωνί έτσι ώστε τα δάχτυλα του ενός χεριού να καλύπτουν με ασφάλεια το πώμα, ενώ το άλλο χέρι να πιάνει τον πυθμένα του χωνιού (Εικ. 6 α).
7. Αναποδογυρίστε απαλά το χωνί (Εικ. 6 β) και αναδεύστε λίγο το μείγμα. Παρόλο που δεν είναι ασυνήθιστο να εισχωρήσει λίγο υγρό στον σύνδεσμο του γυαλιού εδάφους όταν αναποδογυρίζεται, αυτό θα πρέπει να είναι ελάχιστο. Εάν στάζει υγρό στα δάχτυλα ή στα γάντια σας όταν αναποδογυρίζετε το χωνί, το πώμα είναι πιθανώς λάθος μεγέθους.
8. Μπορεί να δημιουργηθεί πίεση στο εσωτερικό της διαχωριστικής χοάνης όταν αναμειγνύονται τα διαλύματα, γι' αυτό αμέσως μετά την ανάδευση και με τη χοάνη ακόμα ανεστραμμένη, "εξαερώστε" τη χοάνη ανοίγοντας για λίγο τη στρόφιγγα για να μπορέσει να εκτονωθεί η πίεση (Εικ. 6 γ). Η πίεση αυξάνεται στο χωνί καθώς ο διαλύτης εξατμίζεται στο κεφαλοδιάστημα και συνεισφέρει επιπλέον ατμούς στην αρχική πίεση αέρα ∼1 ατμόσφαιρας στο χωνί. Με ιδιαίτερα πτητικούς διαλύτες (όπως ο διαιθυλαιθέρας), μπορεί να ακουστεί ένα σαφές "σφύριγμα" κατά την εξαέρωση και μικρές ποσότητες υγρού μπορεί ακόμη και να εκτοξευθούν από το βύσμα. Εάν το υγρό εκτοξεύεται από το βάνδαλο, προσπαθήστε να το αφήσετε να στραγγίξει πίσω στο χωνί. Ο θόρυβος που σχετίζεται με την εξαέρωση συνήθως παύει μετά τη δεύτερη ή τρίτη αναστροφή, καθώς το κενό κεφαλής κορεστεί με ατμούς διαλύτη και οι πιέσεις εντός και εκτός της χοάνης εξισωθούν.
Σημείωση ασφαλείας: Ποτέ μην στρέφετε το βουλωτήρα προς κάποιον καθώς εξαερίζετε, καθώς είναι πιθανό να εκτοξευτεί κάποιο υγρό πάνω του.
9. Κλείστε τη στρόφιγγα και αναμείξτε τα διαλύματα λίγο πιο έντονα, σταματώντας περιοδικά για να εξαερώσετε το σύστημα. Υπάρχουν διαφορετικές απόψεις σχετικά με το πόσο έντονα πρέπει να αναμειγνύονται τα διαλύματα σε διαχωριστικά χωνιά και για πόσο χρονικό διάστημα. Ως γενικός οδηγός, μια ήπια ανάμιξη για 10-20 δευτερόλεπτα θα πρέπει να είναι αρκετή. Με ορισμένα διαλύματα (π.χ. διχλωρομεθάνιο), θα πρέπει να δίνεται προσοχή ώστε να μην αναδεύεται πολύ έντονα, καθώς τα διαλύματα αυτά συχνά σχηματίζουν γαλακτώματα (όπου η διεπιφάνεια μεταξύ των διαλυμάτων δεν διασαφηνίζεται). Με διαλύματα επιρρεπή σε γαλακτώματα, το χωνί πρέπει να κουνιέται απαλά για ένα λεπτό.
10. Τοποθετήστε το διαχωριστικό χωνί σε όρθια θέση στον δακτυλιοειδή σφιγκτήρα, ώστε να επιτραπεί ο πλήρης διαχωρισμός των στρωμάτων. Η διεπιφάνεια μεταξύ των στρωμάτων θα πρέπει να καθιζάνει μάλλον γρήγορα, συχνά μέσα σε 10 δευτερόλεπτα περίπου. Εάν η διεπιφάνεια είναι θολή ή δεν είναι καλά καθορισμένη (έχει σχηματιστεί γαλάκτωμα), ανατρέξτε στην ενότητα αντιμετώπισης προβλημάτων για συμβουλές.
Διαχωρισμός των στρωμάτων (για απλή εκχύλιση)
11. Το υγρό δεν αποστραγγίζεται καλά από ένα διαχωριστικό χωνί εάν το πώμα παραμένει τοποθετημένο, καθώς ο αέρας δεν μπορεί να εισέλθει στο χωνί για να αντικαταστήσει το εκτοπισμένο υγρό. Εάν το υγρό στραγγίσει από το χωνί χωρίς να αντικατασταθεί από ίσο όγκο αέρα, θα σχηματιστεί αρνητική πίεση στο χωνί. Συνεπώς, πριν από την αποστράγγιση υγρού από ένα διαχωριστικό χωνί, αφαιρείτε το πώμα (Σχ. 7 α).
12. Στραγγίξτε το μεγαλύτερο μέρος του κάτω στρώματος σε μια καθαρή φιάλη Erlenmeyer, τοποθετώντας τον δακτυλιοειδή σφιγκτήρα έτσι ώστε το άκρο του διαχωριστικού χωνιού να φωλιάζει στη φιάλη Erlenmeyer για να αποφευχθεί η εκτόξευση (Εικ. 7 β). Σταματήστε την αποστράγγιση όταν η διεπιφάνεια βρίσκεται σε απόσταση 1 cm από τον πυθμένα του κρουνού.
13. Αναδεύστε απαλά το χωνί για να απομακρύνετε τυχόν σταγονίδια που προσκολλώνται στο γυαλί (Εικ.7 γ). Μια ράβδος ανάδευσης γυαλιού μπορεί να χρησιμοποιηθεί για να χτυπήσει τα επίμονα προσκολλημένα σταγονίδια.
14. Περαιτέρω, αποστραγγίστε το κάτω στρώμα, σταματώντας όταν η διεπιφάνεια μόλις εισέλθει στο θάλαμο της στρόφιγγας (Εικ.7 δ). Επισημάνετε τη φιάλη Erlenmeyer (π.χ. "στρώμα πυθμένα").
Σημείωση ασφαλείας: Ποτέ μην στρέφετε το βουλωτήρα προς κάποιον καθώς εξαερίζετε, καθώς είναι πιθανό να εκτοξευτεί κάποιο υγρό πάνω του.
9. Κλείστε τη στρόφιγγα και αναμείξτε τα διαλύματα λίγο πιο έντονα, σταματώντας περιοδικά για να εξαερώσετε το σύστημα. Υπάρχουν διαφορετικές απόψεις σχετικά με το πόσο έντονα πρέπει να αναμειγνύονται τα διαλύματα σε διαχωριστικά χωνιά και για πόσο χρονικό διάστημα. Ως γενικός οδηγός, μια ήπια ανάμιξη για 10-20 δευτερόλεπτα θα πρέπει να είναι αρκετή. Με ορισμένα διαλύματα (π.χ. διχλωρομεθάνιο), θα πρέπει να δίνεται προσοχή ώστε να μην αναδεύεται πολύ έντονα, καθώς τα διαλύματα αυτά συχνά σχηματίζουν γαλακτώματα (όπου η διεπιφάνεια μεταξύ των διαλυμάτων δεν διασαφηνίζεται). Με διαλύματα επιρρεπή σε γαλακτώματα, το χωνί πρέπει να κουνιέται απαλά για ένα λεπτό.
10. Τοποθετήστε το διαχωριστικό χωνί σε όρθια θέση στον δακτυλιοειδή σφιγκτήρα, ώστε να επιτραπεί ο πλήρης διαχωρισμός των στρωμάτων. Η διεπιφάνεια μεταξύ των στρωμάτων θα πρέπει να καθιζάνει μάλλον γρήγορα, συχνά μέσα σε 10 δευτερόλεπτα περίπου. Εάν η διεπιφάνεια είναι θολή ή δεν είναι καλά καθορισμένη (έχει σχηματιστεί γαλάκτωμα), ανατρέξτε στην ενότητα αντιμετώπισης προβλημάτων για συμβουλές.
Διαχωρισμός των στρωμάτων (για απλή εκχύλιση)
11. Το υγρό δεν αποστραγγίζεται καλά από ένα διαχωριστικό χωνί εάν το πώμα παραμένει τοποθετημένο, καθώς ο αέρας δεν μπορεί να εισέλθει στο χωνί για να αντικαταστήσει το εκτοπισμένο υγρό. Εάν το υγρό στραγγίσει από το χωνί χωρίς να αντικατασταθεί από ίσο όγκο αέρα, θα σχηματιστεί αρνητική πίεση στο χωνί. Συνεπώς, πριν από την αποστράγγιση υγρού από ένα διαχωριστικό χωνί, αφαιρείτε το πώμα (Σχ. 7 α).
12. Στραγγίξτε το μεγαλύτερο μέρος του κάτω στρώματος σε μια καθαρή φιάλη Erlenmeyer, τοποθετώντας τον δακτυλιοειδή σφιγκτήρα έτσι ώστε το άκρο του διαχωριστικού χωνιού να φωλιάζει στη φιάλη Erlenmeyer για να αποφευχθεί η εκτόξευση (Εικ. 7 β). Σταματήστε την αποστράγγιση όταν η διεπιφάνεια βρίσκεται σε απόσταση 1 cm από τον πυθμένα του κρουνού.
13. Αναδεύστε απαλά το χωνί για να απομακρύνετε τυχόν σταγονίδια που προσκολλώνται στο γυαλί (Εικ.7 γ). Μια ράβδος ανάδευσης γυαλιού μπορεί να χρησιμοποιηθεί για να χτυπήσει τα επίμονα προσκολλημένα σταγονίδια.
14. Περαιτέρω, αποστραγγίστε το κάτω στρώμα, σταματώντας όταν η διεπιφάνεια μόλις εισέλθει στο θάλαμο της στρόφιγγας (Εικ.7 δ). Επισημάνετε τη φιάλη Erlenmeyer (π.χ. "στρώμα πυθμένα").
15. Αδειάστε το ανώτερο στρώμα από την κορυφή του διαχωριστικού χωνιού σε μια άλλη καθαρή φιάλη Erlenmeyer (Εικ. 8 α), φροντίζοντας να επισημάνετε και πάλι τη φιάλη αυτή (Εικ. 8 β). Η σωστή τεχνική είναι να αποστραγγίζεται το κάτω στρώμα μέσω του κρουνού και να χύνεται το πάνω στρώμα από την κορυφή του χωνιού. Με τη μέθοδο αυτή ελαχιστοποιείται η εκ νέου ανάμειξη των διαλυμάτων, καθώς μόνο το κατώτερο στρώμα αγγίζει το στέλεχος του χωνιού.
16. Ποτέ μην πετάτε υγρά από μια εκχύλιση μέχρι να είστε απολύτως βέβαιοι ότι έχετε την επιθυμητή ένωση. Τα ανεπιθύμητα στρώματα μπορούν να απορριφθούν κατάλληλα όταν θα έχετε στα χέρια σας την επιθυμητή ένωση (π.χ. αφού ο περιστροφικός εξατμιστής απομακρύνει τον διαλύτη).
Τα λάθη που γίνονται κατά τη διάρκεια των εκχυλίσεων (π.χ. συνέχιση με το λάθος στρώμα), μπορούν να επιλυθούν εφόσον τα διαλύματα δεν έχουν τοποθετηθεί στο δοχείο αποβλήτων! Οι στιβάδες πρέπει επίσης να φυλάσσονται μέχρι την εξάτμιση, διότι η επιθυμητή ένωση μπορεί να μην είναι πολύ διαλυτή στον διαλύτη που χρησιμοποιήθηκε. Εάν η ένωση δεν εξαχθεί σε έναν διαλύτη, μπορεί να δοκιμαστεί αργότερα ένας διαφορετικός διαλύτης, και πάλι μόνο εάν οι στρώσεις δεν έχουν ακόμη απορριφθεί.
Καθαρισμός (για απλή εκχύλιση)
Για να καθαρίσετε ένα διαχωριστικό χωνί, ξεπλύνετέ το πρώτα με ακετόνη σε ένα δοχείο απορριμμάτων. Στη συνέχεια, πλύνετε το χωνί με σαπούνι και νερό στον πάγκο σας. Αποσυναρμολογήστε το πώμα από τεφλόν (εάν χρησιμοποιείται). Αφού ξεπλύνετε με αποσταγμένο νερό, αφήστε τα μέρη να στεγνώσουν χωριστά στο ντουλάπι σας (Εικ. 8 γ).
Τα λάθη που γίνονται κατά τη διάρκεια των εκχυλίσεων (π.χ. συνέχιση με το λάθος στρώμα), μπορούν να επιλυθούν εφόσον τα διαλύματα δεν έχουν τοποθετηθεί στο δοχείο αποβλήτων! Οι στιβάδες πρέπει επίσης να φυλάσσονται μέχρι την εξάτμιση, διότι η επιθυμητή ένωση μπορεί να μην είναι πολύ διαλυτή στον διαλύτη που χρησιμοποιήθηκε. Εάν η ένωση δεν εξαχθεί σε έναν διαλύτη, μπορεί να δοκιμαστεί αργότερα ένας διαφορετικός διαλύτης, και πάλι μόνο εάν οι στρώσεις δεν έχουν ακόμη απορριφθεί.
Καθαρισμός (για απλή εκχύλιση)
Για να καθαρίσετε ένα διαχωριστικό χωνί, ξεπλύνετέ το πρώτα με ακετόνη σε ένα δοχείο απορριμμάτων. Στη συνέχεια, πλύνετε το χωνί με σαπούνι και νερό στον πάγκο σας. Αποσυναρμολογήστε το πώμα από τεφλόν (εάν χρησιμοποιείται). Αφού ξεπλύνετε με αποσταγμένο νερό, αφήστε τα μέρη να στεγνώσουν χωριστά στο ντουλάπι σας (Εικ. 8 γ).
Πολλαπλές εκχυλίσεις.
Σε αυτή την ενότητα υπάρχουν σταδιακές οδηγίες για τον τρόπο εκχύλισης ενός υδατικού διαλύματος με έναν οργανικό διαλύτη που είναι λιγότερο πυκνός από το νερό (το οργανικό στρώμα θα βρίσκεται στην κορυφή). Ως παράδειγμα, οι οδηγίες γράφονται για την εκχύλιση ενός υδατικού διαλύματος τρεις φορές χρησιμοποιώντας 25 ml διαιθυλαιθέρα κάθε φορά (3×25 ml διαιθυλαιθέρα). Μια διαδικαστική περίληψη των δύο πρώτων εκχυλίσεων βρίσκεται στο Σχ. 9. Δύο εκχυλίσεις όταν το οργανικό στρώμα βρίσκεται στην κορυφή.
.

Εκχύλιση #1
1. Πραγματοποιήστε μία μόνο εκχύλιση χρησιμοποιώντας περίπου 25 ml διαιθυλαιθέρα (η ακριβής ποσότητα δεν είναι απαραίτητη), όπως περιγράφηκε προηγουμένως, φροντίζοντας να επισημάνετε κατάλληλα κάθε στρώμα (π.χ. "πάνω οργανικό στρώμα" και "κάτω υδατικό στρώμα").
Εκχύλιση #2
2. Επιστρέψτε το υδατικό στρώμα στη διαχωριστική χοάνη. Δεν χρειάζεται να πλύνετε το χωνί μεταξύ των εκχυλίσεων.
3. Προσθέστε μια νέα δόση διαιθυλαιθέρα 25 ml στο διαχωριστικό χωνί. Κλείστε το χωνί, αναποδογυρίστε και ανακινήστε με εξαερισμό, και στη συνέχεια αφήστε τα στρώματα να διαχωριστούν.
Σε αυτό το βήμα, θα πρέπει να υπάρχουν δύο στρώματα στο διαχωριστικό χωνί. Εάν δεν υπάρχουν δύο στρώματα, είναι πιθανό να προστέθηκε λάθος στρώμα στο διαχωριστικό χωνί στο βήμα 2 (ένα συνηθισμένο λάθος). Ένας τρόπος για να ελέγξετε αν αυτό ήταν το λάθος είναι να προσθέσετε λίγο νερό από ένα μπουκάλι ψεκασμού. Εάν το στρώμα που επιστρέφεται στο διαχωριστικό χωνί είναι το οργανικό στρώμα (λάθος), το νερό από το μπουκάλι του πιτσιλίσματος δεν θα αναμιχθεί με το διάλυμα, αλλά θα πέσει ως σταγονίδια στον πυθμένα. Εάν το οργανικό στρώμα (λανθασμένο) επιστράφηκε κατά λάθος στο διαχωριστικό χωνί, δεν έγινε καμία ζημιά, καθώς το οργανικό στρώμα απλώς αραιώθηκε. Αδειάστε το υγρό πίσω στη φιάλη που προορίζεται για την οργανική στιβάδα, και αντ' αυτού προσθέστε το υδατικό διάλυμα στο χωνί.
4. Στραγγίστε το κατώτατο υδατικό στρώμα σε φιάλη Erlenmeyer: είναι αποδεκτό να χρησιμοποιήσετε την ίδια φιάλη που χρησιμοποιήθηκε για το υδατικό στρώμα στην πρώτη εκχύλιση (που μπορεί να είχε την ένδειξη "κατώτατο υδατικό στρώμα").
5. Δεδομένου ότι είναι συνηθέστερο να συνδυάζονται τα οργανικά στρώματα σε πολλαπλές εκχυλίσεις, το ανώτερο οργανικό στρώμα μπορεί να χύνεται από το διαχωριστικό χωνί στην ίδια φιάλη που χρησιμοποιήθηκε για το οργανικό στρώμα στην πρώτη εκχύλιση (που μπορεί να έχει την ένδειξη "ανώτερο οργανικό στρώμα"). Σε αυτή τη φιάλη θα πρέπει να υπάρχουν περίπου 50 ml διαιθυλαιθέρα από τις δύο εκχυλίσεις.
Εκχύλιση #3
6. Επαναλάβετε την εκχύλιση για τρίτη φορά προσθέτοντας το υδατικό στρώμα από τη δεύτερη εκχύλιση στη διαχωριστική χοάνη, ακολουθούμενο από άλλη μια νέα δόση διαιθυλαιθέρα 25 ml. Κλείστε το χωνί, αναποδογυρίστε και ανακινήστε με εξαερισμό, στη συνέχεια αφήστε τα στρώματα να διαχωριστούν.
7. Στραγγίστε το υδατικό στρώμα στην κατάλληλη φιάλη και ρίξτε και πάλι το ανώτερο στρώμα στη φιάλη οργανικού στρώματος, όπου θα πρέπει να υπάρχουν περίπου 75 ml διαιθυλαιθέρα από τις τρεις εκχυλίσεις.
1. Πραγματοποιήστε μία μόνο εκχύλιση χρησιμοποιώντας περίπου 25 ml διαιθυλαιθέρα (η ακριβής ποσότητα δεν είναι απαραίτητη), όπως περιγράφηκε προηγουμένως, φροντίζοντας να επισημάνετε κατάλληλα κάθε στρώμα (π.χ. "πάνω οργανικό στρώμα" και "κάτω υδατικό στρώμα").
Εκχύλιση #2
2. Επιστρέψτε το υδατικό στρώμα στη διαχωριστική χοάνη. Δεν χρειάζεται να πλύνετε το χωνί μεταξύ των εκχυλίσεων.
3. Προσθέστε μια νέα δόση διαιθυλαιθέρα 25 ml στο διαχωριστικό χωνί. Κλείστε το χωνί, αναποδογυρίστε και ανακινήστε με εξαερισμό, και στη συνέχεια αφήστε τα στρώματα να διαχωριστούν.
Σε αυτό το βήμα, θα πρέπει να υπάρχουν δύο στρώματα στο διαχωριστικό χωνί. Εάν δεν υπάρχουν δύο στρώματα, είναι πιθανό να προστέθηκε λάθος στρώμα στο διαχωριστικό χωνί στο βήμα 2 (ένα συνηθισμένο λάθος). Ένας τρόπος για να ελέγξετε αν αυτό ήταν το λάθος είναι να προσθέσετε λίγο νερό από ένα μπουκάλι ψεκασμού. Εάν το στρώμα που επιστρέφεται στο διαχωριστικό χωνί είναι το οργανικό στρώμα (λάθος), το νερό από το μπουκάλι του πιτσιλίσματος δεν θα αναμιχθεί με το διάλυμα, αλλά θα πέσει ως σταγονίδια στον πυθμένα. Εάν το οργανικό στρώμα (λανθασμένο) επιστράφηκε κατά λάθος στο διαχωριστικό χωνί, δεν έγινε καμία ζημιά, καθώς το οργανικό στρώμα απλώς αραιώθηκε. Αδειάστε το υγρό πίσω στη φιάλη που προορίζεται για την οργανική στιβάδα, και αντ' αυτού προσθέστε το υδατικό διάλυμα στο χωνί.
4. Στραγγίστε το κατώτατο υδατικό στρώμα σε φιάλη Erlenmeyer: είναι αποδεκτό να χρησιμοποιήσετε την ίδια φιάλη που χρησιμοποιήθηκε για το υδατικό στρώμα στην πρώτη εκχύλιση (που μπορεί να είχε την ένδειξη "κατώτατο υδατικό στρώμα").
5. Δεδομένου ότι είναι συνηθέστερο να συνδυάζονται τα οργανικά στρώματα σε πολλαπλές εκχυλίσεις, το ανώτερο οργανικό στρώμα μπορεί να χύνεται από το διαχωριστικό χωνί στην ίδια φιάλη που χρησιμοποιήθηκε για το οργανικό στρώμα στην πρώτη εκχύλιση (που μπορεί να έχει την ένδειξη "ανώτερο οργανικό στρώμα"). Σε αυτή τη φιάλη θα πρέπει να υπάρχουν περίπου 50 ml διαιθυλαιθέρα από τις δύο εκχυλίσεις.
Εκχύλιση #3
6. Επαναλάβετε την εκχύλιση για τρίτη φορά προσθέτοντας το υδατικό στρώμα από τη δεύτερη εκχύλιση στη διαχωριστική χοάνη, ακολουθούμενο από άλλη μια νέα δόση διαιθυλαιθέρα 25 ml. Κλείστε το χωνί, αναποδογυρίστε και ανακινήστε με εξαερισμό, στη συνέχεια αφήστε τα στρώματα να διαχωριστούν.
7. Στραγγίστε το υδατικό στρώμα στην κατάλληλη φιάλη και ρίξτε και πάλι το ανώτερο στρώμα στη φιάλη οργανικού στρώματος, όπου θα πρέπει να υπάρχουν περίπου 75 ml διαιθυλαιθέρα από τις τρεις εκχυλίσεις.
Αντιμετώπιση προβλημάτων.
Αυτή η ενότητα περιγράφει συνήθη προβλήματα και λύσεις στις εκχυλίσεις.Υπάρχει μόνο ένα στρώμα
Ο πιο συνηθισμένος λόγος για τον οποίο υπάρχει μόνο μία στιβάδα σε ένα διαχωριστικό χωνί, ενώ θα έπρεπε να υπάρχουν δύο (όπως όταν η διαδικασία σας λέει να "διαχωρίσετε τις στιβάδες"), είναι να έχει γίνει κάποιο λάθος. Αυτό που πιθανότατα συνέβη είναι ότι στο διαχωριστικό χωνί προστέθηκε η λάθος στιβάδα - για παράδειγμα, η οργανική στιβάδα προστέθηκε εν αγνοία σας αντί για την υδατική στιβάδα. Όταν ο οργανικός διαλύτης προστίθεται σε ένα οργανικό στρώμα στο διαχωριστικό χωνί, το αποτέλεσμα είναι μόνο ένα στρώμα. Το λάθος μπορεί να διορθωθεί εφόσον τα στρώματα δεν έχουν ακόμη απορριφθεί! Εάν προστεθεί η σωστή στιβάδα στο χωνί, όλα θα λειτουργήσουν όπως είχε προγραμματιστεί. Για να αποφύγετε αυτό το λάθος στο μέλλον, φροντίστε να επισημάνετε τις φιάλες Erlenmeyer. Επίσης, φροντίστε να μην πετάτε ποτέ ένα στρώμα μέχρι να είστε απολύτως σίγουροι ότι έχετε κάνει τα πάντα σωστά.
Ένας περιστασιακός λόγος για τον οποίο σχηματίζεται μόνο ένα στρώμα σε ένα διαχωριστικό χωνί είναι εάν υπάρχουν μεγάλες ποσότητες ενώσεων που διαλύονται και στους δύο διαλύτες, για παράδειγμα εάν υπάρχουν μεγάλες ποσότητες αιθανόλης, η οποία διαλύεται καλά τόσο σε υδατικούς όσο και σε οργανικούς διαλύτες. Σε αυτή την περίπτωση, η καλύτερη προσέγγιση είναι η απομάκρυνση της προβληματικής ένωσης (δηλαδή της αιθανόλης) σε περιστροφικό εξατμιστή πριν από την εκχύλιση.
Υπάρχουν τρία στρώματα
Ο συνηθέστερος λόγος για την ύπαρξη τριών στρωμάτων σε ένα διαχωριστικό χωνί είναι η ανεπαρκής ανάμιξη (Εικ. 10 α). Εάν το χωνί ανακινηθεί με μεγαλύτερη δύναμη, είναι πιθανό να κατακαθίσει σε δύο στρώματα (Εικ.10 β). Είναι επίσης πιθανό το μεσαίο τρίτο στρώμα να είναι γαλάκτωμα, όπου τα δύο στρώματα δεν έχουν διαχωριστεί πλήρως.
Ο πιο συνηθισμένος λόγος για τον οποίο υπάρχει μόνο μία στιβάδα σε ένα διαχωριστικό χωνί, ενώ θα έπρεπε να υπάρχουν δύο (όπως όταν η διαδικασία σας λέει να "διαχωρίσετε τις στιβάδες"), είναι να έχει γίνει κάποιο λάθος. Αυτό που πιθανότατα συνέβη είναι ότι στο διαχωριστικό χωνί προστέθηκε η λάθος στιβάδα - για παράδειγμα, η οργανική στιβάδα προστέθηκε εν αγνοία σας αντί για την υδατική στιβάδα. Όταν ο οργανικός διαλύτης προστίθεται σε ένα οργανικό στρώμα στο διαχωριστικό χωνί, το αποτέλεσμα είναι μόνο ένα στρώμα. Το λάθος μπορεί να διορθωθεί εφόσον τα στρώματα δεν έχουν ακόμη απορριφθεί! Εάν προστεθεί η σωστή στιβάδα στο χωνί, όλα θα λειτουργήσουν όπως είχε προγραμματιστεί. Για να αποφύγετε αυτό το λάθος στο μέλλον, φροντίστε να επισημάνετε τις φιάλες Erlenmeyer. Επίσης, φροντίστε να μην πετάτε ποτέ ένα στρώμα μέχρι να είστε απολύτως σίγουροι ότι έχετε κάνει τα πάντα σωστά.
Ένας περιστασιακός λόγος για τον οποίο σχηματίζεται μόνο ένα στρώμα σε ένα διαχωριστικό χωνί είναι εάν υπάρχουν μεγάλες ποσότητες ενώσεων που διαλύονται και στους δύο διαλύτες, για παράδειγμα εάν υπάρχουν μεγάλες ποσότητες αιθανόλης, η οποία διαλύεται καλά τόσο σε υδατικούς όσο και σε οργανικούς διαλύτες. Σε αυτή την περίπτωση, η καλύτερη προσέγγιση είναι η απομάκρυνση της προβληματικής ένωσης (δηλαδή της αιθανόλης) σε περιστροφικό εξατμιστή πριν από την εκχύλιση.
Υπάρχουν τρία στρώματα
Ο συνηθέστερος λόγος για την ύπαρξη τριών στρωμάτων σε ένα διαχωριστικό χωνί είναι η ανεπαρκής ανάμιξη (Εικ. 10 α). Εάν το χωνί ανακινηθεί με μεγαλύτερη δύναμη, είναι πιθανό να κατακαθίσει σε δύο στρώματα (Εικ.10 β). Είναι επίσης πιθανό το μεσαίο τρίτο στρώμα να είναι γαλάκτωμα, όπου τα δύο στρώματα δεν έχουν διαχωριστεί πλήρως.
Υπάρχει αδιάλυτο υλικό στη διεπιφάνεια.
Μια μικρή ποσότητα αδιάλυτης μεμβράνης μεταξύ δύο στρωμάτων δεν είναι ασυνήθιστη κατά τη διάρκεια μιας εκχύλισης. Τα πολυμερή υλικά τείνουν να αναπαύονται μεταξύ των στρωμάτων, καθώς οι αλληλεπιδράσεις του διαλύτη ελαχιστοποιούνται στη διεπιφάνεια. Μια μικρή μεμβράνη δεν είναι κάτι που πρέπει να ανησυχείτε, διότι εάν μια μικρή ποσότητα καταφέρει να εισέλθει στην οργανική στιβάδα, ένα επακόλουθο στάδιο ξήρανσης και διήθησης συχνά την απομακρύνει.
Η διεπιφάνεια δεν είναι ορατή.
Ενίοτε, οι ενώσεις σε ένα διαχωριστικό χωνί είναι τόσο σκοτεινές που επισκιάζουν τη διεπιφάνεια μεταξύ των δύο στρωμάτων. Εάν συμβεί αυτό, υπάρχουν διάφορες μέθοδοι που μπορεί να σας βοηθήσουν να δείτε τη διεπιφάνεια. Μία από αυτές είναι να κρατήσετε το διαχωριστικό χωνί στο φως ή να φωτίσετε με φακό το γυαλί (Εικ. 11 β). Το πρόσθετο φως σας επιτρέπει μερικές φορές να δείτε τη διεπιφάνεια. Μια δεύτερη μέθοδος είναι να παρατηρήσετε προσεκτικά τα στρώματα ενώ γέρνετε το χωνί μπρος-πίσω προς το πλάι (Εικ.11 γ). Το μάτι σας μπορεί μερικές φορές να εντοπίσει λεπτές διαφορές στον τρόπο ροής των υγρών. Μια τρίτη μέθοδος είναι να προσθέσετε λίγο περισσότερο διαλύτη στο χωνί για να αραιώσετε κάπως ένα από τα στρώματα ή να προσθέσετε διαφορετικό διαλύτη για να αλλάξετε το δείκτη διάθλασης.
Τα στρώματα δεν διαχωρίζονται καλά (σχηματίζεται γαλάκτωμα)
Τα γαλακτώματα μπορούν να συμβούν για διάφορους λόγους.
1. Η πυκνότητα κάθε στρώματος μπορεί να είναι τόσο παρόμοια ώστε να υπάρχει ασθενές κίνητρο για το διαχωρισμό των υγρών.2. Μπορεί να υπάρχουν ενώσεις που μοιάζουν με σαπούνι ή άλλοι γαλακτωματοποιητές που διαλύουν ορισμένα συστατικά το ένα μέσα στο άλλο.
Τα γαλακτώματα μπορεί να είναι πολύ δύσκολο να διορθωθούν, και είναι καλύτερο να αποφεύγονται εξαρχής με την ήπια ανακίνηση διαλυμάτων που είναι επιρρεπή σε γαλακτώματα (π.χ. διχλωρομεθάνιο με πολύ βασικά ή πυκνά διαλύματα) μέσα στη διαχωριστική χοάνη. Παρ' όλα αυτά, αν όντως σχηματιστεί γαλάκτωμα, υπάρχουν κάποιοι τρόποι για να επιχειρήσουμε τη διαλεύκανσή τους.
- α) Για ήπια γαλακτώματα, αναδεύστε απαλά τα στρώματα και προσπαθήστε να χτυπήσετε τα αιωρούμενα σταγονίδια με μια γυάλινη ράβδο ανάδευσης.
- β) Αφήστε το διάλυμα να παραμείνει για κάποιο χρονικό διάστημα (ακόμη και μέχρι την επόμενη εργαστηριακή περίοδο), αν είναι δυνατόν. Με αρκετό χρόνο, ορισμένα διαλύματα καθιζάνουν από μόνα τους. Αυτό βέβαια μπορεί να μην είναι πρακτικό.
- γ) Για μικρούς όγκους, χρησιμοποιήστε μια φυγόκεντρο, αν υπάρχει διαθέσιμη. Μια φυγόκεντρος επιταχύνει τη διαδικασία που αφήνει ένα γαλάκτωμα να κατακαθίσει από μόνο του. Να θυμάστε ότι μια φυγόκεντρος πρέπει να είναι ισορροπημένη, αλλιώς μπορεί να ταλαντεύεται από την επιφάνεια του πάγκου. Χωρίστε τα διαλύματα ισομερώς, τοποθετώντας σωλήνες ίσου όγκου ο ένας απέναντι από τον άλλο μέσα στη φυγόκεντρο.
- δ) Εάν σχηματίζεται γαλάκτωμα επειδή τα δύο στρώματα έχουν παρόμοιες πυκνότητες, προσπαθήστε να αλλάξετε την πυκνότητα κάθε στρώματος για να τα κάνετε πιο διαφορετικά. Για να βοηθήσετε στη διασαφήνιση ενός γαλακτώματος, προσπαθήστε να μειώσετε την πυκνότητα του επάνω στρώματος ή να αυξήσετε την πυκνότητα του κάτω στρώματος. Για παράδειγμα, αν προκύψει ένα γαλάκτωμα με οξικό αιθυλεστέρα (ανώτερο στρώμα) και υδατικό διάλυμα (κατώτερο στρώμα), προσθέστε λίγο NaCl. Το NaCl θα διαλυθεί στο υδατικό στρώμα και θα αυξήσει την πυκνότητα του υδατικού διαλύματος. Εναλλακτικά, προσθέστε επιπλέον οξικό αιθυλεστέρα, ο οποίος θα αραιώσει το οργανικό στρώμα και θα μειώσει την πυκνότητά του. Ως έσχατη λύση, προσθέστε λίγο πεντάνιο, το οποίο θα αναμιχθεί με το ανώτερο οργανικό στρώμα και θα μειώσει την πυκνότητά του (το πεντάνιο είναι ένας από τους λιγότερο πυκνούς οργανικούς διαλύτες). Η προσθήκη πεντανίου χρησιμοποιείται ως τελική προσπάθεια, καθώς θα επηρεάσει αρνητικά την ικανότητα του οργανικού στρώματος να εκχυλίζει κάπως πολικές ενώσεις.
Εάν προκύψει γαλάκτωμα με υδατικό διάλυμα (ανώτερο στρώμα) και διχλωρομεθάνιο (κατώτερο στρώμα), προσθέστε λίγο νερό από ένα μπουκάλι ψεκασμού για να αραιώσετε το ανώτερο στρώμα και να μειώσετε την πυκνότητά του. Αυτή η μέθοδος λειτούργησε καλά για τη διαύγαση του γαλακτώματος στην Εικ. 13 γ, όπως αποδεικνύεται από την Εικ. 13 δ. - γ) Δοκιμάστε να μειώσετε τη διαλυτότητα του ενός συστατικού στο άλλο. Μια μέθοδος είναι η προσθήκη NaCl ή NH4Cl στο διαχωριστικό χωνί, το οποίο διαλύεται στο υδατικό στρώμα και μειώνει την ικανότητα των οργανικών ενώσεων να διαλύονται στο νερό ("αλάτωση").
Εκχύλιση οξέος-βάσης
Εκχύλιση οξέος-βάσης
- G.Patton
- 2
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/threads/extraction.553/
Πώς λειτουργούν.
Μια τροποποίηση των εκχυλίσεων που συζητήθηκαν προηγουμένως σε αυτό το κεφάλαιο είναι η πραγματοποίηση μιας χημικής αντίδρασης στη διαχωριστική χοάνη προκειμένου να αλλάξει η πολικότητα και, επομένως, ο καταμερισμός μιας ένωσης στο υδατικό και στο οργανικό στρώμα. Μια συνήθης μέθοδος είναι η εκτέλεση μιας αντίδρασης οξέος-βάσης, η οποία μπορεί να μετατρέψει ορισμένες ενώσεις από ουδέτερες σε ιοντικές μορφές (ή αντίστροφα).
Για παράδειγμα, φανταστείτε ότι ένα μείγμα βενζοϊκού οξέος και κυκλοεξανίου διαλύεται σε έναν οργανικό διαλύτη όπως ο οξικός αιθυλεστέρας σε ένα διαχωριστικό χωνί. Για το διαχωρισμό των συστατικών, μπορεί να επιχειρηθεί πλύση με νερό για την απομάκρυνση του βενζοϊκού οξέος, αλλά το βενζοϊκό οξύ δεν είναι ιδιαίτερα υδατοδιαλυτό λόγω του μη πολικού αρωματικού δακτυλίου του και μόνο μικρές ποσότητες θα εκχυλίζονταν στο υδατικό στρώμα (Εικ. 14 α).
Για παράδειγμα, φανταστείτε ότι ένα μείγμα βενζοϊκού οξέος και κυκλοεξανίου διαλύεται σε έναν οργανικό διαλύτη όπως ο οξικός αιθυλεστέρας σε ένα διαχωριστικό χωνί. Για το διαχωρισμό των συστατικών, μπορεί να επιχειρηθεί πλύση με νερό για την απομάκρυνση του βενζοϊκού οξέος, αλλά το βενζοϊκό οξύ δεν είναι ιδιαίτερα υδατοδιαλυτό λόγω του μη πολικού αρωματικού δακτυλίου του και μόνο μικρές ποσότητες θα εκχυλίζονταν στο υδατικό στρώμα (Εικ. 14 α).
Ο διαχωρισμός ενός μείγματος βενζοϊκού οξέος και κυκλοεξανίου είναι ωστόσο δυνατός με πλύση με βάση, όπως το NaOH. Λόγω της όξινης φύσης του, το βενζοϊκό οξύ μπορεί να υποστεί αντίδραση με NaOH ως εξής, με αποτέλεσμα το καρβοξυλικό άλας βενζοϊκό νάτριο.
Οι ιδιότητες διαλυτότητας των καρβοξυλικών οξέων διαφέρουν ουσιαστικά από τα αντίστοιχα καρβοξυλικά άλατα. Το σαλικυλικό νάτριο είναι περίπου 350 φορές πιο διαλυτό στο νερό από το σαλικυλικό οξύ λόγω του ιοντικού του χαρακτήρα (Εικ. 15), ενώ είναι μάλλον αδιάλυτο σε οργανικούς διαλύτες όπως ο διαιθυλαιθέρας.
Επομένως, μια πλύση με NaOH θα μετέτρεπε το βενζοϊκό οξύ στην ιοντική καρβοξυλική μορφή του, η οποία στη συνέχεια θα ήταν πιο διαλυτή στο υδατικό στρώμα, επιτρέποντας την εκχύλιση του βενζοϊκού νατρίου στο υδατικό στρώμα. Το κυκλοεξάνιο θα παρέμενε στην οργανική στιβάδα, καθώς δεν έχει καμία συγγένεια με την υδατική φάση, ούτε μπορεί να αντιδράσει με το NaOH με οποιονδήποτε τρόπο. Με αυτόν τον τρόπο μπορεί να διαχωριστεί ένα μείγμα βενζοϊκού οξέος και κυκλοεξανίου (Σχ. 14 β). Η υδατική στιβάδα μπορεί αργότερα να οξυνθεί με HCl(aq), εάν είναι επιθυμητό, για να μετατραπεί το βενζοϊκό οξύ πίσω στην ουδέτερη μορφή του.
Πλύσεις με διττανθρακικό νάτριο
Μια εκχύλιση οξέος-βάσης μπορεί να χρησιμοποιηθεί για την εκχύλιση καρβοξυλικών οξέων από το οργανικό στρώμα στο υδατικό στρώμα. Όπως συζητήθηκε στην προηγούμενη ενότητα, το NaOH μπορεί να χρησιμοποιηθεί για τη μετατροπή ενός καρβοξυλικού οξέος στην πιο υδατοδιαλυτή ιοντική καρβοξυλική μορφή του. Ωστόσο, εάν το μείγμα περιέχει μια επιθυμητή ένωση που μπορεί να αντιδράσει με το NaOH, θα πρέπει να χρησιμοποιηθεί μια πιο ήπια βάση, όπως το διττανθρακικό νάτριο. Συμβαίνει μια παρόμοια αντίδραση.
Πλύσεις με διττανθρακικό νάτριο
Μια εκχύλιση οξέος-βάσης μπορεί να χρησιμοποιηθεί για την εκχύλιση καρβοξυλικών οξέων από το οργανικό στρώμα στο υδατικό στρώμα. Όπως συζητήθηκε στην προηγούμενη ενότητα, το NaOH μπορεί να χρησιμοποιηθεί για τη μετατροπή ενός καρβοξυλικού οξέος στην πιο υδατοδιαλυτή ιοντική καρβοξυλική μορφή του. Ωστόσο, εάν το μείγμα περιέχει μια επιθυμητή ένωση που μπορεί να αντιδράσει με το NaOH, θα πρέπει να χρησιμοποιηθεί μια πιο ήπια βάση, όπως το διττανθρακικό νάτριο. Συμβαίνει μια παρόμοια αντίδραση.
Μια διαφορά στη χρήση της βάσης NaHCO3 αντί του NaOH είναι ότι το παραπροϊόν ανθρακικό οξύ (H2CO3) μπορεί να διασπαστεί σε νερό και αέριο διοξείδιο του άνθρακα. Κατά την ανακίνηση ενός όξινου διαλύματος με διττανθρακικό νάτριο σε διαχωριστικό χωνί, θα πρέπει να λαμβάνεται μέριμνα για την ήπια ανάδευση και τον συχνότερο εξαερισμό για την αποδέσμευση της πίεσης από το αέριο.
Ένα παράδειγμα αντίδρασης που χρησιμοποιεί συχνά πλύση διττανθρακικού νατρίου στην επεξεργασία είναι η αντίδραση εστεροποίησης Fischer. Για την επίδειξη, το βενζοϊκό οξύ επαναρροφήθηκε σε αιθανόλη μαζί με πυκνό θειικό οξύ για να σχηματιστεί βενζοϊκό αιθυλεστέρα (Σχήμα 16 α και β). Μια πλάκα TLC του μίγματος της αντίδρασης σε 1 ώρα επαναρροής έδειξε υπολείμματα μη αντιδρώντος καρβοξυλικού οξέος (Εικ.16 γ), κάτι που δεν είναι ασυνήθιστο λόγω της ενεργειακής συμπεριφοράς της αντίδρασης.
Ένα παράδειγμα αντίδρασης που χρησιμοποιεί συχνά πλύση διττανθρακικού νατρίου στην επεξεργασία είναι η αντίδραση εστεροποίησης Fischer. Για την επίδειξη, το βενζοϊκό οξύ επαναρροφήθηκε σε αιθανόλη μαζί με πυκνό θειικό οξύ για να σχηματιστεί βενζοϊκό αιθυλεστέρα (Σχήμα 16 α και β). Μια πλάκα TLC του μίγματος της αντίδρασης σε 1 ώρα επαναρροής έδειξε υπολείμματα μη αντιδρώντος καρβοξυλικού οξέος (Εικ.16 γ), κάτι που δεν είναι ασυνήθιστο λόγω της ενεργειακής συμπεριφοράς της αντίδρασης.
Το υπολειπόμενο καρβοξυλικό οξύ μπορεί να απομακρυνθεί από το επιθυμητό προϊόν εστέρα με εκχύλιση με βάση οξέος σε διαχωριστικό χωνί. Μια πλύση με διττανθρακικό νάτριο μετατρέπει το βενζοϊκό οξύ στην πιο υδατοδιαλυτή μορφή του βενζοϊκού νατρίου, εκχυλίζοντάς το στο υδατικό στρώμα (Εικ. 17). Επιπλέον, το διττανθρακικό νάτριο εξουδετερώνει το καταλυτικό οξύ σε αυτή την αντίδραση.
Το διττανθρακικό νάτριο είναι προτιμότερο από το NaOH σε αυτή τη διεργασία, καθώς είναι πολύ ασθενέστερη βάση- η πλύση με NaOH θα μπορούσε να προκαλέσει υδρόλυση του προϊόντος του εστέρα.
Μείγματα οξέων και βάσεων
Όπως συζητήθηκε προηγουμένως, οι ιδιότητες οξέων-βάσεων των ενώσεων μπορούν να χρησιμοποιηθούν για την επιλεκτική εξαγωγή ορισμένων ενώσεων από μείγματα. Η στρατηγική αυτή μπορεί να επεκταθεί και σε άλλα παραδείγματαΜείγματα οξέων και βάσεων
Εξαγωγή βάσεων
Βασικές ενώσεις, όπως οι αμίνες, μπορούν να εξαχθούν από οργανικά διαλύματα ανακινώντας τις με όξινα διαλύματα για να μετατραπούν σε πιο υδατοδιαλυτά άλατα. Με τον τρόπο αυτό, μπορούν να εξαχθούν από ένα οργανικό στρώμα σε ένα υδατικό στρώμα.Εκχύλιση καρβοξυλικών οξέων έναντι φαινολών
Όπως αναφέρθηκε προηγουμένως, τα καρβοξυλικά οξέα μπορούν να εκχυλιστούν από ένα οργανικό στρώμα σε ένα υδατικό στρώμα ανακινώντας τα με βασικά διαλύματα, τα οποία τα μετατρέπουν σε πιο υδατοδιαλυτά τους άλατα.
Όπως αναφέρθηκε προηγουμένως, τα καρβοξυλικά οξέα μπορούν να εκχυλιστούν από ένα οργανικό στρώμα σε ένα υδατικό στρώμα ανακινώντας τα με βασικά διαλύματα, τα οποία τα μετατρέπουν σε πιο υδατοδιαλυτά τους άλατα.
Παρόμοια αντίδραση λαμβάνει χώρα με τις φαινόλες (PhOH), και μπορούν επίσης να εκχυλιστούν σε υδατικό στρώμα NaOH (Εικ. 18 α).
Ωστόσο, οι φαινόλες είναι σημαντικά λιγότερο όξινες από τα καρβοξυλικά οξέα και δεν είναι αρκετά όξινες ώστε να αντιδράσουν πλήρως με το NaHCO3, μια ασθενέστερη βάση. Επομένως, ένα διάλυμα διττανθρακικού οξέος μπορεί να χρησιμοποιηθεί για το διαχωρισμό μιγμάτων φαινολών και καρβοξυλικών οξέων (Εικ.18 β).
Ωστόσο, οι φαινόλες είναι σημαντικά λιγότερο όξινες από τα καρβοξυλικά οξέα και δεν είναι αρκετά όξινες ώστε να αντιδράσουν πλήρως με το NaHCO3, μια ασθενέστερη βάση. Επομένως, ένα διάλυμα διττανθρακικού οξέος μπορεί να χρησιμοποιηθεί για το διαχωρισμό μιγμάτων φαινολών και καρβοξυλικών οξέων (Εικ.18 β).
Εκχύλιση οξέων, βάσεων και ουδέτερων ενώσεων
Οι ιδιότητες οξέος-βάσης που συζητήθηκαν προηγουμένως επιτρέπουν τον καθαρισμό ενός μίγματος που περιέχει όξινα (π.χ. RCO2H), βασικά (π.χ. RNH2) και ουδέτερα συστατικά μέσω μιας σειράς εκχυλίσεων, όπως συνοψίζεται στο Σχήμα 19 (το οποίο χρησιμοποιεί έναν οργανικό διαλύτη λιγότερο πυκνό από το νερό).
Οι ιδιότητες οξέος-βάσης που συζητήθηκαν προηγουμένως επιτρέπουν τον καθαρισμό ενός μίγματος που περιέχει όξινα (π.χ. RCO2H), βασικά (π.χ. RNH2) και ουδέτερα συστατικά μέσω μιας σειράς εκχυλίσεων, όπως συνοψίζεται στο Σχήμα 19 (το οποίο χρησιμοποιεί έναν οργανικό διαλύτη λιγότερο πυκνό από το νερό).
Θεωρείται ότι οι αναγνώστες που διεξάγουν αυτού του είδους το πείραμα είναι εξοικειωμένοι με την εκτέλεση απλών και πολλαπλών εκχυλίσεων. Στην παρούσα ενότητα περιγράφονται οι διαφορές μεταξύ των γενικών διαδικασιών εκχύλισης και της διαδικασίας όπως συνοψίζεται στο Σχ. 19.
1. Απομόνωση του όξινου συστατικού:
α) Όταν το όξινο συστατικό βρίσκεται στο υδατικό στρώμα σε φιάλη Erlenmeyer, μπορεί να μετατραπεί πίσω στο ουδέτερο συστατικό με προσθήκη 2M HCl(aq) έως ότου το διάλυμα δώσει pH 3-4 (όπως προσδιορίζεται με χαρτί pH). Εάν υπάρχουν μεγάλες ποσότητες οξέος, ώστε η οξίνιση να απαιτεί πολύ μεγάλο όγκο 2M HCl(aq), μπορεί να προστεθεί σταδιακά πυκνό HCl(aq). Χαμηλότερες συγκεντρώσεις HCl(aq) είναι λιγότερο επικίνδυνες, αλλά η αύξηση του όγκου του υδατικού στρώματος κατά μεγάλη ποσότητα θα επηρέαζε την αποτελεσματικότητα των επόμενων εκχυλίσεων και των βημάτων φιλτραρίσματος.
β) Μετά την οξίνιση, μπορούν να ακολουθηθούν δύο διαδρομές, ανάλογα με το αν το όξινο συστατικό είναι στερεό ή υγρό.
1. Απομόνωση του όξινου συστατικού:
α) Όταν το όξινο συστατικό βρίσκεται στο υδατικό στρώμα σε φιάλη Erlenmeyer, μπορεί να μετατραπεί πίσω στο ουδέτερο συστατικό με προσθήκη 2M HCl(aq) έως ότου το διάλυμα δώσει pH 3-4 (όπως προσδιορίζεται με χαρτί pH). Εάν υπάρχουν μεγάλες ποσότητες οξέος, ώστε η οξίνιση να απαιτεί πολύ μεγάλο όγκο 2M HCl(aq), μπορεί να προστεθεί σταδιακά πυκνό HCl(aq). Χαμηλότερες συγκεντρώσεις HCl(aq) είναι λιγότερο επικίνδυνες, αλλά η αύξηση του όγκου του υδατικού στρώματος κατά μεγάλη ποσότητα θα επηρέαζε την αποτελεσματικότητα των επόμενων εκχυλίσεων και των βημάτων φιλτραρίσματος.
β) Μετά την οξίνιση, μπορούν να ακολουθηθούν δύο διαδρομές, ανάλογα με το αν το όξινο συστατικό είναι στερεό ή υγρό.
- Εάν κατά την οξίνιση του ιοντικού άλατος σχηματιστεί στερεό, μπορεί να συλλεχθεί μέσω διήθησης με αναρρόφηση. Η μέθοδος αυτή πρέπει να χρησιμοποιείται μόνο εάν παρατηρούνται μεγάλες ποσότητες κρυστάλλων μεγάλου μεγέθους. Εάν σχηματιστούν λεπτοί κρύσταλλοι (οι οποίοι είναι αρκετά συνηθισμένοι), θα φράξουν το διηθητικό χαρτί και θα παρεμποδίσουν την επαρκή αποστράγγιση. Εάν παρατηρείται μόνο μια μικρή ποσότητα στερεού σε σύγκριση με τη θεωρητική ποσότητα, είναι πιθανό η ένωση να είναι αρκετά υδατοδιαλυτή και η διήθηση θα οδηγούσε σε χαμηλή ανάκτηση.
- Εάν δεν σχηματιστεί στερεό κατά την οξίνιση (ή εάν σχηματιστούν λεπτοί κρύσταλλοι ή μικρή ποσότητα στερεού), εκχυλίστε το όξινο συστατικό πίσω σε οργανικό διαλύτη (×3). Ως γενικός κανόνας, χρησιμοποιήστε το ένα τρίτο της ποσότητας διαλύτη για τις εκχυλίσεις σε σχέση με το αρχικό στρώμα (π.χ. εάν χρησιμοποιείτε 100 ml υδατικού διαλύματος, εκχυλίστε με 33 ml οργανικού διαλύτη κάθε φορά). Φροντίστε να ψύξετε πρώτα το υδατικό διάλυμα σε παγόλουτρο πριν από την εκχύλιση, εάν η οξίνιση δημιούργησε αξιοσημείωτη θερμότητα. Ακολουθεί πλύση με άλμη (×1) εάν χρησιμοποιείται διαιθυλαιθέρας ή οξικός αιθυλεστέρας, στεγνώστε με ξηραντικό μέσο και αφαιρέστε τον διαλύτη μέσω περιστροφικού εξατμιστή για να παραμείνει το καθαρό όξινο συστατικό.
2. Απομόνωση του βασικού συστατικού:
Χρησιμοποιήστε παρόμοια διαδικασία με την απομόνωση του όξινου συστατικού, με τη διαφορά ότι βασικοποιείτε το διάλυμα χρησιμοποιώντας 2M NaOH(aq) έως ότου δώσει pH 9-10, όπως προσδιορίζεται με χαρτί pH.
3. Απομόνωση του ουδέτερου συστατικού:
Το ουδέτερο συστατικό θα είναι η ένωση που "περισσεύει" στο οργανικό στρώμα. Για την απομόνωση, πλύνετε με άλμη (×1) εάν χρησιμοποιείτε διαιθυλαιθέρα ή οξικό αιθυλεστέρα, στεγνώστε με ένα μέσο ξήρανσης και αφαιρέστε τον διαλύτη μέσω περιστροφικού εξατμιστή για να αφήσετε το καθαρό ουδέτερο συστατικό.
Χρησιμοποιήστε παρόμοια διαδικασία με την απομόνωση του όξινου συστατικού, με τη διαφορά ότι βασικοποιείτε το διάλυμα χρησιμοποιώντας 2M NaOH(aq) έως ότου δώσει pH 9-10, όπως προσδιορίζεται με χαρτί pH.
3. Απομόνωση του ουδέτερου συστατικού:
Το ουδέτερο συστατικό θα είναι η ένωση που "περισσεύει" στο οργανικό στρώμα. Για την απομόνωση, πλύνετε με άλμη (×1) εάν χρησιμοποιείτε διαιθυλαιθέρα ή οξικό αιθυλεστέρα, στεγνώστε με ένα μέσο ξήρανσης και αφαιρέστε τον διαλύτη μέσω περιστροφικού εξατμιστή για να αφήσετε το καθαρό ουδέτερο συστατικό.
Συμπέρασμα.
Οι μέθοδοι εκχύλισης χρησιμοποιούνται για την εκχύλιση ορισμένων ουσιών από μίγμα. Οι ουσίες αυτές μπορεί να είναι βάσεις, οξέα ή ουδέτερα (πολικά ή μη πολικά). Για παράδειγμα, αυτή η μέθοδος χρησιμοποιείται κατά την παραγωγή αμφεταμίνης στο στάδιο της απομάκρυνσης: συλλέγεται το ανώτερο στρώμα που περιέχει τη βάση της αμφεταμίνης σε αλκοόλη. Μπορεί να ξηρανθεί λίγο με άνυδρο θειικό μαγνήσιο και η σκωρία μπορεί να εκχυλιστεί επιπλέον με μη πολικό διαλύτη (αιθέρα, βενζόλιο, τολουόλιο), ο διαλύτης στη συνέχεια εξατμίζεται. Η παραγωγή μεφεδρώνων περιλαμβάνει χειρισμό με διαχωριστικό χωνί και εκχύλιση. Επίσης, η εκχύλιση οξέος-βάσης χρησιμοποιείται στον καθαρισμό ορισμένων ψυχοδραστικών ουσιών από προσμίξεις.
Attachments
Last edited: