La mefedrona (4-metilmetcatinona) es una droga estimulante β-cetoanfetamina de abuso con estrechas similitudes estructurales y mecanísticas con la metanfetamina. Una de las acciones más potentes asociadas a la mefedrona es su capacidad para estimular la liberación de dopamina (DA) y bloquear su recaptación mediante su interacción con el transportador de dopamina (DAT). Aunque la mefedrona no causa toxicidad en las terminaciones nerviosas DA, su capacidad para servir como bloqueador del DAT podría proporcionar protección contra la neurotoxicidad inducida por la metanfetamina, al igual que otros inhibidores del DAT. Para probar esta posibilidad, se trató a ratones con mefedrona (10, 20 o 40 mg/kg) antes de cada inyección de un régimen neurotóxico de metanfetamina (4 inyecciones de 2,5 o 5,0 mg/kg a intervalos de 2 horas). La integridad de las terminaciones nerviosas DA del cuerpo estriado se evaluó mediante medidas de los niveles de DA, DAT y tirosina hidroxilasa. Ninguna dosis de mefedrona evitó la toxicidad moderada a grave de la DA asociada a las distintas dosis de metanfetamina, sino que, de hecho, aumentó significativamente. La hipertermia causada por el tratamiento combinado con mefedrona y metanfetamina fue la misma que la observada con cualquiera de los dos fármacos por separado. La mefedrona también potenció los efectos neurotóxicos de la anfetamina y la MDMA sobre las terminaciones nerviosas DA. En cambio, la nomifensina protegió contra la neurotoxicidad inducida por la metanfetamina. Dado que la mefedrona aumenta la neurotoxicidad de la metanfetamina, los presentes resultados sugieren que interactúa con la DAT de un modo distinto al de otros inhibidores típicos de la DAT. Los efectos relativamente inocuos de la mefedrona por sí sola sobre las terminaciones nerviosas DA enmascaran una interacción potencialmente peligrosa con drogas que a menudo se consumen conjuntamente con ella, lo que conduce a una mayor neurotoxicidad.
La mefedrona (4-metilmetcatinona) es un derivado de la catinona y un análogo estructural de la metanfetamina y la 3,4-metilendioximetanfetamina (MDMA). La mefedrona es uno de los ingredientes psicoactivos de las "sales de baño", junto con otros compuestos como la metilona, la butilona y la 3,4-metilendioxipirovalerona (MDPV). Las β-cetoanfetaminas son objeto de un consumo cada vez mayor debido en gran parte a la disponibilidad muy restringida de los precursores necesarios para la síntesis de metanfetamina y MDMA en laboratorios clandestinos y a la correspondiente reducción de su pureza (Winstock et al. 2011b, Brunt et al. 2011). A medida que sigue aumentando el consumo de β-cetoanfetaminas, la lista de sus efectos adversos ha ido creciendo hasta incluir complicaciones cardiovasculares, agitación, insomnio, psicosis y depresión (Schifano et al. 2011, Prosser y Nelson 2012).
Como congéneres químicos de la metanfetamina y la MDMA, no es de extrañar que las β-cetoanfetaminas tengan muchos de los mismos efectos que estas drogas anteriores sobre el sistema nervioso central. Por ejemplo, estas drogas bloquean los transportadores de dopamina (DA) y serotonina (5-HT) (DAT y SERT, respectivamente) (Cozzi et al. 1999, Rothman et al. 2003, Fleckenstein et al. 2000, Lopez-Arnau et al. 2012) y estimulan la liberación de monoaminas in vitro (Kalix y Glennon 1986, Gygi et al. 1997, Rothman et al. 2003) e in vivo (Gygi et al. 1997, Kehr et al. 2011). La metcatinona causa reducciones persistentes de la actividad de la triptófano hidroxilasa y la tirosina hidroxilasa (TH) y depleción de DA y 5-HT (Gygi et al. 1997, Gygi et al. 1996, Sparago et al. 1996). Los estudios de imágenes PET en consumidores abstinentes de metcatinona revelaron una reducción de la densidad DAT estriatal, lo que sugiere una pérdida de terminales DA (McCann y colab. 1998). La estimulación simultánea de la liberación de DA y la inhibición de su captación reflejan los elementos críticos subyacentes a la neurotoxicidad asociada a la metanfetamina (Kuhn et al. 2008, Yamamoto y Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Nosotros (Angoa-Pérez et al. 2012) y otros (Baumann et al. 2012, Hadlock et al. 2011) investigamos recientemente la posibilidad de que la mefedrona pudiera causar neurotoxicidad como la metanfetamina y la MDMA. Sorprendentemente, la mefedrona no era tóxica para las terminaciones nerviosas DA del cuerpo estriado (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). La cuestión de si la mefedrona daña las terminaciones nerviosas 5-HT sigue sin resolverse, ya que un estudio documentó efectos positivos (Hadlock et al. 2011) mientras que otro fue negativo (Baumann et al. 2012). A la luz del efecto relativamente benigno de la mefedrona en las terminaciones nerviosas DA y teniendo en cuenta sus propiedades como bloqueador de DAT, planteamos la hipótesis de que en realidad podría proteger el sistema neuronal DA de los efectos neurotóxicos de la metanfetamina, al igual que se sabe que ocurre con otros bloqueadores de DAT como el ácido anfonelico (Pu et al. 1994, Schmidt y Gibb 1985, Marek et al. 1990) y la nomifensina (Poth et al. 2012). Actualmente, informamos de que la mefedrona aumenta significativamente la neurotoxicidad de la metanfetamina. Este efecto se extiende a la anfetamina y la MDMA, drogas de las que a menudo se abusa junto con la mefedrona (Feyissa y Kelly 2008, Schifano et al. 2011). Estos sorprendentes resultados arrojan una nueva luz sobre el abuso de la mefedrona y añaden urgencia al reconocimiento de esta sutil y peligrosa propiedad de esta β-cetoanfetamina.
Materiales y métodos
Drogas y reactivos
El clorhidrato de mefedrona y la 3,4-metilendioximetanfetamina (MDMA) se obtuvieron del Programa de Suministro de Drogas de Recursos de Investigación del NIDA. (+) El clorhidrato de metanfetamina, el maleato de nomifensina, el sulfato de d-anfetamina, el pentobarbital, el DA y todos los tampones y reactivos para HPLC se adquirieron a Sigma-Aldrich (St. Louis, MO, EE.UU.). Los kits de ensayo de proteínas de ácido bicinconínico se obtuvieron de Pierce (Rockford, IL, EE.UU.). Los anticuerpos policlonales contra la TH de rata se produjeron como se ha descrito previamente (Kuhn y Billingsley 1987). Los anticuerpos monoclonales contra el DAT de rata fueron proporcionados generosamente por la Dra. Roxanne A. Vaughan (Universidad de Dakota del Norte, Grand Forks, ND, EE.UU.). Los anticuerpos secundarios anti-IgG conjugados con HRP fueron proporcionados por Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, EE.UU.).
Animales
Se alojaron 5 ratones hembra C57BL/6 (Harlan, Indianapolis, IN, EE.UU.) de 20-25 g de peso en el momento de la experimentación en jaulas grandes tipo caja de zapatos en una habitación con luz (12 h luz/oscuridad) y temperatura controladas. Se utilizaron ratones hembra porque se sabe que son muy sensibles al daño neuronal por las anfetaminas neurotóxicas y para mantener la coherencia con nuestros estudios previos de neurotoxicidad por metanfetamina (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). Los ratones tenían libre acceso a comida y agua. El Comité de Cuidado y Uso Institucional de la Universidad Estatal Wayne aprobó el cuidado de los animales y los procedimientos experimentales. Todos los procedimientos se ajustaron también a la Guía de los NIH para el cuidado y uso de animales de laboratorio.
Procedimientos farmacológicos, fisiológicos y conductuales
Los ratones se trataron con mefedrona mediante un régimen tipo atracón compuesto por 4 inyecciones de 10, 20 o 40 mg/kg con un intervalo de 2 h entre cada inyección. Este régimen de tratamiento de atracón, cuando se utiliza para inyectar anfetaminas sustituidas y derivados de la catinona, produce un daño extenso en las terminaciones nerviosas DA. Las dosis de mefedrona utilizadas actualmente demostraron previamente no ser tóxicas para las terminaciones nerviosas DA (Angoa-Pérez et al. 2012). Los ratones fueron tratados con metanfetamina (4X 2,5 o 5 mg/kg), anfetamina (4X 5 mg/kg) o MDMA (4X 20 mg/kg) solos o en combinación con mefedrona. Cuando fueron tratados con dos drogas, los ratones recibieron una inyección de mefedrona 30 min antes de cada una de las 4 inyecciones de metanfetamina, anfetamina o MDMA. Los controles recibieron inyecciones de solución salina fisiológica en el mismo programa utilizado para la mefedrona sola o en combinación con otras anfetaminas. Como control de los efectos de un inhibidor DAT sobre la toxicidad de la metanfetamina, se trató a los ratones con nomifensina (4X 5 mg/kg) 30 min antes de cada inyección de metanfetamina (4X 5 mg/kg). Todas las inyecciones se administraron por vía i.p.. Los ratones fueron sacrificados 2 días después del último tratamiento farmacológico, cuando la neurotoxicidad asociada a la anfetamina había alcanzado su máximo. La temperatura corporal se monitorizó por telemetría utilizando transpondedores de temperatura implantables IPTT-300 de Bio Medic Data Systems, Inc. (Seaford, DE, EE.UU.). Las temperaturas se registraron de forma no invasiva cada 20 minutos, comenzando 60 minutos antes de la primera inyección de METH y continuando durante 9 horas a partir de entonces, utilizando el sistema de consola DAS-5001 de Bio Medic.
Determinación del contenido de DA estriatal
El tejido estriado se diseccionó bilateralmente del cerebro después del tratamiento y se almacenó a -80°C. Los tejidos congelados se pesaron y se congelaron a temperatura ambiente. Los tejidos congelados se pesaron y sonicaron en 10 volúmenes de ácido perclórico 0,16 N a 4°C. Las proteínas insolubles se eliminaron por centrifugación. La proteína insoluble se eliminó por centrifugación y la DA se determinó por HPLC con detección electroquímica como se ha descrito previamente para la metanfetamina (Thomas et al. 2010, Thomas et al, 2009).
Determinación de los niveles de proteínas TH y DAT mediante inmunotransferencia
Los efectos de los tratamientos farmacológicos sobre los niveles estriatales de TH y DAT se determinaron mediante inmunotransferencia como índice de toxicidad para las terminaciones nerviosas DA estriatales. Los ratones fueron sacrificados por decapitación después del tratamiento y el estriado se disecó bilateralmente. El tejido se almacenó a -80°C. El tejido congelado se disgregó por sonicación en SDS al 1% a 95°C y el material insoluble se sedimentó por centrifugación. Se determinó la proteína por el método del ácido bicinconínico y se resolvieron cantidades iguales de proteína (70 μg/l) mediante electroforesis en gel de SDS-poliacrilamida y luego se electroborraron en nitrocelulosa. Los blots se bloquearon en solución salina tamponada con Tris que contenía Tween 20 (0,1% v/v) y un 5% de leche en polvo descremada durante 1 h a temperatura ambiente. Los anticuerpos primarios contra TH (1:1000) o DAT (1:1000) se añadieron a los blots y se dejaron incubar durante 16 h a 4°C. Los blots se lavaron 3 veces en tampón salino Tris con Tween 20 (1% v/v) y 5% de leche descremada. Los blots se lavaron 3 veces en solución salina tamponada con Tris para eliminar los anticuerpos que no habían reaccionado y, a continuación, se incubaron con un anticuerpo secundario anti-IgG conjugado con HRP (1:4000) durante 1 h a temperatura ambiente. Las bandas inmunorreactivas se visualizaron mediante quimioluminiscencia mejorada y las densidades relativas de las bandas reactivas TH y DAT se determinaron mediante imágenes con una Kodak Image Station (Carestream Molecular Systems, Rochester, NY, EE.UU.) y se cuantificaron utilizando el software ImageJ (NIH).
Análisis de datos
Se realizaron ANOVAs de dos vías para analizar los efectos de dosis de metanfetamina frente a mefedrona sobre DA, DAT y TH. Se comprobó la significación de los efectos de los tratamientos farmacológicos sobre el contenido estriatal de DA, TH y DAT mediante ANOVA unidireccional seguido de la prueba de comparación múltiple de Tukey. Los resultados de los tratamientos farmacológicos sobre la temperatura corporal central a lo largo del tiempo se analizaron mediante un ANOVA de dos vías seguido de la prueba de Bonferroni para determinar la significación de las diferencias de temperatura en momentos individuales tras el tratamiento. Las diferencias se consideraron significativas si p < 0,05. Todos los análisis estadísticos se realizaron con GraphPad Prism versión 5.02 para Windows (GraphPad Software, San Diego, CA, EE.UU., www.graphpad.com).
Ir a:
Resultados
Efectos de la mefedrona sobre la neurotoxicidad inducida por metanfetamina
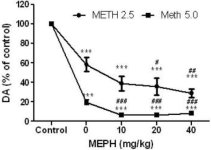
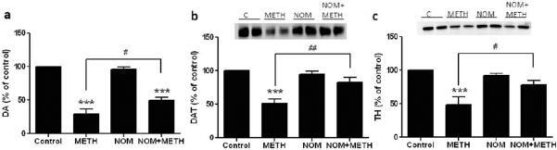
La mefedrona, en dosis (10, 20 o 40 mg/kg) que se sabe que no causan toxicidad en las terminaciones nerviosas DA (Angoa-Pérez et al. 2012) se administró 30 min antes de cada inyección de metanfetamina. La metanfetamina se administró en dosis que causan daños moderados (4X 2,5 mg/kg) o graves (4X 5 mg/kg) en las terminaciones nerviosas DA del cuerpo estriado (Thomas et al. 2004, Thomas et al. 2010). Los resultados presentados en la Fig. 1 muestran que los efectos principales de la dosis de metanfetamina (F1,40 = 66,60, p < 0,0001) y la dosis de mefedrona (F4,40 = 131,3, p < 0,0001) sobre los niveles de DA en el cuerpo estriado fueron altamente significativos mediante ANOVA de dos vías. El efecto principal de la mefedrona administrada en combinación con 2,5 mg/kg (F4,22 = 35,96, p < 0,001) o 5,0 mg/kg de metanfetamina (F4,17 = 953,9, p < 0,0001) también fue altamente significativo mediante ANOVA unidireccional. Todos los tratamientos con cualquiera de las dosis de metanfetamina ± mefedrona causaron reducciones significativamente mayores de DA en comparación con el control respectivo (p < 0,0001 para todos). La Fig. 1 también muestra que las dosis de mefedrona de 20 (p < 0,01) y 40 mg/kg (p < 0,001) potenciaron significativamente los efectos depletivos de 2,5 mg/kg de metanfetamina sobre la DA, mientras que todas las dosis de mefedrona potenciaron significativamente los efectos de 5,0 mg/kg de metanfetamina sobre los niveles de DA (p < 0,0001 para todas).
Fig.1
Efectos de la mefedrona sobre las reducciones de DA estriatal inducidas por metanfetamina. Los ratones fueron tratados con las dosis indicadas de mefedrona (MEPH) 30 min antes de cada inyección de 2,5 (-) o 5,0 mg/kg (■) de metanfetamina (METH) y sacrificados 2d después para la determinación de los niveles estriatales de DA por HPLC. Los datos son la media ± SEM de 5-7 ratones por grupo. Algunas barras de error eran demasiado pequeñas para exceder el tamaño de los símbolos y no aparecen visibles. ***p < 0,001 frente a controles y #p < 0,01, ##p < 0,001 o ###p < 0,0001 frente a la dosis respectiva de metanfetamina (prueba de comparación múltiple de Tukey).
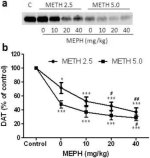
La Fig. 2a muestra que la mefedrona aumentó significativamente las reducciones inducidas por la metanfetamina en los niveles de DAT, según se determinó mediante inmunotransferencia. Los inmunoblots fueron cuantificados y de acuerdo con los resultados para DA, los efectos principales de la dosis de metanfetamina (F1,92 = 9,48, p < 0,001) y la dosis de mefedrona (F4,92 = 37,56, p < 0,0001) en los niveles de DAT en el cuerpo estriado fueron altamente significativos por ANOVA de dos vías (Fig. 2b). El efecto principal de la mefedrona administrada en combinación con 2.5 mg/kg (F4,56 = 15.55, p < 0.0001) o 5.0 mg/kg de metanfetamina (F4,39 = 24.84, p < 0.0001) también fue altamente significativo por ANOVA de una vía. Todos los tratamientos con cualquiera de las dosis de metanfetamina ± mefedrona causaron reducciones significativamente mayores en DAT en comparación con el control respectivo (p < 0.01 para 2.5 mg/kg de metanfetamina sola; p < 0.0001 para todos los demás tratamientos). La Fig. 2b también muestra que las dosis de mefedrona de 20 mg/kg (p < 0,01) y 40 mg/kg (p < 0,001) aumentaron significativamente las reducciones de DAT causadas por 2,5 mg/kg de metanfetamina, mientras que sólo la dosis de mefedrona de 40 mg/kg aumentó significativamente (p < 0,01) los efectos de 5,0 mg/kg de metanfetamina sobre las reducciones de DAT.
Fig.2
Efectos de la mefedrona sobre las reducciones de DAT estriatal inducidas por metanfetamina. Los ratones fueron tratados con las dosis indicadas de mefedrona (MEPH) 30 min antes de cada inyección de 2,5 (●) o 5,0 mg/kg (■) de metanfetamina (METH) y sacrificados 2d después para determinar los niveles estriatales de DAT mediante inmunotransferencia (a). Las manchas se cuantificaron mediante ImageJ y los datos son la media ± SEM de 10-12 ratones por grupo (b). *p < 0,01 o ***p < 0,0001 frente a control (C) y #p < 0,01 o ##p < 0,001 frente a la dosis respectiva de metanfetamina (prueba de comparación múltiple de Tukey).
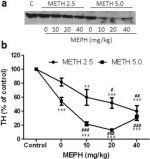
La Fig. 3a muestra que la mefedrona aumentó significativamente las reducciones inducidas por la metanfetamina en los niveles de TH, según se determinó mediante inmunotransferencia. Los inmunoblots fueron cuantificados y de acuerdo con los resultados anteriores para DA y DAT, los efectos principales de la dosis de metanfetamina (F1,81 = 47,89, p < 0,0001) y la dosis de mefedrona (F4,81 = 63,57, p < 0,0001) fueron altamente significativos por ANOVA de dos vías (Fig. 3b). El efecto principal de la mefedrona administrada en combinación con 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) o 5,0 mg/kg de metanfetamina (F4,49 = 99,16, p < 0,0001) también fue altamente significativo mediante ANOVA unidireccional. Todos los tratamientos con cualquier dosis de metanfetamina ± mefedrona causaron reducciones significativamente mayores en TH en comparación con el control respectivo (p < 0,001 para 2,5 mg/kg de metanfetamina + 10 mg/kg de mefedrona; p < 0,0001 para todas las demás combinaciones) con la excepción de 2,5 mg/kg de metanfetamina sola que no cambió significativamente los niveles de TH (es decir, sin toxicidad). La Fig. 3b también muestra que las dosis de mefedrona de 20 mg/kg (p < 0,01) y 40 mg/kg (p < 0,001) aumentaron significativamente las reducciones de TH causadas por 2,5 mg/kg de metanfetamina y las tres dosis de mefedrona aumentaron significativamente (p < 0,0001) los efectos de 5,0 mg/kg de metanfetamina sobre las reducciones de TH.
Fig. 3
Efectos de la mefedrona sobre las reducciones del TH estriatal inducidas por la metanfetamina. Los ratones fueron tratados con las dosis indicadas de mefedrona (MEPH) 30 min antes de cada inyección de 2,5 (●) o 5,0 mg/kg (■) de metanfetamina (METH) y sacrificados 2d después para determinar los niveles estriatales de TH mediante inmunotransferencia (a). Las manchas se cuantificaron mediante ImageJ y los datos son la media ± SEM de 10-12 ratones por grupo (b). Algunas barras de error eran demasiado pequeñas para exceder el tamaño de los símbolos y no aparecen visibles. **p < 0,001 o ***p < 0,0001 frente a control (C) y #p < 0,01, ##p < 0,001 o ###p < 0,0001) frente a la dosis respectiva de metanfetamina (prueba de comparación múltiple de Tukey).
Efectos de la mefedrona sobre la hipertermia inducida por metanfetamina
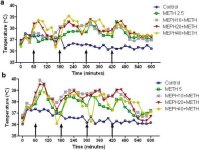
La mefedrona, al igual que la metanfetamina, provoca una hipertermia significativa (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Cuando se administró mefedrona 30 min antes de cada inyección de metanfetamina, puede verse en la Fig. 4 que los efectos principales de las dosis de metanfetamina y mefedrona (F1,300 = 11,99, p < 0,0001) sobre el tiempo (F4,300 = 51,73, p < 0,0001) fueron altamente significativos mediante ANOVA de dos vías. Los efectos principales de la mefedrona administrada en combinación con 2,5 mg/kg de metanfetamina (F4,120 = 41,44, p < 0,0001, panel a) a lo largo del tiempo (F30,120 = 3,84, p < 0,0001) o 5,0 mg/kg de metanfetamina (F4,120 = 78,09, p < 0,0001, panel b) a lo largo del tiempo (F30,120 = 9,98, p < 0,0001) también fueron altamente significativos mediante ANOVA de dos vías. Todos los tratamientos con cualquiera de las dosis de metanfetamina ± mefedrona fueron significativamente diferentes de los respectivos controles (p < 0,0001 para todos los tratamientos).
Fig. 4
Efectos de la mefedrona sobre la hipertermia inducida por metanfetamina. Los ratones fueron tratados con las dosis indicadas de mefedrona (MEPH) 30 min antes de cada inyección de 2,5 (a) o 5,0 mg/kg (b) de metanfetamina (METH). Las temperaturas centrales se midieron a intervalos de 20 min mediante telemetría, comenzando 60 min antes de la primera inyección de metanfetamina. Las 4 inyecciones de metanfetamina se indican con las flechas apoyadas en el eje x. Los datos se expresan como temperatura corporal media de 6-8 ratones por grupo. Los SEM fueron siempre < 10% de la media y se omiten en aras de la claridad.
Efectos de la mefedrona sobre la neurotoxicidad inducida por anfetamina y MDMA
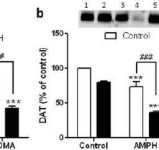
Para comprobar si los efectos potenciadores de la mefedrona sobre la metanfetamina podían extenderse a otras anfetaminas neurotóxicas, se trató a ratones con esta β-cetoanfetamina (20 mg/kg) más anfetamina (4X 5 mg/kg) o MDMA (4X 20 mg/kg) y los resultados se presentan en la Fig. 5. Recordemos que la mefedrona por sí misma no reduce DA, DAT o TH estriatales (Angoa-Perez et al. 2012). El efecto principal de la droga (F5,27 = 27,18, p < 0,0001) fue altamente significativo mediante ANOVA unidireccional para las reducciones de DA (Fig. 5a). También puede observarse en la Fig. 5a que todos los tratamientos con anfetamina (p < 0,001) o MDMA (p < 0,001) solos o en combinación con mefedrona (p < 0,0001 para ambas drogas) redujeron significativamente los niveles de DA respecto al control. La mefedrona aumentó significativamente las reducciones de DA causadas por la anfetamina (p < 0,01) o la MDMA (p < 0,01). La Fig. 5b muestra efectos similares de la combinación de tratamientos farmacológicos sobre los niveles de DAT en el cuerpo estriado. El efecto principal de la droga (F4,49 = 42.63, p < 0.0001) fue altamente significativo por ANOVA de una vía para DAT. También puede verse en la Fig. 5b que todos los tratamientos con anfetamina o MDMA fueron significativamente (p < 0,0001 para todos) más bajos en comparación con el control. La mefedrona también aumentó significativamente las reducciones de DAT causadas por anfetamina o MDMA (p < 0.0001 en ambos casos). Finalmente, la Fig. 5c muestra que el efecto principal de la droga (F4,50 = 75,06, p < 0,0001) fue altamente significativo mediante ANOVA unidireccional para las reducciones de TH. También puede verse en la Fig. 5c que todos los tratamientos con anfetamina o MDMA fueron significativamente (p < 0,0001 para todos) más bajos en comparación con el control. La mefedrona también aumentó significativamente las reducciones de TH causadas por anfetamina o MDMA (p < 0,0001 en ambos casos).
Fig. 5
Efectos de la mefedrona sobre la neurotoxicidad de las terminaciones nerviosas DA inducida por anfetamina o MDMA. Los ratones fueron tratados con 20 mg/kg de mefedrona (MEPH) 30 min antes de cada inyección de 5,0 mg/kg de anfetamina (AMPH) o 20 mg/kg de MDMA y sacrificados 2d después del tratamiento para la determinación de los niveles estriatales de (a) DA por HPLC. (b) DAT y (c) TH se determinaron mediante inmunotransferencia y los blots se cuantificaron mediante ImageJ. Los inmunoblots representativos de DAT y TH se incluyen como recuadros en los paneles (b) y (c) respectivamente y los tratamientos para ambos paneles se indican con 1,5: control; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; y 8: MDMA + MEPH. Los datos son la media ± SEM de 5-12 ratones en cada grupo. **p < 0,001 o ***p < 0,0001 frente a control y #p < 0,01 o ###p < 0,0001 frente a AMPH o MDMA (prueba de comparación múltiple de Tukey).
Efectos de la nomifensina sobre la neurotoxicidad inducida por metanfetamina
La nomifensina, un potente bloqueador DAT sin potencial neurotóxico o de abuso conocido, fue probada por su capacidad de proteger contra la neurotoxicidad inducida por metanfetamina y por contraste con las acciones de la mefedrona sobre la toxicidad a las terminaciones nerviosas DA causada por metanfetamina, anfetamina y MDMA. Los resultados en la Fig. 6a muestran que el efecto principal de la droga (F3,16 = 63,39, p < 0,0001) en los niveles de DA fue altamente significativo por ANOVA unidireccional. La nomifensina sola no alteró los niveles de DA, pero la reducción causada por la metanfetamina (p < 0,0001) fue leve pero significativamente revertida por la nomifensina (p < 0,01). El efecto principal de la droga (F3,20 = 16.78, p < 0.0001) en los niveles de DAT fue altamente significativo por ANOVA de una vía como se muestra en la Fig. 6b. La nomifensina no cambió los niveles de DAT pero proporcionó una protección significativa (p < 0,001) contra la reducción de la DAT estriatal causada por la metanfetamina (p < 0,0001) en comparación con el control. Finalmente, la Fig. 6c muestra que el efecto principal de la droga (F3,15 = 14.10, p < 0.0001) sobre los niveles de TH fue altamente significativo por ANOVA de una vía. Como se vio para DA y DAT, la reducción en TH causada por metanfetamina (p < 0.0001) fue leve pero significativamente prevenida por nomifensina (p < 0.01).
Fig. 6
Efectos de la nomifensina sobre la neurotoxicidad de las terminaciones nerviosas DA inducida por la metanfetamina. Los ratones fueron tratados con 5,0 mg/kg de nomifensina (NOM) 30 min antes de cada inyección de 5,0 mg/kg de metanfetamina (METH) y sacrificados 2d después para la determinación de los niveles estriatales de (a) DA por HPLC. (b) DAT y (c) TH se determinaron mediante inmunotransferencia y los blots se cuantificaron utilizando ImageJ. Se incluyen inmunotransferencias representativas de DAT y TH en los recuadros de los paneles (b) y (c) respectivamente. Los datos son la media más el SEM de 5-7 ratones por grupo. ***p < 0,0001 frente a control (C) y #p < 0,01 o ##p < 0,001 frente a metanfetamina sola (prueba de comparación múltiple de Tukey).
Discusión
El objetivo del presente estudio era determinar si la mefedrona prevendría la toxicidad de las terminaciones nerviosas DA causada por la metanfetamina. Basándose en su similitud química con la metanfetamina y la MDMA, inicialmente se esperaba que la mefedrona ejerciera efectos dañinos sobre el sistema neuronal DA. Sin embargo, varios estudios establecieron casi simultáneamente que la mefedrona no era tóxica para las terminaciones nerviosas DA (Angoa-Pérez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). La cuestión de si esta droga causa daños en el sistema neuronal 5-HT sigue abierta. Un estudio informó de reducciones persistentes en la función de las terminaciones nerviosas 5-HT (Hadlock et al. 2011), mientras que otro descubrió que la mefedrona no causaba daños (Baumann et al. 2012). La mefedrona interactúa con la terminación nerviosa DA de una manera que sugiere que efectivamente estimula la liberación y bloquea la recaptación de DA a través de sus interacciones con la DAT. Una faceta clave del mecanismo de acción neurotóxico de la metanfetamina es su capacidad para acceder a las terminaciones nerviosas DA a través de la DAT y alterar la homeostasis DA (Sulzer 2011). Si este primer paso en la cascada neurotóxica de la metanfetamina se evita mediante la inhibición de la DAT, se previene la toxicidad (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt y Gibb 1985). Razonamos que la mefedrona podría tener esta misma propiedad protectora que otros inhibidores de la DAT, pero observamos en cambio un aumento significativo de la toxicidad. Esta interacción se observó utilizando dos dosis diferentes de metanfetamina que causan daños moderados o severos en las terminaciones nerviosas DA (4X 2,5 o 5,0 mg/kg, respectivamente). Este efecto potenciador de la mefedrona no se limitó a la metanfetamina y se extendió a la anfetamina y la MDMA, dos drogas de las que se suele abusar conjuntamente con la mefedrona y otras β-cetoanfetaminas (Feyissa y Kelly 2008, Schifano et al. 2011, Kelly 2011). Por tanto, a pesar de que la mefedrona no causa toxicidad al menos en las terminaciones nerviosas DA del cuerpo estriado, potencia los efectos neurotóxicos de otras drogas de abuso. Este nuevo hallazgo debería poner aún más en evidencia el abuso de la mefedrona, ya que su falta de neurotoxicidad intrínseca puede hacerla parecer inocua.
La hipertermia es un efecto adverso agudo comúnmente notificado de la ingestión de metanfetamina (Greene et al. 2008) y β-cetoanfetamina en humanos (Borek y Holstege 2012, Prosser y Nelson 2012). Al igual que la metanfetamina, muchas de las drogas β-cetoanfetamínicas también causan elevaciones significativas de la temperatura central en roedores (Angoa-Pérez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Aunque la hipertermia causada por la metanfetamina podría contribuir a sus efectos perjudiciales morfológicos y neuronales, no es necesariamente el caso que la hipertermia sea la causa directa de estos efectos (Kiyatkin y Sharma 2009). Registramos las temperaturas corporales centrales en ratones tratados con mefedrona y metanfetamina y observamos que el tratamiento combinado no aumentaba las temperaturas más allá de los aumentos máximos observados con cualquiera de los dos fármacos por separado. La metanfetamina provocó un aumento de la temperatura corporal relacionado con la dosis y esta hipertermia fue invariable en todo el intervalo de dosis de mefedrona probado. De hecho, el descenso de la temperatura corporal tras la inyección observado tras el tratamiento con mefedrona (Angoa-Pérez et al. 2012) se mantuvo con dosis más altas de mefedrona más metanfetamina. Aunque la hipertermia inducida por la droga no aumentó con el tratamiento farmacológico combinado, los efectos neurotóxicos fueron aditivos. Por lo tanto, al menos en este caso, parece que los efectos neurotóxicos de la metanfetamina pueden ser potenciados por la mefedrona de forma independiente de la hipertermia.
La mefedrona inhibe claramente la función DAT y bloquea la recaptación de DA in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). La mefedrona desplaza al WIN-35,428 de su sitio de unión en la DAT, lo que sugiere que es un inhibidor competitivo de la captación de DA (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). La potencia de la mefedrona en este sentido es muy similar a la de la metanfetamina (Cozzi et al. 1999) y la MDMA (Escubedo et al. 2011). No se sabe si la mefedrona es transportada por la DAT, pero la metcatinona sí (Cozzi y Foley 2003). La nomifensina y el ácido anfonelico, que se unen a la DAT e inhiben la captación de DA, proporcionan una protección sustancial contra la neurotoxicidad inducida por la metanfetamina (Pu et al. 1994, Marek et al. 1990, Schmidt y Gibb 1985, Poth et al. 2012) y los ratones que carecen de la DAT son resistentes a la toxicidad neuronal de la metanfetamina (Fumagalli et al. 1998). Sabiendo que la mefedrona no es neurotóxica y que es un bloqueador de la DAT, cabe predecir que debería prevenir la toxicidad. En este sentido, probamos la nomifensina como control positivo y confirmamos que protege contra la depleción de DA, DAT y TH inducida por la metanfetamina. La nomifensina también inhibe el transportador de norepinefrina (Brogden et al. 1979), pero esta propiedad no puede explicar los presentes resultados porque la mayoría de las β-cetoanfetaminas, incluida la mefedrona, inhiben el transportador de norepinefrina y bloquean la captación de norepinefrina (Kelly 2011, Rothman et al. 2003, Cozzi et al. 1999, Sogawa et al. 2011, Lopez-Arnau et al. 2012). Un papel del sistema neuronal 5-HT en algunas de las acciones farmacológicas de la mefedrona es posible a la luz de la capacidad de esta droga, al igual que la MDMA (Yamamoto et al. 1995), para provocar el eflujo de DA estriatal a través de sus interacciones con los receptores 5-HT2A (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). La hiperlocución causada por la mefedrona depende de la 5-HT endógena (Lopez-Arnau et al. 2012) y esta droga también estimula la liberación de 5-HT e inhibe su captación in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) e in vivo (Baumann et al. 2012, Kehr et al. 2011). Sin embargo, podemos descartar un papel de la 5-HT endógena en la neurotoxicidad DA de al menos la metanfetamina al demostrar que los ratones genéticamente desprovistos de 5-HT conservan su sensibilidad a la neurotoxicidad (Thomas et al. 2010).
La mefedrona podría potenciar la neurotoxicidad de la metanfetamina por varios mecanismos posibles. En primer lugar, la mefedrona podría interactuar con la VMAT para provocar la fuga de DA al citoplasma de la terminación nerviosa presináptica. Los tratamientos que aumentan la reserva citoplasmática (es decir, liberable por el fármaco) de DA aumentan la neurotoxicidad de la metanfetamina (Thomas et al. 2008, Thomas et al. 2009, Schmidt et al. 1985). Este mecanismo no es probable porque la metcatinona sólo interactúa débilmente con la VMAT (Cozzi et al. 1999). En segundo lugar, la combinación de mefedrona más metanfetamina podría tener un efecto sinérgico sobre la liberación no vesicular de DA, pero esta posibilidad también parece poco probable a la luz de los resultados que muestran que el tratamiento de células CHO que expresan DAT o SERT con mefedrona más metanfetamina no tiene un efecto aditivo sobre la liberación de DA o 5-HT (Sogawa et al. 2011). En tercer lugar, la mefedrona podría interactuar con la DAT de una manera novedosa que contribuya a la toxicidad aditiva. Se ha demostrado que la metilona en combinación con la metanfetamina causa citotoxicidad sinérgica en células CHO que expresan la DAT o la SERT, pero no en células CHO de tipo salvaje que carecen de los transportadores (Sogawa et al. 2011). La citotoxicidad observada en las células cultivadas en estos estudios (es decir, la liberación de LDH) es muy diferente del daño a las terminaciones nerviosas DA causado por la metanfetamina, pero este mecanismo sugiere un papel interesante pero indefinido de la DAT en el aumento de la citotoxicidad. Por último, la mefedrona podría modificar el metabolismo de la metanfetamina. La mefedrona se metaboliza principalmente por N-desmetilación (Meyer y Maurer 2010), al igual que la metanfetamina y la MDMA (Caldwell 1976). Este mecanismo se apoya en la demostración de que la metanfetamina y la MDMA inhiben mutuamente la producción de sus respectivos metabolitos primarios y elevan los niveles plasmáticos de la droga por encima de los observados tras la administración de cualquiera de ellas por separado (Kuwayama et al. 2012). Las dosis de mefedrona utilizadas actualmente y en nuestro estudio anterior (Angoa-Pérez et al. 2012), aunque elevadas, no son neurotóxicas y se sitúan dentro del intervalo consumido por los seres humanos (McErath y O'Neill 2011). Por lo tanto, la mefedrona podría estar actuando como la MDMA para aumentar los niveles plasmáticos de metanfetamina inhibiendo su metabolismo. Será necesario un análisis farmacocinético en profundidad para confirmar esta última posibilidad.
El abuso de las β-cetoanfetaminas está aumentando a un ritmo alarmante y la mefedrona es ahora una de las drogas más consumidas después del cannabis, la MDMA y la cocaína (Morris 2010, Winstock et al. 2011b). Además, la mefedrona induce una mayor sensación de ansia en los humanos en comparación con la MDMA (Brunt et al. 2011) y los consumidores que esnifan mefedrona la consideran más adictiva que la cocaína (Winstock et al. 2011b). La mefedrona es consumida por los humanos de forma similar a un atracón (es decir, "apilada") y a menudo se toma con otras drogas como el cannabis y los psicoestimulantes anfetamínicos (Schifano et al. 2011, Fass et al. 2012, Winstock et al. 2011a, Kelly 2011, Torrance y Cooper 2010). La mefedrona se encuentra cada vez más en comprimidos que se venden como MDMA (Brunt et al. 2011) y es probable que su consumo supere al de la MDMA a medida que siga disminuyendo la pureza de esta última droga (Brunt et al. 2011, Tanner-Smith 2006, Teng et al. 2006). Basándonos en los patrones comunes de abuso de mefedrona y otros ingredientes de las "sales de baño", es importante considerar si se acumulan riesgos adicionales para la salud en humanos cuando estas drogas se combinan con las anfetaminas de forma intencionada o no. Nuestros resultados, que demuestran que al menos la mefedrona potencia significativamente la neurotoxicidad de las terminaciones nerviosas DA del cuerpo estriado causada por la metanfetamina, la anfetamina y la MDMA, revelan una propiedad especialmente peligrosa e inesperada de esta β-cetoanfetamina.
Abreviaturas utilizadas
5-HT serotonina
DA dopamina
DAT Transportador DA
MDMA 3,4-metilendioximetanfetamina
TH tirosina hidroxilasa
VMAT transportador vesicular de monoaminas
La mefedrona (4-metilmetcatinona) es un derivado de la catinona y un análogo estructural de la metanfetamina y la 3,4-metilendioximetanfetamina (MDMA). La mefedrona es uno de los ingredientes psicoactivos de las "sales de baño", junto con otros compuestos como la metilona, la butilona y la 3,4-metilendioxipirovalerona (MDPV). Las β-cetoanfetaminas son objeto de un consumo cada vez mayor debido en gran parte a la disponibilidad muy restringida de los precursores necesarios para la síntesis de metanfetamina y MDMA en laboratorios clandestinos y a la correspondiente reducción de su pureza (Winstock et al. 2011b, Brunt et al. 2011). A medida que sigue aumentando el consumo de β-cetoanfetaminas, la lista de sus efectos adversos ha ido creciendo hasta incluir complicaciones cardiovasculares, agitación, insomnio, psicosis y depresión (Schifano et al. 2011, Prosser y Nelson 2012).
Como congéneres químicos de la metanfetamina y la MDMA, no es de extrañar que las β-cetoanfetaminas tengan muchos de los mismos efectos que estas drogas anteriores sobre el sistema nervioso central. Por ejemplo, estas drogas bloquean los transportadores de dopamina (DA) y serotonina (5-HT) (DAT y SERT, respectivamente) (Cozzi et al. 1999, Rothman et al. 2003, Fleckenstein et al. 2000, Lopez-Arnau et al. 2012) y estimulan la liberación de monoaminas in vitro (Kalix y Glennon 1986, Gygi et al. 1997, Rothman et al. 2003) e in vivo (Gygi et al. 1997, Kehr et al. 2011). La metcatinona causa reducciones persistentes de la actividad de la triptófano hidroxilasa y la tirosina hidroxilasa (TH) y depleción de DA y 5-HT (Gygi et al. 1997, Gygi et al. 1996, Sparago et al. 1996). Los estudios de imágenes PET en consumidores abstinentes de metcatinona revelaron una reducción de la densidad DAT estriatal, lo que sugiere una pérdida de terminales DA (McCann y colab. 1998). La estimulación simultánea de la liberación de DA y la inhibición de su captación reflejan los elementos críticos subyacentes a la neurotoxicidad asociada a la metanfetamina (Kuhn et al. 2008, Yamamoto y Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Nosotros (Angoa-Pérez et al. 2012) y otros (Baumann et al. 2012, Hadlock et al. 2011) investigamos recientemente la posibilidad de que la mefedrona pudiera causar neurotoxicidad como la metanfetamina y la MDMA. Sorprendentemente, la mefedrona no era tóxica para las terminaciones nerviosas DA del cuerpo estriado (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). La cuestión de si la mefedrona daña las terminaciones nerviosas 5-HT sigue sin resolverse, ya que un estudio documentó efectos positivos (Hadlock et al. 2011) mientras que otro fue negativo (Baumann et al. 2012). A la luz del efecto relativamente benigno de la mefedrona en las terminaciones nerviosas DA y teniendo en cuenta sus propiedades como bloqueador de DAT, planteamos la hipótesis de que en realidad podría proteger el sistema neuronal DA de los efectos neurotóxicos de la metanfetamina, al igual que se sabe que ocurre con otros bloqueadores de DAT como el ácido anfonelico (Pu et al. 1994, Schmidt y Gibb 1985, Marek et al. 1990) y la nomifensina (Poth et al. 2012). Actualmente, informamos de que la mefedrona aumenta significativamente la neurotoxicidad de la metanfetamina. Este efecto se extiende a la anfetamina y la MDMA, drogas de las que a menudo se abusa junto con la mefedrona (Feyissa y Kelly 2008, Schifano et al. 2011). Estos sorprendentes resultados arrojan una nueva luz sobre el abuso de la mefedrona y añaden urgencia al reconocimiento de esta sutil y peligrosa propiedad de esta β-cetoanfetamina.
Materiales y métodos
Drogas y reactivos
El clorhidrato de mefedrona y la 3,4-metilendioximetanfetamina (MDMA) se obtuvieron del Programa de Suministro de Drogas de Recursos de Investigación del NIDA. (+) El clorhidrato de metanfetamina, el maleato de nomifensina, el sulfato de d-anfetamina, el pentobarbital, el DA y todos los tampones y reactivos para HPLC se adquirieron a Sigma-Aldrich (St. Louis, MO, EE.UU.). Los kits de ensayo de proteínas de ácido bicinconínico se obtuvieron de Pierce (Rockford, IL, EE.UU.). Los anticuerpos policlonales contra la TH de rata se produjeron como se ha descrito previamente (Kuhn y Billingsley 1987). Los anticuerpos monoclonales contra el DAT de rata fueron proporcionados generosamente por la Dra. Roxanne A. Vaughan (Universidad de Dakota del Norte, Grand Forks, ND, EE.UU.). Los anticuerpos secundarios anti-IgG conjugados con HRP fueron proporcionados por Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, EE.UU.).
Animales
Se alojaron 5 ratones hembra C57BL/6 (Harlan, Indianapolis, IN, EE.UU.) de 20-25 g de peso en el momento de la experimentación en jaulas grandes tipo caja de zapatos en una habitación con luz (12 h luz/oscuridad) y temperatura controladas. Se utilizaron ratones hembra porque se sabe que son muy sensibles al daño neuronal por las anfetaminas neurotóxicas y para mantener la coherencia con nuestros estudios previos de neurotoxicidad por metanfetamina (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). Los ratones tenían libre acceso a comida y agua. El Comité de Cuidado y Uso Institucional de la Universidad Estatal Wayne aprobó el cuidado de los animales y los procedimientos experimentales. Todos los procedimientos se ajustaron también a la Guía de los NIH para el cuidado y uso de animales de laboratorio.
Procedimientos farmacológicos, fisiológicos y conductuales
Los ratones se trataron con mefedrona mediante un régimen tipo atracón compuesto por 4 inyecciones de 10, 20 o 40 mg/kg con un intervalo de 2 h entre cada inyección. Este régimen de tratamiento de atracón, cuando se utiliza para inyectar anfetaminas sustituidas y derivados de la catinona, produce un daño extenso en las terminaciones nerviosas DA. Las dosis de mefedrona utilizadas actualmente demostraron previamente no ser tóxicas para las terminaciones nerviosas DA (Angoa-Pérez et al. 2012). Los ratones fueron tratados con metanfetamina (4X 2,5 o 5 mg/kg), anfetamina (4X 5 mg/kg) o MDMA (4X 20 mg/kg) solos o en combinación con mefedrona. Cuando fueron tratados con dos drogas, los ratones recibieron una inyección de mefedrona 30 min antes de cada una de las 4 inyecciones de metanfetamina, anfetamina o MDMA. Los controles recibieron inyecciones de solución salina fisiológica en el mismo programa utilizado para la mefedrona sola o en combinación con otras anfetaminas. Como control de los efectos de un inhibidor DAT sobre la toxicidad de la metanfetamina, se trató a los ratones con nomifensina (4X 5 mg/kg) 30 min antes de cada inyección de metanfetamina (4X 5 mg/kg). Todas las inyecciones se administraron por vía i.p.. Los ratones fueron sacrificados 2 días después del último tratamiento farmacológico, cuando la neurotoxicidad asociada a la anfetamina había alcanzado su máximo. La temperatura corporal se monitorizó por telemetría utilizando transpondedores de temperatura implantables IPTT-300 de Bio Medic Data Systems, Inc. (Seaford, DE, EE.UU.). Las temperaturas se registraron de forma no invasiva cada 20 minutos, comenzando 60 minutos antes de la primera inyección de METH y continuando durante 9 horas a partir de entonces, utilizando el sistema de consola DAS-5001 de Bio Medic.
Determinación del contenido de DA estriatal
El tejido estriado se diseccionó bilateralmente del cerebro después del tratamiento y se almacenó a -80°C. Los tejidos congelados se pesaron y se congelaron a temperatura ambiente. Los tejidos congelados se pesaron y sonicaron en 10 volúmenes de ácido perclórico 0,16 N a 4°C. Las proteínas insolubles se eliminaron por centrifugación. La proteína insoluble se eliminó por centrifugación y la DA se determinó por HPLC con detección electroquímica como se ha descrito previamente para la metanfetamina (Thomas et al. 2010, Thomas et al, 2009).
Determinación de los niveles de proteínas TH y DAT mediante inmunotransferencia
Los efectos de los tratamientos farmacológicos sobre los niveles estriatales de TH y DAT se determinaron mediante inmunotransferencia como índice de toxicidad para las terminaciones nerviosas DA estriatales. Los ratones fueron sacrificados por decapitación después del tratamiento y el estriado se disecó bilateralmente. El tejido se almacenó a -80°C. El tejido congelado se disgregó por sonicación en SDS al 1% a 95°C y el material insoluble se sedimentó por centrifugación. Se determinó la proteína por el método del ácido bicinconínico y se resolvieron cantidades iguales de proteína (70 μg/l) mediante electroforesis en gel de SDS-poliacrilamida y luego se electroborraron en nitrocelulosa. Los blots se bloquearon en solución salina tamponada con Tris que contenía Tween 20 (0,1% v/v) y un 5% de leche en polvo descremada durante 1 h a temperatura ambiente. Los anticuerpos primarios contra TH (1:1000) o DAT (1:1000) se añadieron a los blots y se dejaron incubar durante 16 h a 4°C. Los blots se lavaron 3 veces en tampón salino Tris con Tween 20 (1% v/v) y 5% de leche descremada. Los blots se lavaron 3 veces en solución salina tamponada con Tris para eliminar los anticuerpos que no habían reaccionado y, a continuación, se incubaron con un anticuerpo secundario anti-IgG conjugado con HRP (1:4000) durante 1 h a temperatura ambiente. Las bandas inmunorreactivas se visualizaron mediante quimioluminiscencia mejorada y las densidades relativas de las bandas reactivas TH y DAT se determinaron mediante imágenes con una Kodak Image Station (Carestream Molecular Systems, Rochester, NY, EE.UU.) y se cuantificaron utilizando el software ImageJ (NIH).
Análisis de datos
Se realizaron ANOVAs de dos vías para analizar los efectos de dosis de metanfetamina frente a mefedrona sobre DA, DAT y TH. Se comprobó la significación de los efectos de los tratamientos farmacológicos sobre el contenido estriatal de DA, TH y DAT mediante ANOVA unidireccional seguido de la prueba de comparación múltiple de Tukey. Los resultados de los tratamientos farmacológicos sobre la temperatura corporal central a lo largo del tiempo se analizaron mediante un ANOVA de dos vías seguido de la prueba de Bonferroni para determinar la significación de las diferencias de temperatura en momentos individuales tras el tratamiento. Las diferencias se consideraron significativas si p < 0,05. Todos los análisis estadísticos se realizaron con GraphPad Prism versión 5.02 para Windows (GraphPad Software, San Diego, CA, EE.UU., www.graphpad.com).
Ir a:
Resultados
Efectos de la mefedrona sobre la neurotoxicidad inducida por metanfetamina
La mefedrona, en dosis (10, 20 o 40 mg/kg) que se sabe que no causan toxicidad en las terminaciones nerviosas DA (Angoa-Pérez et al. 2012) se administró 30 min antes de cada inyección de metanfetamina. La metanfetamina se administró en dosis que causan daños moderados (4X 2,5 mg/kg) o graves (4X 5 mg/kg) en las terminaciones nerviosas DA del cuerpo estriado (Thomas et al. 2004, Thomas et al. 2010). Los resultados presentados en la Fig. 1 muestran que los efectos principales de la dosis de metanfetamina (F1,40 = 66,60, p < 0,0001) y la dosis de mefedrona (F4,40 = 131,3, p < 0,0001) sobre los niveles de DA en el cuerpo estriado fueron altamente significativos mediante ANOVA de dos vías. El efecto principal de la mefedrona administrada en combinación con 2,5 mg/kg (F4,22 = 35,96, p < 0,001) o 5,0 mg/kg de metanfetamina (F4,17 = 953,9, p < 0,0001) también fue altamente significativo mediante ANOVA unidireccional. Todos los tratamientos con cualquiera de las dosis de metanfetamina ± mefedrona causaron reducciones significativamente mayores de DA en comparación con el control respectivo (p < 0,0001 para todos). La Fig. 1 también muestra que las dosis de mefedrona de 20 (p < 0,01) y 40 mg/kg (p < 0,001) potenciaron significativamente los efectos depletivos de 2,5 mg/kg de metanfetamina sobre la DA, mientras que todas las dosis de mefedrona potenciaron significativamente los efectos de 5,0 mg/kg de metanfetamina sobre los niveles de DA (p < 0,0001 para todas).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/sywobkqrnd-jpg.47/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig.1
Efectos de la mefedrona sobre las reducciones de DA estriatal inducidas por metanfetamina. Los ratones fueron tratados con las dosis indicadas de mefedrona (MEPH) 30 min antes de cada inyección de 2,5 (-) o 5,0 mg/kg (■) de metanfetamina (METH) y sacrificados 2d después para la determinación de los niveles estriatales de DA por HPLC. Los datos son la media ± SEM de 5-7 ratones por grupo. Algunas barras de error eran demasiado pequeñas para exceder el tamaño de los símbolos y no aparecen visibles. ***p < 0,001 frente a controles y #p < 0,01, ##p < 0,001 o ###p < 0,0001 frente a la dosis respectiva de metanfetamina (prueba de comparación múltiple de Tukey).
La Fig. 2a muestra que la mefedrona aumentó significativamente las reducciones inducidas por la metanfetamina en los niveles de DAT, según se determinó mediante inmunotransferencia. Los inmunoblots fueron cuantificados y de acuerdo con los resultados para DA, los efectos principales de la dosis de metanfetamina (F1,92 = 9,48, p < 0,001) y la dosis de mefedrona (F4,92 = 37,56, p < 0,0001) en los niveles de DAT en el cuerpo estriado fueron altamente significativos por ANOVA de dos vías (Fig. 2b). El efecto principal de la mefedrona administrada en combinación con 2.5 mg/kg (F4,56 = 15.55, p < 0.0001) o 5.0 mg/kg de metanfetamina (F4,39 = 24.84, p < 0.0001) también fue altamente significativo por ANOVA de una vía. Todos los tratamientos con cualquiera de las dosis de metanfetamina ± mefedrona causaron reducciones significativamente mayores en DAT en comparación con el control respectivo (p < 0.01 para 2.5 mg/kg de metanfetamina sola; p < 0.0001 para todos los demás tratamientos). La Fig. 2b también muestra que las dosis de mefedrona de 20 mg/kg (p < 0,01) y 40 mg/kg (p < 0,001) aumentaron significativamente las reducciones de DAT causadas por 2,5 mg/kg de metanfetamina, mientras que sólo la dosis de mefedrona de 40 mg/kg aumentó significativamente (p < 0,01) los efectos de 5,0 mg/kg de metanfetamina sobre las reducciones de DAT.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/bfu3sx5dnr-jpg.4797/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig.2
Efectos de la mefedrona sobre las reducciones de DAT estriatal inducidas por metanfetamina. Los ratones fueron tratados con las dosis indicadas de mefedrona (MEPH) 30 min antes de cada inyección de 2,5 (●) o 5,0 mg/kg (■) de metanfetamina (METH) y sacrificados 2d después para determinar los niveles estriatales de DAT mediante inmunotransferencia (a). Las manchas se cuantificaron mediante ImageJ y los datos son la media ± SEM de 10-12 ratones por grupo (b). *p < 0,01 o ***p < 0,0001 frente a control (C) y #p < 0,01 o ##p < 0,001 frente a la dosis respectiva de metanfetamina (prueba de comparación múltiple de Tukey).
La Fig. 3a muestra que la mefedrona aumentó significativamente las reducciones inducidas por la metanfetamina en los niveles de TH, según se determinó mediante inmunotransferencia. Los inmunoblots fueron cuantificados y de acuerdo con los resultados anteriores para DA y DAT, los efectos principales de la dosis de metanfetamina (F1,81 = 47,89, p < 0,0001) y la dosis de mefedrona (F4,81 = 63,57, p < 0,0001) fueron altamente significativos por ANOVA de dos vías (Fig. 3b). El efecto principal de la mefedrona administrada en combinación con 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) o 5,0 mg/kg de metanfetamina (F4,49 = 99,16, p < 0,0001) también fue altamente significativo mediante ANOVA unidireccional. Todos los tratamientos con cualquier dosis de metanfetamina ± mefedrona causaron reducciones significativamente mayores en TH en comparación con el control respectivo (p < 0,001 para 2,5 mg/kg de metanfetamina + 10 mg/kg de mefedrona; p < 0,0001 para todas las demás combinaciones) con la excepción de 2,5 mg/kg de metanfetamina sola que no cambió significativamente los niveles de TH (es decir, sin toxicidad). La Fig. 3b también muestra que las dosis de mefedrona de 20 mg/kg (p < 0,01) y 40 mg/kg (p < 0,001) aumentaron significativamente las reducciones de TH causadas por 2,5 mg/kg de metanfetamina y las tres dosis de mefedrona aumentaron significativamente (p < 0,0001) los efectos de 5,0 mg/kg de metanfetamina sobre las reducciones de TH.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/tggfrjpqru-jpg.4798/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 3
Efectos de la mefedrona sobre las reducciones del TH estriatal inducidas por la metanfetamina. Los ratones fueron tratados con las dosis indicadas de mefedrona (MEPH) 30 min antes de cada inyección de 2,5 (●) o 5,0 mg/kg (■) de metanfetamina (METH) y sacrificados 2d después para determinar los niveles estriatales de TH mediante inmunotransferencia (a). Las manchas se cuantificaron mediante ImageJ y los datos son la media ± SEM de 10-12 ratones por grupo (b). Algunas barras de error eran demasiado pequeñas para exceder el tamaño de los símbolos y no aparecen visibles. **p < 0,001 o ***p < 0,0001 frente a control (C) y #p < 0,01, ##p < 0,001 o ###p < 0,0001) frente a la dosis respectiva de metanfetamina (prueba de comparación múltiple de Tukey).
Efectos de la mefedrona sobre la hipertermia inducida por metanfetamina
La mefedrona, al igual que la metanfetamina, provoca una hipertermia significativa (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Cuando se administró mefedrona 30 min antes de cada inyección de metanfetamina, puede verse en la Fig. 4 que los efectos principales de las dosis de metanfetamina y mefedrona (F1,300 = 11,99, p < 0,0001) sobre el tiempo (F4,300 = 51,73, p < 0,0001) fueron altamente significativos mediante ANOVA de dos vías. Los efectos principales de la mefedrona administrada en combinación con 2,5 mg/kg de metanfetamina (F4,120 = 41,44, p < 0,0001, panel a) a lo largo del tiempo (F30,120 = 3,84, p < 0,0001) o 5,0 mg/kg de metanfetamina (F4,120 = 78,09, p < 0,0001, panel b) a lo largo del tiempo (F30,120 = 9,98, p < 0,0001) también fueron altamente significativos mediante ANOVA de dos vías. Todos los tratamientos con cualquiera de las dosis de metanfetamina ± mefedrona fueron significativamente diferentes de los respectivos controles (p < 0,0001 para todos los tratamientos).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/x0ik9hdwsw-jpg.4799/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 4
Efectos de la mefedrona sobre la hipertermia inducida por metanfetamina. Los ratones fueron tratados con las dosis indicadas de mefedrona (MEPH) 30 min antes de cada inyección de 2,5 (a) o 5,0 mg/kg (b) de metanfetamina (METH). Las temperaturas centrales se midieron a intervalos de 20 min mediante telemetría, comenzando 60 min antes de la primera inyección de metanfetamina. Las 4 inyecciones de metanfetamina se indican con las flechas apoyadas en el eje x. Los datos se expresan como temperatura corporal media de 6-8 ratones por grupo. Los SEM fueron siempre < 10% de la media y se omiten en aras de la claridad.
Efectos de la mefedrona sobre la neurotoxicidad inducida por anfetamina y MDMA
Para comprobar si los efectos potenciadores de la mefedrona sobre la metanfetamina podían extenderse a otras anfetaminas neurotóxicas, se trató a ratones con esta β-cetoanfetamina (20 mg/kg) más anfetamina (4X 5 mg/kg) o MDMA (4X 20 mg/kg) y los resultados se presentan en la Fig. 5. Recordemos que la mefedrona por sí misma no reduce DA, DAT o TH estriatales (Angoa-Perez et al. 2012). El efecto principal de la droga (F5,27 = 27,18, p < 0,0001) fue altamente significativo mediante ANOVA unidireccional para las reducciones de DA (Fig. 5a). También puede observarse en la Fig. 5a que todos los tratamientos con anfetamina (p < 0,001) o MDMA (p < 0,001) solos o en combinación con mefedrona (p < 0,0001 para ambas drogas) redujeron significativamente los niveles de DA respecto al control. La mefedrona aumentó significativamente las reducciones de DA causadas por la anfetamina (p < 0,01) o la MDMA (p < 0,01). La Fig. 5b muestra efectos similares de la combinación de tratamientos farmacológicos sobre los niveles de DAT en el cuerpo estriado. El efecto principal de la droga (F4,49 = 42.63, p < 0.0001) fue altamente significativo por ANOVA de una vía para DAT. También puede verse en la Fig. 5b que todos los tratamientos con anfetamina o MDMA fueron significativamente (p < 0,0001 para todos) más bajos en comparación con el control. La mefedrona también aumentó significativamente las reducciones de DAT causadas por anfetamina o MDMA (p < 0.0001 en ambos casos). Finalmente, la Fig. 5c muestra que el efecto principal de la droga (F4,50 = 75,06, p < 0,0001) fue altamente significativo mediante ANOVA unidireccional para las reducciones de TH. También puede verse en la Fig. 5c que todos los tratamientos con anfetamina o MDMA fueron significativamente (p < 0,0001 para todos) más bajos en comparación con el control. La mefedrona también aumentó significativamente las reducciones de TH causadas por anfetamina o MDMA (p < 0,0001 en ambos casos).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/onvypkgxvn-jpg.4800/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 5
Efectos de la mefedrona sobre la neurotoxicidad de las terminaciones nerviosas DA inducida por anfetamina o MDMA. Los ratones fueron tratados con 20 mg/kg de mefedrona (MEPH) 30 min antes de cada inyección de 5,0 mg/kg de anfetamina (AMPH) o 20 mg/kg de MDMA y sacrificados 2d después del tratamiento para la determinación de los niveles estriatales de (a) DA por HPLC. (b) DAT y (c) TH se determinaron mediante inmunotransferencia y los blots se cuantificaron mediante ImageJ. Los inmunoblots representativos de DAT y TH se incluyen como recuadros en los paneles (b) y (c) respectivamente y los tratamientos para ambos paneles se indican con 1,5: control; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; y 8: MDMA + MEPH. Los datos son la media ± SEM de 5-12 ratones en cada grupo. **p < 0,001 o ***p < 0,0001 frente a control y #p < 0,01 o ###p < 0,0001 frente a AMPH o MDMA (prueba de comparación múltiple de Tukey).
Efectos de la nomifensina sobre la neurotoxicidad inducida por metanfetamina
La nomifensina, un potente bloqueador DAT sin potencial neurotóxico o de abuso conocido, fue probada por su capacidad de proteger contra la neurotoxicidad inducida por metanfetamina y por contraste con las acciones de la mefedrona sobre la toxicidad a las terminaciones nerviosas DA causada por metanfetamina, anfetamina y MDMA. Los resultados en la Fig. 6a muestran que el efecto principal de la droga (F3,16 = 63,39, p < 0,0001) en los niveles de DA fue altamente significativo por ANOVA unidireccional. La nomifensina sola no alteró los niveles de DA, pero la reducción causada por la metanfetamina (p < 0,0001) fue leve pero significativamente revertida por la nomifensina (p < 0,01). El efecto principal de la droga (F3,20 = 16.78, p < 0.0001) en los niveles de DAT fue altamente significativo por ANOVA de una vía como se muestra en la Fig. 6b. La nomifensina no cambió los niveles de DAT pero proporcionó una protección significativa (p < 0,001) contra la reducción de la DAT estriatal causada por la metanfetamina (p < 0,0001) en comparación con el control. Finalmente, la Fig. 6c muestra que el efecto principal de la droga (F3,15 = 14.10, p < 0.0001) sobre los niveles de TH fue altamente significativo por ANOVA de una vía. Como se vio para DA y DAT, la reducción en TH causada por metanfetamina (p < 0.0001) fue leve pero significativamente prevenida por nomifensina (p < 0.01).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/daczg9cwfv-jpg.4801/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 6
Efectos de la nomifensina sobre la neurotoxicidad de las terminaciones nerviosas DA inducida por la metanfetamina. Los ratones fueron tratados con 5,0 mg/kg de nomifensina (NOM) 30 min antes de cada inyección de 5,0 mg/kg de metanfetamina (METH) y sacrificados 2d después para la determinación de los niveles estriatales de (a) DA por HPLC. (b) DAT y (c) TH se determinaron mediante inmunotransferencia y los blots se cuantificaron utilizando ImageJ. Se incluyen inmunotransferencias representativas de DAT y TH en los recuadros de los paneles (b) y (c) respectivamente. Los datos son la media más el SEM de 5-7 ratones por grupo. ***p < 0,0001 frente a control (C) y #p < 0,01 o ##p < 0,001 frente a metanfetamina sola (prueba de comparación múltiple de Tukey).
Discusión
El objetivo del presente estudio era determinar si la mefedrona prevendría la toxicidad de las terminaciones nerviosas DA causada por la metanfetamina. Basándose en su similitud química con la metanfetamina y la MDMA, inicialmente se esperaba que la mefedrona ejerciera efectos dañinos sobre el sistema neuronal DA. Sin embargo, varios estudios establecieron casi simultáneamente que la mefedrona no era tóxica para las terminaciones nerviosas DA (Angoa-Pérez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). La cuestión de si esta droga causa daños en el sistema neuronal 5-HT sigue abierta. Un estudio informó de reducciones persistentes en la función de las terminaciones nerviosas 5-HT (Hadlock et al. 2011), mientras que otro descubrió que la mefedrona no causaba daños (Baumann et al. 2012). La mefedrona interactúa con la terminación nerviosa DA de una manera que sugiere que efectivamente estimula la liberación y bloquea la recaptación de DA a través de sus interacciones con la DAT. Una faceta clave del mecanismo de acción neurotóxico de la metanfetamina es su capacidad para acceder a las terminaciones nerviosas DA a través de la DAT y alterar la homeostasis DA (Sulzer 2011). Si este primer paso en la cascada neurotóxica de la metanfetamina se evita mediante la inhibición de la DAT, se previene la toxicidad (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt y Gibb 1985). Razonamos que la mefedrona podría tener esta misma propiedad protectora que otros inhibidores de la DAT, pero observamos en cambio un aumento significativo de la toxicidad. Esta interacción se observó utilizando dos dosis diferentes de metanfetamina que causan daños moderados o severos en las terminaciones nerviosas DA (4X 2,5 o 5,0 mg/kg, respectivamente). Este efecto potenciador de la mefedrona no se limitó a la metanfetamina y se extendió a la anfetamina y la MDMA, dos drogas de las que se suele abusar conjuntamente con la mefedrona y otras β-cetoanfetaminas (Feyissa y Kelly 2008, Schifano et al. 2011, Kelly 2011). Por tanto, a pesar de que la mefedrona no causa toxicidad al menos en las terminaciones nerviosas DA del cuerpo estriado, potencia los efectos neurotóxicos de otras drogas de abuso. Este nuevo hallazgo debería poner aún más en evidencia el abuso de la mefedrona, ya que su falta de neurotoxicidad intrínseca puede hacerla parecer inocua.
La hipertermia es un efecto adverso agudo comúnmente notificado de la ingestión de metanfetamina (Greene et al. 2008) y β-cetoanfetamina en humanos (Borek y Holstege 2012, Prosser y Nelson 2012). Al igual que la metanfetamina, muchas de las drogas β-cetoanfetamínicas también causan elevaciones significativas de la temperatura central en roedores (Angoa-Pérez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Aunque la hipertermia causada por la metanfetamina podría contribuir a sus efectos perjudiciales morfológicos y neuronales, no es necesariamente el caso que la hipertermia sea la causa directa de estos efectos (Kiyatkin y Sharma 2009). Registramos las temperaturas corporales centrales en ratones tratados con mefedrona y metanfetamina y observamos que el tratamiento combinado no aumentaba las temperaturas más allá de los aumentos máximos observados con cualquiera de los dos fármacos por separado. La metanfetamina provocó un aumento de la temperatura corporal relacionado con la dosis y esta hipertermia fue invariable en todo el intervalo de dosis de mefedrona probado. De hecho, el descenso de la temperatura corporal tras la inyección observado tras el tratamiento con mefedrona (Angoa-Pérez et al. 2012) se mantuvo con dosis más altas de mefedrona más metanfetamina. Aunque la hipertermia inducida por la droga no aumentó con el tratamiento farmacológico combinado, los efectos neurotóxicos fueron aditivos. Por lo tanto, al menos en este caso, parece que los efectos neurotóxicos de la metanfetamina pueden ser potenciados por la mefedrona de forma independiente de la hipertermia.
La mefedrona inhibe claramente la función DAT y bloquea la recaptación de DA in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). La mefedrona desplaza al WIN-35,428 de su sitio de unión en la DAT, lo que sugiere que es un inhibidor competitivo de la captación de DA (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). La potencia de la mefedrona en este sentido es muy similar a la de la metanfetamina (Cozzi et al. 1999) y la MDMA (Escubedo et al. 2011). No se sabe si la mefedrona es transportada por la DAT, pero la metcatinona sí (Cozzi y Foley 2003). La nomifensina y el ácido anfonelico, que se unen a la DAT e inhiben la captación de DA, proporcionan una protección sustancial contra la neurotoxicidad inducida por la metanfetamina (Pu et al. 1994, Marek et al. 1990, Schmidt y Gibb 1985, Poth et al. 2012) y los ratones que carecen de la DAT son resistentes a la toxicidad neuronal de la metanfetamina (Fumagalli et al. 1998). Sabiendo que la mefedrona no es neurotóxica y que es un bloqueador de la DAT, cabe predecir que debería prevenir la toxicidad. En este sentido, probamos la nomifensina como control positivo y confirmamos que protege contra la depleción de DA, DAT y TH inducida por la metanfetamina. La nomifensina también inhibe el transportador de norepinefrina (Brogden et al. 1979), pero esta propiedad no puede explicar los presentes resultados porque la mayoría de las β-cetoanfetaminas, incluida la mefedrona, inhiben el transportador de norepinefrina y bloquean la captación de norepinefrina (Kelly 2011, Rothman et al. 2003, Cozzi et al. 1999, Sogawa et al. 2011, Lopez-Arnau et al. 2012). Un papel del sistema neuronal 5-HT en algunas de las acciones farmacológicas de la mefedrona es posible a la luz de la capacidad de esta droga, al igual que la MDMA (Yamamoto et al. 1995), para provocar el eflujo de DA estriatal a través de sus interacciones con los receptores 5-HT2A (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). La hiperlocución causada por la mefedrona depende de la 5-HT endógena (Lopez-Arnau et al. 2012) y esta droga también estimula la liberación de 5-HT e inhibe su captación in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) e in vivo (Baumann et al. 2012, Kehr et al. 2011). Sin embargo, podemos descartar un papel de la 5-HT endógena en la neurotoxicidad DA de al menos la metanfetamina al demostrar que los ratones genéticamente desprovistos de 5-HT conservan su sensibilidad a la neurotoxicidad (Thomas et al. 2010).
La mefedrona podría potenciar la neurotoxicidad de la metanfetamina por varios mecanismos posibles. En primer lugar, la mefedrona podría interactuar con la VMAT para provocar la fuga de DA al citoplasma de la terminación nerviosa presináptica. Los tratamientos que aumentan la reserva citoplasmática (es decir, liberable por el fármaco) de DA aumentan la neurotoxicidad de la metanfetamina (Thomas et al. 2008, Thomas et al. 2009, Schmidt et al. 1985). Este mecanismo no es probable porque la metcatinona sólo interactúa débilmente con la VMAT (Cozzi et al. 1999). En segundo lugar, la combinación de mefedrona más metanfetamina podría tener un efecto sinérgico sobre la liberación no vesicular de DA, pero esta posibilidad también parece poco probable a la luz de los resultados que muestran que el tratamiento de células CHO que expresan DAT o SERT con mefedrona más metanfetamina no tiene un efecto aditivo sobre la liberación de DA o 5-HT (Sogawa et al. 2011). En tercer lugar, la mefedrona podría interactuar con la DAT de una manera novedosa que contribuya a la toxicidad aditiva. Se ha demostrado que la metilona en combinación con la metanfetamina causa citotoxicidad sinérgica en células CHO que expresan la DAT o la SERT, pero no en células CHO de tipo salvaje que carecen de los transportadores (Sogawa et al. 2011). La citotoxicidad observada en las células cultivadas en estos estudios (es decir, la liberación de LDH) es muy diferente del daño a las terminaciones nerviosas DA causado por la metanfetamina, pero este mecanismo sugiere un papel interesante pero indefinido de la DAT en el aumento de la citotoxicidad. Por último, la mefedrona podría modificar el metabolismo de la metanfetamina. La mefedrona se metaboliza principalmente por N-desmetilación (Meyer y Maurer 2010), al igual que la metanfetamina y la MDMA (Caldwell 1976). Este mecanismo se apoya en la demostración de que la metanfetamina y la MDMA inhiben mutuamente la producción de sus respectivos metabolitos primarios y elevan los niveles plasmáticos de la droga por encima de los observados tras la administración de cualquiera de ellas por separado (Kuwayama et al. 2012). Las dosis de mefedrona utilizadas actualmente y en nuestro estudio anterior (Angoa-Pérez et al. 2012), aunque elevadas, no son neurotóxicas y se sitúan dentro del intervalo consumido por los seres humanos (McErath y O'Neill 2011). Por lo tanto, la mefedrona podría estar actuando como la MDMA para aumentar los niveles plasmáticos de metanfetamina inhibiendo su metabolismo. Será necesario un análisis farmacocinético en profundidad para confirmar esta última posibilidad.
El abuso de las β-cetoanfetaminas está aumentando a un ritmo alarmante y la mefedrona es ahora una de las drogas más consumidas después del cannabis, la MDMA y la cocaína (Morris 2010, Winstock et al. 2011b). Además, la mefedrona induce una mayor sensación de ansia en los humanos en comparación con la MDMA (Brunt et al. 2011) y los consumidores que esnifan mefedrona la consideran más adictiva que la cocaína (Winstock et al. 2011b). La mefedrona es consumida por los humanos de forma similar a un atracón (es decir, "apilada") y a menudo se toma con otras drogas como el cannabis y los psicoestimulantes anfetamínicos (Schifano et al. 2011, Fass et al. 2012, Winstock et al. 2011a, Kelly 2011, Torrance y Cooper 2010). La mefedrona se encuentra cada vez más en comprimidos que se venden como MDMA (Brunt et al. 2011) y es probable que su consumo supere al de la MDMA a medida que siga disminuyendo la pureza de esta última droga (Brunt et al. 2011, Tanner-Smith 2006, Teng et al. 2006). Basándonos en los patrones comunes de abuso de mefedrona y otros ingredientes de las "sales de baño", es importante considerar si se acumulan riesgos adicionales para la salud en humanos cuando estas drogas se combinan con las anfetaminas de forma intencionada o no. Nuestros resultados, que demuestran que al menos la mefedrona potencia significativamente la neurotoxicidad de las terminaciones nerviosas DA del cuerpo estriado causada por la metanfetamina, la anfetamina y la MDMA, revelan una propiedad especialmente peligrosa e inesperada de esta β-cetoanfetamina.
Abreviaturas utilizadas
5-HT serotonina
DA dopamina
DAT Transportador DA
MDMA 3,4-metilendioximetanfetamina
TH tirosina hidroxilasa
VMAT transportador vesicular de monoaminas