Mefedroon (4-metüülmetkatinoon) on β-ketoamfetamiini stimuleeriv kuritarvitatav uimasti, millel on lähedased struktuurilised ja mehhaanilised sarnasused metamfetamiiniga. Üks kõige võimsamaid toimeid, mis on seotud mefedrooniga, on võime stimuleerida dopamiini (DA) vabanemist ja blokeerida selle tagasivõtmist dopamiini transporteriga (DAT) suhtlemise kaudu. Kuigi mefedroon ei põhjusta DA närvilõpmete toksilisust, võib selle võime toimida DAT-blokaatorina pakkuda kaitset metamfetamiini põhjustatud neurotoksilisuse eest nagu teised DAT-inhibiitorid. Selle võimaluse testimiseks raviti hiiri mefedrooniga (10, 20 või 40 mg/kg) enne iga neurotoksilise metamfetamiini süstimist (4 süstimist 2,5 või 5,0 mg/kg 2 tunni tagant). Striatumi DA-närvilõpmete terviklikkust hinnati DA, DAT ja türosiinhüdroksülaasi taseme mõõtmise abil. Erinevate metamfetamiini annustega seotud mõõdukat kuni rasket DA-toksilisust ei takistanud ükski mefedrooni annus, vaid see hoopis suurenes märkimisväärselt. Mefedrooni ja metamfetamiini kombineeritud ravist põhjustatud hüpertermia oli sama, mida täheldati pärast kummagi ravimi manustamist eraldi. Mefedroon suurendas ka amfetamiini ja MDMA neurotoksilist mõju DA närvilõpmetele. Seevastu nomifensiin kaitses metamfetamiini põhjustatud neurotoksilisuse eest. Kuna mefedroon suurendab metamfetamiini neurotoksilisust, viitavad käesolevad tulemused sellele, et see mõjutab DAT-i erinevalt teistest tüüpilistest DAT-i inhibiitoritest. Mefedrooni suhteliselt kahjutu mõju ainuüksi DA-närvilõpmetele varjab potentsiaalselt ohtlikku koostoimet ravimitega, mida sageli koos sellega kuritarvitatakse, mis viib suurenenud neurotoksilisuse tekkimiseni.
Mefedroon (4-metüülmetkatinoon) on katinooni derivaat ja metamfetamiini ja 3,4-metüleendioksümetamfetamiini (MDMA) struktuuriline analoog. Mefedroon on "vannisoolade" üks psühhoaktiivne koostisosa koos teiste ühenditega, nagu metüloon, butüloon ja 3,4-metüleendioksüpropüvaleroon (MDPV). β-ketoamfetamiini kuritarvitatakse üha sagedamini, mis on osaliselt tingitud sellest, et metamfetamiini ja MDMA sünteesiks vajalike lähteainete kättesaadavus salajastes laborites on väga piiratud ja nende puhtus on vastavalt vähenenud (Winstock et al. 2011b, Brunt et al. 2011). Kuna β-ketoamfetamiinide kuritarvitamine kasvab jätkuvalt, on nende kahjulike mõjude loetelu kasvanud, hõlmates kardiovaskulaarseid tüsistusi, rahutust, unetust, psühhoosi ja depressiooni (Schifano et al. 2011, Prosser ja Nelson 2012).
Metamfetamiini ja MDMA keemiliste sugulastena ei ole üllatav, et β-ketoamfetamiinidel on kesknärvisüsteemile palju samu mõjusid, mis neil endistel uimastitel. Näiteks blokeerivad need ravimid dopamiini (DA) ja serotoniini (5-HT) transportereid (vastavalt DAT ja SERT) (Cozzi et al. 1999, Rothman et al. 2003, Fleckenstein et al. 2000, Lopez-Arnau et al. 2012) ning stimuleerivad monoamiini vabanemist in vitro (Kalix ja Glennon 1986, Gygi et al. 1997, Rothman et al. 2003) ja in vivo (Gygi et al. 1997, Kehr et al. 2011). Metkatinoon põhjustab trüptofaanhüdroksülaasi ja türosiinhüdroksülaasi (TH) aktiivsuse püsivat vähenemist ning DA ja 5-HT ammendumist (Gygi et al. 1997, Gygi et al. 1996, Sparago et al. 1996). PET-kujutise uuringutes abstinentsetel metkatinooni kasutajatel ilmnes striataalse DAT-i vähenenud tihedus, mis viitab DA-terminaalide kadumisele (McCann et al. 1998). DA vabanemise samaaegne stimuleerimine ja selle omastamise pärssimine peegeldavad kriitilisi elemente, mis on aluseks metamfetamiiniga seotud neurotoksilisusele (Kuhn et al. 2008, Yamamoto ja Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Meie (Angoa-Perez et al. 2012) ja teised (Baumann et al. 2012, Hadlock et al. 2011) uurisime hiljuti võimalust, et mefedroon võib põhjustada neurotoksilisust nagu metamfetamiin ja MDMA. Üllatuslikult ei olnud mefedroon striatumi DA-närvilõpmetele toksiline (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Küsimus, kas mefedroon kahjustab 5-HT närvilõpmeid, on endiselt lahendamata, kuna üks uuring dokumenteeris positiivset mõju (Hadlock et al. 2011), samas kui teine uuring oli negatiivne (Baumann et al. 2012). Arvestades mefedrooni suhteliselt healoomulist mõju DA-närvilõpmetele ja arvestades selle omadusi DAT-blokaatorina, oletasime, et see võib tegelikult kaitsta DA-neuronisüsteemi metamfetamiini neurotoksiliste mõjude eest, nagu on teadaolevalt toimunud teiste DAT-blokaatoritega, nagu amfoneelhape (Pu et al. 1994, Schmidt ja Gibb 1985, Marek et al. 1990) ja nomifensiin (Poth et al. 2012). Praegu teatame, et mefedroon suurendab märkimisväärselt metamfetamiini neurotoksilisust. See mõju laieneb ka amfetamiinile ja MDMA-le, mis on sageli koos mefedrooniga tarvitatavad uimastid (Feyissa ja Kelly 2008, Schifano et al. 2011). Need üllatavad tulemused asetavad mefedrooni kuritarvitamise uude valgusse ja muudavad selle β-ketoamfetamiini peene ja ohtliku omaduse tunnustamise kiireloomuliseks.
Materjalid ja meetodid
Narkootikumid ja reagendid
Mefedroonvesinikkloriid ja 3,4-metüleendioksümetamfetamiin (MDMA) saadi NIDA uurimisressursside uimastivarustuse programmist. (+) Metamfetamiinvesinikkloriid, nomifensiinmaleaat, d-amfetamiinsulfaat, pentobarbitaal, DA ning kõik puhvrid ja HPLC-reaktiivid osteti Sigma-Aldrichist (St. Louis, MO, USA). Bitsinhooniinhappe valguanalüüsi komplektid saadi Pierce'ilt (Rockford, IL, USA). Polüklonaalsed antikehad roti TH vastu toodeti varem kirjeldatud viisil (Kuhn ja Billingsley 1987). Monoklonaalsed antikehad roti DAT vastu andis lahkesti Dr. Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA). HRP-konjugeeritud anti-IgG sekundaarsed antikehad andis Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA).
Loomad
Emased C57BL/6 hiired (Harlan, Indianapolis, IN, USA), kes katsete ajal kaalusid 20-25 g, paigutati 5 hiirt ühe puuri kohta suurtes kingakastidega puurides valguse (12 h valguse/pimeduse) ja temperatuuri kontrollitud ruumis. Kasutati emaseid hiiri, sest nad on teadaolevalt väga tundlikud neurotoksiliste amfetamiinide tekitatud neuronaalsete kahjustuste suhtes ja et säilitada kooskõla meie varasemate metamfetamiini neurotoksilisuse uuringutega (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). Hiirtel oli vaba juurdepääs toidule ja veele. Wayne'i Riikliku Ülikooli institutsionaalne hooldus- ja kasutuskomitee kiitis loomade hoolduse ja katsemenetlused heaks. Kõik protseduurid vastasid ka NIHi laboriloomade hooldamise ja kasutamise juhendile.
Farmakoloogilised, füsioloogilised ja käitumisprotseduurid
Hiirte raviti mefedrooniga, kasutades joobesarnast raviskeemi, mis koosnes 4 süstist 10, 20 või 40 mg/kg, kusjuures iga süstimise vahel oli 2-tunnine intervall. See joomaravi skeem, kui seda kasutatakse asendavate amfetamiinide ja katinooni derivaatide süstimiseks, põhjustab ulatuslikku DA närvilõpmete kahjustust. Praegu kasutatavad mefedrooni annused on varem näidanud, et need ei ole DA-närvilõpmetele toksilised (Angoa-Perez et al. 2012). Hiiri raviti metamfetamiini (4X 2,5 või 5 mg/kg), amfetamiini (4X 5 mg/kg) või MDMA (4X 20 mg/kg) üksi või kombinatsioonis mefedrooniga. Kui hiiri raviti kahe ravimiga, said nad 30 minutit enne iga 4 metamfetamiini, amfetamiini või MDMA süsti mefedrooni. Kontrollid said füsioloogilise soolalahuse süstid samas ajakavas, mida kasutati mefedrooni puhul üksi või kombinatsioonis teiste amfetamiinidega. DAT-inhibiitori mõju kontrollimiseks metamfetamiini toksilisusele raviti hiiri nomifensiiniga (4X 5 mg/kg) 30 minutit enne iga metamfetamiini süstimist (4X 5 mg/kg). Kõik süstid manustati i.p. teel. Hiired ohverdati 2 päeva pärast viimast ravimi manustamist, kui amfetamiiniga seotud neurotoksilisus oli saavutanud maksimumi. Kehatemperatuuri jälgiti telemeetria abil, kasutades Bio Medic Data Systems, Inc. (Seaford, DE, USA) IPTT-300 implanteeritavaid temperatuuriandureid. Temperatuuri registreeriti mitteinvasiivselt iga 20 minuti järel, alustades 60 minutit enne esimest METH-süsti ja jätkates 9 tunni jooksul pärast seda, kasutades Bio Medic'i DAS-5001 konsoolisüsteemi.
Striataalse DA sisalduse määramine
Striataalkude lõigati pärast ravi kahepoolselt ajust välja ja säilitati -80 °C juures. Külmutatud koed kaaluti ja sonicated 10 mahus 0,16 N perkloriinhappes 4 ° C juures. Lahustumatu valk eemaldati tsentrifuugimise teel ja DA määrati HPLC abil elektrokeemilise avastamisega, nagu on varem kirjeldatud metamfetamiini puhul (Thomas et al. 2010, Thomas et al, 2009).
TH- ja DAT-valgu taseme määramine immunobloti abil
Ravimiga töötlemise mõju striataalse TH ja DAT tasemele määrati immunoblottinguga, mis on striataalse DA närvilõpmete toksilisuse indeksiks. Hiired ohverdati pärast ravi dekapiteerimise teel ja striatum tükeldati kahepoolselt. Kude säilitati -80 °C juures. Külmutatud koed purustati 1% SDSis 95°C juures sonikatsiooni teel ja lahustumatu materjal settesti tsentrifuugimise teel. Valgus määrati bikiinhappemeetodil ja võrdsed valgu kogused (70 μg/laine) eraldati SDS-polüakrüülamiid-geelelektroforeesiga ja seejärel elektrobloteeriti nitrotselluloosile. Blotid blokeeriti Tris-puhvrisoolalahuses, mis sisaldas Tween 20 (0,1% v/v) ja 5% rasvata kuivpiima, 1 tunni jooksul toatemperatuuril. Blotidele lisati TH (1:1000) või DAT (1:1000) vastased primaarsed antikehad ja lasksime inkubeerida 16 tundi 4 °C juures. Blote pesti 3X Tris-puhverdatud soolalahuses, et eemaldada reageerimata antikehad ja seejärel inkubeeriti HRP-konjugeeritud anti-IgG sekundaarse antikehaga (1:4000) 1 h toatemperatuuril. Immunoreaktiivsed ribad visualiseeriti tugevdatud kemiluminestsentsiga ning TH- ja DAT-reaktiivsete ribade suhteline tihedus määrati pildistamise teel Kodak Image Stationiga (Carestream Molecular Systems, Rochester, NY, USA) ja kvantifitseeriti ImageJ tarkvara (NIH) abil.
Andmete analüüs
Metamfetamiini ja mefedrooni annuse mõju analüüsimiseks DA-le, DAT-le ja TH-le viidi läbi kahesuunalised ANOVA-d. Ravimitöötluste mõju striataalse DA, TH ja DAT sisaldusele testiti olulisuse suhtes ühesuunalise ANOVA abil, millele järgnes Tukey mitmekordne võrdlustest. Ravimitega töötlemise tulemusi keha sisetemperatuurile aja jooksul analüüsiti kahesuunalise ANOVA abil, millele järgnes Bonferroni test, et määrata kindlaks temperatuuri erinevuste olulisus üksikutel ajahetkedel pärast ravi. Erinevusi peeti oluliseks, kui p < 0,05. Kõik statistilised analüüsid viidi läbi, kasutades GraphPad Prism versiooni 5.02 for Windows (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Siirdu edasi:
Tulemused
Mefedrooni mõju metamfetamiini põhjustatud neurotoksilisusele
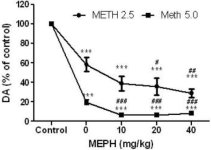
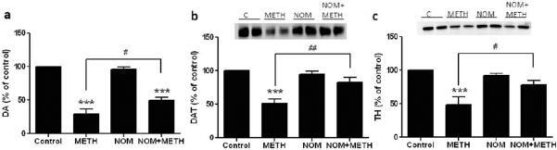
Mefedrooni annustes (10, 20 või 40 mg/kg), mis teadaolevalt ei põhjusta DA närvilõpmete toksilisust (Angoa-Perez et al. 2012), manustati 30 minutit enne iga metamfetamiini süstimist. Metamfetamiini manustati annustes, mis põhjustavad mõõdukat (4X 2,5 mg/kg) või rasket (4X 5 mg/kg) kahjustust striatumi DA-närvilõpmetele (Thomas et al. 2004, Thomas et al. 2010). Joonisel 1 esitatud tulemused näitavad, et metamfetamiini annuse (F1,40 = 66,60, p < 0,0001) ja mefedrooni annuse (F4,40 = 131,3, p < 0,0001) peamine mõju DA tasemele striatumis oli kahesuunalise ANOVA abil väga oluline. Mefedrooni peamine mõju, mis anti koos 2,5 mg/kg (F4,22 = 35,96, p < 0,001) või 5,0 mg/kg metamfetamiiniga (F4,17 = 953,9, p < 0,0001), oli samuti väga oluline ühesuunalise ANOVA abil. Kõik töötlused metamfetamiini ± mefedrooni mõlema annusega põhjustasid DA märkimisväärselt suuremat vähenemist võrreldes vastava kontrolliga (p < 0,0001 kõigi puhul). Joonis 1 näitab ka, et mefedrooni annused 20 (p < 0,01) ja 40 mg/kg (p < 0,001) suurendasid märkimisväärselt 2,5 mg/kg metamfetamiini ammendavat mõju DA-le, samas kui kõik mefedrooni annused suurendasid märkimisväärselt 5,0 mg/kg metamfetamiini mõju DA tasemele (p < 0,0001 kõigi puhul).
Joonis 1
Mefedrooni mõju metamfetamiini põhjustatud striataalse DA vähenemisele. Hiiri raviti näidatud mefedrooni (MEPH) annustega 30 minutit enne iga 2.5 (-) või 5.0 mg / kg (■) metamfetamiini (METH) süstimist ja ohverdati 2d hiljem striataalse DA taseme määramiseks HPLC abil. Andmed on keskmised ± SEM 5-7 hiire kohta rühma kohta. Mõned veabargad olid liiga väikesed, et ületada sümbolite suurust, ja need ei ole nähtavad. ***p < 0,001 vs kontrollid ja #p < 0,01, ##p < 0,001 või ###p < 0,0001 vs vastav metamfetamiini annus (Tukey mitmekordne võrdlustest).
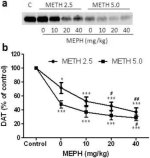
Joonis 2a näitab, et mefedroon suurendas märkimisväärselt metamfetamiini poolt põhjustatud DAT-i taseme vähenemist, nagu on määratud immunoblottinguga. Immunoblotid kvantifitseeriti ja kooskõlas DA tulemustega olid metamfetamiini annuse (F1,92 = 9,48, p < 0,001) ja mefedrooni annuse (F4,92 = 37,56, p < 0,0001) peamised mõjud DAT-i tasemetele striatumis kahesuunalise ANOVA abil väga olulised (joonis 2b). Mefedrooni peamine mõju, mis anti koos 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) või 5,0 mg/kg metamfetamiiniga (F4,39 = 24,84, p < 0,0001), oli samuti väga oluline ühesuunalise ANOVA abil. Kõik ravimeetodid ükskõik millise metamfetamiini ± mefedrooni annusega põhjustasid DAT-i oluliselt suuremat vähenemist võrreldes vastava kontrolliga (p < 0,01 ainult 2,5 mg/kg metamfetamiini puhul; p < 0,0001 kõigi teiste ravimeetodite puhul). Joonis 2b näitab ka, et mefedrooni annused 20 mg/kg (p < 0,01) ja 40 mg/kg (p < 0,001) suurendasid märkimisväärselt 2,5 mg/kg metamfetamiini põhjustatud DAT-i vähenemist, samas kui ainult 40 mg/kg mefedrooni annus suurendas märkimisväärselt (p < 0,01) 5,0 mg/kg metamfetamiini mõju DAT-i vähenemisele.
Joonis 2
Mefedrooni mõju metamfetamiini poolt põhjustatud striataalse DAT-i vähenemisele. Hiiri raviti näidatud mefedrooni annustega (MEPH) 30 minutit enne iga 2,5 (●) või 5,0 mg / kg (■) metamfetamiini (METH) süstimist ja ohverdati 2d hiljem striataalse DAT-i taseme määramiseks immunobloti abil (a). Blotid kvantifitseeriti ImageJ abil ja andmed on keskmised ± SEM 10-12 hiire kohta rühma kohta (b). *p < 0,01 või ***p < 0,0001 vs kontroll (C) ja #p < 0,01 või ##p < 0,001 vs vastav metamfetamiini annus (Tukey mitmekordne võrdlustest).
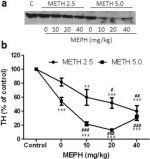
Joonisel 3a on näidatud, et mefedroon suurendas märkimisväärselt metamfetamiini poolt põhjustatud TH taseme vähenemist, nagu on määratud immunoblottinguga. Immunoblotid kvantifitseeriti ja kooskõlas eespool toodud DA ja DAT tulemustega olid metamfetamiini annuse (F1,81 = 47,89, p < 0,0001) ja mefedrooni annuse (F4,81 = 63,57, p < 0,0001) peamised mõjud kahesuunalise ANOVA abil väga olulised (joonis 3b). Mefedrooni manustamise peamine mõju koos 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) või 5,0 mg/kg metamfetamiiniga (F4,49 = 99,16, p < 0,0001) oli samuti väga oluline ühesuunalise ANOVA abil. Kõik töötlused metamfetamiini ± mefedrooni kummagi annusega põhjustasid oluliselt suuremat TH vähenemist võrreldes vastava kontrolliga (p < 0,001 2,5 mg/kg metamfetamiini + 10 mg/kg mefedrooni puhul; p < 0,0001 kõigi teiste kombinatsioonide puhul), välja arvatud 2,5 mg/kg metamfetamiini üksi, mis ei muutnud oluliselt TH taset (st ei põhjustanud toksilisust). Joonisel 3b on samuti näha, et mefedrooni annused 20 mg/kg (p < 0,01) ja 40 mg/kg (p < 0,001) suurendasid märkimisväärselt 2,5 mg/kg metamfetamiini põhjustatud TH vähenemist ja kõik kolm mefedrooni annust suurendasid märkimisväärselt (p < 0,0001) 5,0 mg/kg metamfetamiini mõju TH vähenemisele.
Joonis 3
Mefedrooni mõju metamfetamiini poolt põhjustatud striataalse TH vähenemisele. Hiiri raviti näidatud mefedrooni annustega (MEPH) 30 minutit enne iga 2,5 (●) või 5,0 mg / kg (■) metamfetamiini (METH) süstimist ja ohverdati 2d hiljem striataalse TH taseme määramiseks immunoblottinguga (a). Blotid kvantifitseeriti ImageJ abil ja andmed on keskmised ± SEM 10-12 hiire kohta rühma kohta (b). Mõned veabargad olid liiga väikesed, et ületada sümbolite suurust, ja need ei ole nähtavad. **p < 0,001 või ***p < 0,0001 vs kontroll (C) ja #p < 0,01, ##p < 0,001 või ###p < 0,0001) vs vastav metamfetamiini annus (Tukey mitmekordne võrdlustest).
Mefedrooni mõju metamfetamiini poolt põhjustatud hüpertermiale
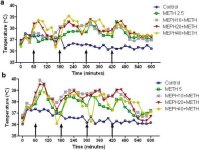
Mefedroon põhjustab sarnaselt metamfetamiiniga märkimisväärset hüpertermiat (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Kui mefedrooni manustati 30 minutit enne iga metamfetamiini süsti, on joonisel 4 näha, et metamfetamiini ja mefedrooni annuste (F1,300 = 11,99, p < 0,0001) peamine mõju aja (F4,300 = 51,73, p < 0,0001) oli kahesuunalise ANOVA abil väga oluline. Kahepoolse ANOVA abil olid samuti väga olulised mefedrooni ja 2,5 mg/kg metamfetamiini (F4,120 = 41,44, p < 0,0001, paneel a) kombinatsiooni peamised mõjud aja jooksul (F30,120 = 3,84, p < 0,0001) või 5,0 mg/kg metamfetamiini (F4,120 = 78,09, p < 0,0001, paneel b) aja jooksul (F30,120 = 9,98, p < 0,0001). Kõik töötlused metamfetamiini ± mefedrooni mõlema annusega erinesid oluliselt vastavatest kontrollidest (p < 0,0001 kõigi töötluste puhul).
Joonis 4
Mefedrooni mõju metamfetamiini põhjustatud hüpertermiale. Hiiri raviti näidatud annustega mefedrooni (MEPH) 30 minutit enne iga 2,5 (a) või 5,0 mg/kg (b) metamfetamiini (METH) süstimist. Tuuma temperatuuri mõõdeti 20-minutiliste intervallidega telemeetria abil, alustades 60 minutit enne esimest metamfetamiini süstimist. 4 metamfetamiini süstimist on tähistatud x-teljel asetsevate nooltega. Andmed on väljendatud 6-8 hiire kehatemperatuuri keskmisena rühma kohta. SEM oli alati < 10% keskmisest ja on selguse huvides välja jäetud.
Mefedrooni mõju amfetamiini ja MDMA poolt põhjustatud neurotoksilisusele
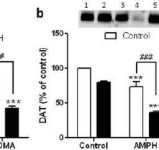
Selleks, et testida, kas mefedrooni tugevdav mõju metamfetamiinile võib laieneda ka teistele neurotoksilistele amfetamiinidele, raviti hiiri selle β-ketoamfetamiiniga (20 mg/kg) pluss amfetamiin (4X 5 mg/kg) või MDMA (4X 20 mg/kg) ja tulemused on esitatud joonisel 5. Tuletame meelde, et mefedroon ise ei vähenda striataalset DA-d, DAT-i või TH-d (Angoa-Perez et al. 2012). Ravimi peamine mõju (F5,27 = 27.18, p < 0.0001) oli ülimalt oluline ühepoolse ANOVA abil DA vähenemise puhul (joonis 5a). Samuti on joonisel 5a näha, et kõik ravid amfetamiini (p < 0.001) või MDMA (p < 0.001) üksi või kombinatsioonis mefedrooniga (p < 0.0001 mõlema ravimi puhul) vähendasid märkimisväärselt DA taset võrreldes kontrolliga. Mefedroon suurendas märkimisväärselt amfetamiini (p < 0,01) või MDMA (p < 0,01) põhjustatud DA vähenemist. Joonis 5b näitab sarnast mõju kombinatsioonravimite ravile DAT-i tasemele striatumis. Ravimi peamine mõju (F4,49 = 42.63, p < 0.0001) oli DAT-i jaoks ülimalt oluline ühepoolse ANOVA abil. Joonisel 5b on samuti näha, et kõik amfetamiini või MDMA-ga tehtud ravid olid võrreldes kontrolliga märkimisväärselt (p < 0,0001 kõigi puhul) madalamad. Mefedroon suurendas samuti märkimisväärselt DAT-i vähenemist, mida põhjustas kas amfetamiin või MDMA (p < 0,0001 mõlemal juhul). Lõpuks näitab joonis 5c, et ravimi peamine mõju (F4,50 = 75,06, p < 0,0001) oli väga oluline ühepoolse ANOVA abil TH vähenemise puhul. Samuti on joonisel 5c näha, et kõik amfetamiini või MDMA-ga tehtud ravid olid võrreldes kontrolliga märkimisväärselt (p < 0,0001 kõigi puhul) madalamad. Mefedroon suurendas samuti märkimisväärselt TH vähenemist, mida põhjustas kas amfetamiin või MDMA (p < 0,0001 mõlemal juhul).
Joonis 5
Mefedrooni mõju amfetamiini või MDMA põhjustatud DA närvilõpmete neurotoksilisusele. Hiiri raviti 20 mg/kg mefedrooniga (MEPH) 30 minutit enne iga 5,0 mg/kg amfetamiini (AMPH) või 20 mg/kg MDMA süstimist ja ohverdati 2d pärast ravi, et määrata striataalseid DA tasemeid (a) HPLC abil. (b) DAT ja (c) TH määrati immunobloti abil ja blotid kvantifitseeriti ImageJ abil. Representatiivsed immunoblotid DAT ja TH jaoks on lisatud vastavalt paneelide (b) ja (c) lisadena ning mõlema paneeli puhul on ravi märgitud 1,5: kontroll; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; ja 8: MDMA + MEPH. Andmed on keskmised ± SEM 5-12 hiire kohta igas rühmas. **p < 0,001 või ***p < 0,0001 vs kontroll ja #p < 0,01 või ###p < 0,0001 vs AMPH või MDMA (Tukey mitmekordne võrdlustest).
Nomifensiini mõju metamfetamiini põhjustatud neurotoksilisusele
Nomifensiini, võimsat DAT-blokaatorit, mille kuritarvitamise või neurotoksilise potentsiaali ei ole teada, testiti selle võime suhtes kaitsta metamfetamiini põhjustatud neurotoksilisuse eest ja kontrastiks mefedrooni toimele metamfetamiini, amfetamiini ja MDMA põhjustatud DA-närvilõpmete toksilisusele. Tulemused joonisel 6a näitavad, et ravimi peamine mõju (F3,16 = 63,39, p < 0,0001) DA-tasemetele oli ülimalt oluline ühesuunalise ANOVA abil. Nomifensiin üksi ei muutnud DA taset, kuid metamfetamiini põhjustatud vähenemine (p < 0,0001) tühistati nomifensiiniga veidi, kuid märkimisväärselt (p < 0,01). Ravimi peamine mõju (F3,20 = 16.78, p < 0.0001) DAT-tasemetele oli väga oluline ühepoolse ANOVA abil, nagu on näidatud joonisel 6b. Nomifensiin ei muutnud DAT-i taset, kuid pakkus märkimisväärset kaitset (p < 0,001) metamfetamiini põhjustatud striataalse DAT-i vähenemise eest (p < 0,0001) võrreldes kontrolliga. Lõpuks näitab joonis 6c, et ravimi peamine mõju (F3,15 = 14,10, p < 0,0001) TH-tasemetele oli ülimalt oluline ühesuunalise ANOVA abil. Nagu näha DA ja DAT puhul, vähendas nomifensiin (p < 0,0001) metamfetamiini põhjustatud TH vähenemist (p < 0,01) veidi, kuid märkimisväärselt (p < 0,01).
Joonis 6
Nomifensiini mõju metamfetamiini poolt põhjustatud DA närvilõpmete neurotoksilisusele. Hiiri raviti 5,0 mg / kg nomifensiini (NOM) 30 minutit enne iga 5,0 mg / kg metamfetamiini (METH) süstimist ja ohverdati 2d hiljem striataalse DA taseme määramiseks (a) HPLC abil. (b) DAT ja (c) TH määrati immunobloti abil ja blotid kvantifitseeriti ImageJ abil. DAT-i ja TH-i esinduslikud immunoblotid on lisatud paneelide (b) ja (c) lisadena. Andmed on keskmised pluss SEM 5-7 hiire kohta rühma kohta. ***p < 0,0001 vs kontroll (C) ja #p < 0,01 või ##p < 0,001 vs metamfetamiin üksi (Tukey mitmekordne võrdlustest).
Arutelu
Käesoleva uuringu eesmärk oli kindlaks teha, kas mefedroon takistab metamfetamiini põhjustatud DA närvilõpmete toksilisust. Lähtudes selle keemilisest sarnasusest metamfetamiini ja MDMA-ga, eeldati esialgu, et mefedroon avaldab DA-neuronisüsteemile kahjulikku mõju. Siiski tuvastati mitmes uuringus peaaegu samaaegselt, et mefedroon ei ole DA-närvilõpmetele toksiline (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Küsimus, kas see ravim põhjustab 5-HT neuronaalsüsteemi kahjustusi, jääb lahtiseks. Ühes uuringus teatati 5-HT närvilõpmete funktsiooni püsivast vähenemisest (Hadlock et al. 2011), samas kui teises uuringus leiti, et mefedroon ei põhjustanud kahju (Baumann et al. 2012). Mefedroon interakteerub DA närvilõpuga viisil, mis viitab sellele, et see tõepoolest stimuleerib vabanemist ja blokeerib DA tagasihaarde DAT-ga suhtlemise kaudu. Metamfetamiini neurotoksilise toimemehhanismi peamine tahk on selle võime pääseda DAT-i kaudu DA närvilõpmetele ja häirida DA homöostaasi (Sulzer 2011). Kui see metamfetamiini neurotoksilise kaskaadi varajane etapp on DAT-i inhibeerimisega takistatud, on toksilisus takistatud (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt ja Gibb 1985). Me arutlesime, et mefedroonil võiks olla sama kaitsev omadus nagu teistel DAT-i inhibiitoritel, kuid täheldasime selle asemel toksilisuse olulist suurenemist. Seda koostoimet täheldati, kasutades kahte erinevat metamfetamiini annust, mis põhjustavad DA-närvilõpmete mõõdukat või rasket kahjustust (vastavalt 4X 2,5 või 5,0 mg / kg). See mefedrooni võimendav toime ei piirdunud ainult metamfetamiiniga ja laienes amfetamiinile ja MDMA-le, kahele ravimile, mida sageli koos mefedrooni ja teiste β-ketoamfetamiinidega kuritarvitatakse (Feyissa ja Kelly 2008, Schifano et al. 2011, Kelly 2011). Seega, vaatamata sellele, et mefedroon ei põhjusta toksilisust vähemalt striatumi DA-närvilõpmetele, võimendab see teiste kuritarvitatavate uimastite neurotoksilist mõju. See uus leid peaks mefedrooni kuritarvitamist veelgi karmimaks muutma, sest selle sisemise neurotoksilisuse puudumine võib muuta selle süütuna näivaks.
Hüpertermia on metamfetamiini (Greene et al. 2008) ja β-ketoamfetamiini manustamise äge kõrvaltoime inimestel (Borek ja Holstege 2012, Prosser ja Nelson 2012). Nagu metamfetamiin, põhjustavad ka paljud β-ketoamfetamiini uimastid närilistel märkimisväärset südametemperatuuri tõusu (Angoa-Perez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Kuigi metamfetamiini põhjustatud hüpertermia võib aidata kaasa selle morfoloogilistele ja neuroneid kahjustavatele mõjudele, ei pruugi hüpertermia olla nende mõjude otsene põhjus (Kiyatkin ja Sharma 2009). Me registreerisime mefedrooni ja metamfetamiiniga ravitud hiirte keha sisetemperatuuri ja täheldasime, et kombineeritud ravi ei tõstnud temperatuuri rohkem kui maksimaalne tõus, mida täheldati pärast kummagi ravimi manustamist eraldi. Metamfetamiin põhjustas annusest sõltuva kehatemperatuuri tõusu ja see hüpertermia oli muutumatu kogu testitud mefedrooni annuste vahemikus. Tegelikult säilis kehatemperatuuri süstimisjärgne langus, mida täheldati pärast mefedroonravi (Angoa-Perez et al. 2012), ka suuremate mefedroon- ja metamfetamiini annuste puhul. Kuigi ravimi poolt põhjustatud hüpertermiat ei suurendanud kombineeritud ravimravi, olid neurotoksilised mõjud aditiivsed. Seega näib vähemalt käesoleval juhul, et metamfetamiini neurotoksilist mõju võib mefedroon suurendada hüpertermia toimest sõltumatult.
Mefedroon pärsib selgelt DAT-funktsiooni ja blokeerib DA tagasihaarde in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). Mefedroon tõrjub WIN-35,428 oma seondumiskohast DAT-is, mis viitab sellele, et see on DA tagasihaarde konkurentsivõimeline inhibiitor (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). Mefedrooni tugevus on selles osas väga sarnane metamfetamiini (Cozzi et al. 1999) ja MDMA (Escubedo et al. 2011) tugevusega. Ei ole teada, kas mefedroon transporditakse DAT-i kaudu, kuid metkatinoon küll (Cozzi ja Foley 2003). Nomifensiin ja amfooneliinhape, mis seonduvad DAT-ga ja inhibeerivad DA omastamist, pakuvad olulist kaitset metamfetamiini põhjustatud neurotoksilisuse eest (Pu et al. 1994, Marek et al. 1990, Schmidt ja Gibb 1985, Poth et al. 2012) ja hiired, kellel puudub DAT, on resistentsed metamfetamiini neuronaalse toksilisuse suhtes (Fumagalli et al. 1998). Teades, et mefedroon ei ole neurotoksiline ja DAT-blokaator, viib see prognoosini, et see peaks ennetama toksilisust. Me testisime selles osas positiivse kontrollina nomifensiini ja kinnitasime, et see kaitseb metamfetamiini poolt põhjustatud DA, DAT ja TH ammendumise eest. Nomifensiin inhibeerib ka noradrenaliini transporterit (Brogden et al. 1979), kuid see omadus ei saa seletada käesolevaid tulemusi, sest enamik β-ketoamfetamiine, sealhulgas mefedroon, inhibeerivad noradrenaliini transporterit ja blokeerivad noradrenaliini omastamist (Kelly 2011, Rothman et al. 2003, Cozzi et al. 1999, Sogawa et al. 2011, Lopez-Arnau et al. 2012). 5-HT neuronaalse süsteemi roll mõnes mefedrooni farmakoloogilises toimes on võimalik, arvestades selle ravimi, nagu ka MDMA (Yamamoto et al. 1995), võimet põhjustada striataalse DA väljavoolu selle koostoimete kaudu 5-HT2A retseptoritega (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). Mefedrooni poolt põhjustatud hüperlokatsioon sõltub endogeensest 5-HT-st (Lopez-Arnau et al. 2012) ja see ravim stimuleerib ka 5-HT vabanemist ja inhibeerib selle omastamist in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) ja in vivo (Baumann et al. 2012, Kehr et al. 2011). Kuid me võime välistada endogeense 5-HT rolli vähemalt metamfetamiini DA neurotoksilisuses, näidates, et 5-HT geneetiliselt vähendatud hiired säilitavad oma tundlikkuse neurotoksilisuse suhtes (Thomas et al. 2010).
Mefedroon võib suurendada metamfetamiini neurotoksilisust mitme võimaliku mehhanismi abil. Esiteks võib mefedroon suhelda VMAT-iga, et põhjustada DA lekkimist presünaptilise närvilõpu tsütoplasmasse. Ravimid, mis suurendavad DA tsütoplasma basseini (st ravimi vabastamist), suurendavad metamfetamiini neurotoksilisust (Thomas et al. 2008, Thomas et al. 2009, Schmidt et al. 1985). See mehhanism ei ole tõenäoline, sest metkatinoon interakteerub VMAT-iga ainult nõrgalt (Cozzi et al. 1999). Teiseks, mefedrooni ja metamfetamiini kombinatsioonil võib olla sünergistlik mõju DA mittevesikulaarsele vabanemisele, kuid ka see võimalus tundub ebatõenäoline, arvestades tulemusi, mis näitavad, et DAT- või SERT-i ekspresseerivate CHO-rakkude töötlemine metetooni ja metamfetamiiniga ei avalda aditiivset mõju DA või 5-HT vabanemisele (Sogawa et al. 2011). Kolmandaks võib mefedroon suhelda DAT-iga uudsel viisil, mis aitab kaasa additiivsele toksilisusele. On näidatud, et metepedroon koos metamfetamiiniga põhjustab sünergistlikku tsütotoksilisust CHO rakkudes, mis ekspresseerivad DAT-i või SERT-i, kuid mitte metsikut tüüpi CHO rakkudes, kus puuduvad need transporterid (Sogawa et al. 2011). Kultuuritud rakkudes nendes uuringutes täheldatud tsütotoksilisus (st LDH vabanemine) erineb suuresti metamfetamiini poolt põhjustatud DA-närvilõpmete kahjustusest, kuid see mehhanism viitab DAT-i huvitavale, kuid määratlemata rollile kõrgendatud tsütotoksilisuses. Lõpuks võib mefedroon muuta metamfetamiini metabolismi. Mefedroon metaboliseerub peamiselt N-demetüleerimise teel (Meyer ja Maurer 2010), nagu ka metamfetamiin ja MDMA (Caldwell 1976). Seda mehhanismi toetab tõend, et metamfetamiin ja MDMA pärsivad vastastikku oma vastavate esmaste metaboliitide tootmist ja tõstavad narkootikumide plasmatasemeid kõrgemaks kui pärast kummagi ravimi manustamist üksi (Kuwayama et al. 2012). Praegu ja meie eelmises uuringus (Angoa-Perez et al. 2012) kasutatud mefedrooni annused on küll suured, kuid mitte neurotoksilised ja jäävad inimeste poolt kuritarvitatud annuste vahemikku (McErath ja O'Neill 2011). Seega võib mefedroon toimida nagu MDMA, et suurendada metamfetamiini plasmataset, inhibeerides selle metabolismi. Viimase võimaluse kinnitamiseks on vaja põhjalikku farmakokineetilist analüüsi.
β-ketoamfetamiinide kuritarvitamine suureneb murettekitavalt ja mefedroon on praegu üks kõige sagedamini kasutatavaid uimasteid kanepi, MDMA ja kokaiini järel (Morris 2010, Winstock et al. 2011b). Lisaks sellele tekitab mefedroon inimestes MDMAga võrreldes tugevamat iha (Brunt et al. 2011) ja mefedrooni nuusutanud kasutajad hindavad seda sõltuvust tekitavamaks kui kokaiini (Winstock et al. 2011b). Mefedrooni tarbivad inimesed joobesarnaselt ("stacking") ja seda tarvitatakse sageli koos teiste uimastitega, nagu kanepi ja amfetamiini psühhostimulantidega (Schifano et al. 2011, Fass et al. 2012, Winstock et al. 2011a, Kelly 2011, Torrance ja Cooper 2010). Mefedrooni leidub üha enam MDMA-na müüdavates tablettides (Brunt et al. 2011) ja selle kasutamine ületab tõenäoliselt MDMA kasutamise, kuna viimase puhtusaste langeb jätkuvalt (Brunt et al. 2011, Tanner-Smith 2006, Teng et al. 2006). Mefedrooni ja teiste "vannisoolade" koostisosade levinud kuritarvitamise mustrite põhjal on oluline kaaluda, kas nende uimastite tahtlikul või tahtmatul kombineerimisel amfetamiinidega tekivad inimestel täiendavad terviseriskid. Meie tulemused, mis näitavad, et vähemalt mefedroon suurendab märkimisväärselt metamfetamiini, amfetamiini ja MDMA põhjustatud neurotoksilisust striatumi DA-närvilõpmetele, näitavad selle β-ketoamfetamiini eriti ohtlikku ja ootamatut omadust.
Kasutatud lühendid
5-HT serotoniin
DA dopamiin
DAT DA transporter
MDMA 3,4-metüleendioksümetamfetamiin
TH türosiinhüdroksülaas
VMAT vesikulaarne monoamiini transporter
Mefedroon (4-metüülmetkatinoon) on katinooni derivaat ja metamfetamiini ja 3,4-metüleendioksümetamfetamiini (MDMA) struktuuriline analoog. Mefedroon on "vannisoolade" üks psühhoaktiivne koostisosa koos teiste ühenditega, nagu metüloon, butüloon ja 3,4-metüleendioksüpropüvaleroon (MDPV). β-ketoamfetamiini kuritarvitatakse üha sagedamini, mis on osaliselt tingitud sellest, et metamfetamiini ja MDMA sünteesiks vajalike lähteainete kättesaadavus salajastes laborites on väga piiratud ja nende puhtus on vastavalt vähenenud (Winstock et al. 2011b, Brunt et al. 2011). Kuna β-ketoamfetamiinide kuritarvitamine kasvab jätkuvalt, on nende kahjulike mõjude loetelu kasvanud, hõlmates kardiovaskulaarseid tüsistusi, rahutust, unetust, psühhoosi ja depressiooni (Schifano et al. 2011, Prosser ja Nelson 2012).
Metamfetamiini ja MDMA keemiliste sugulastena ei ole üllatav, et β-ketoamfetamiinidel on kesknärvisüsteemile palju samu mõjusid, mis neil endistel uimastitel. Näiteks blokeerivad need ravimid dopamiini (DA) ja serotoniini (5-HT) transportereid (vastavalt DAT ja SERT) (Cozzi et al. 1999, Rothman et al. 2003, Fleckenstein et al. 2000, Lopez-Arnau et al. 2012) ning stimuleerivad monoamiini vabanemist in vitro (Kalix ja Glennon 1986, Gygi et al. 1997, Rothman et al. 2003) ja in vivo (Gygi et al. 1997, Kehr et al. 2011). Metkatinoon põhjustab trüptofaanhüdroksülaasi ja türosiinhüdroksülaasi (TH) aktiivsuse püsivat vähenemist ning DA ja 5-HT ammendumist (Gygi et al. 1997, Gygi et al. 1996, Sparago et al. 1996). PET-kujutise uuringutes abstinentsetel metkatinooni kasutajatel ilmnes striataalse DAT-i vähenenud tihedus, mis viitab DA-terminaalide kadumisele (McCann et al. 1998). DA vabanemise samaaegne stimuleerimine ja selle omastamise pärssimine peegeldavad kriitilisi elemente, mis on aluseks metamfetamiiniga seotud neurotoksilisusele (Kuhn et al. 2008, Yamamoto ja Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Meie (Angoa-Perez et al. 2012) ja teised (Baumann et al. 2012, Hadlock et al. 2011) uurisime hiljuti võimalust, et mefedroon võib põhjustada neurotoksilisust nagu metamfetamiin ja MDMA. Üllatuslikult ei olnud mefedroon striatumi DA-närvilõpmetele toksiline (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Küsimus, kas mefedroon kahjustab 5-HT närvilõpmeid, on endiselt lahendamata, kuna üks uuring dokumenteeris positiivset mõju (Hadlock et al. 2011), samas kui teine uuring oli negatiivne (Baumann et al. 2012). Arvestades mefedrooni suhteliselt healoomulist mõju DA-närvilõpmetele ja arvestades selle omadusi DAT-blokaatorina, oletasime, et see võib tegelikult kaitsta DA-neuronisüsteemi metamfetamiini neurotoksiliste mõjude eest, nagu on teadaolevalt toimunud teiste DAT-blokaatoritega, nagu amfoneelhape (Pu et al. 1994, Schmidt ja Gibb 1985, Marek et al. 1990) ja nomifensiin (Poth et al. 2012). Praegu teatame, et mefedroon suurendab märkimisväärselt metamfetamiini neurotoksilisust. See mõju laieneb ka amfetamiinile ja MDMA-le, mis on sageli koos mefedrooniga tarvitatavad uimastid (Feyissa ja Kelly 2008, Schifano et al. 2011). Need üllatavad tulemused asetavad mefedrooni kuritarvitamise uude valgusse ja muudavad selle β-ketoamfetamiini peene ja ohtliku omaduse tunnustamise kiireloomuliseks.
Materjalid ja meetodid
Narkootikumid ja reagendid
Mefedroonvesinikkloriid ja 3,4-metüleendioksümetamfetamiin (MDMA) saadi NIDA uurimisressursside uimastivarustuse programmist. (+) Metamfetamiinvesinikkloriid, nomifensiinmaleaat, d-amfetamiinsulfaat, pentobarbitaal, DA ning kõik puhvrid ja HPLC-reaktiivid osteti Sigma-Aldrichist (St. Louis, MO, USA). Bitsinhooniinhappe valguanalüüsi komplektid saadi Pierce'ilt (Rockford, IL, USA). Polüklonaalsed antikehad roti TH vastu toodeti varem kirjeldatud viisil (Kuhn ja Billingsley 1987). Monoklonaalsed antikehad roti DAT vastu andis lahkesti Dr. Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA). HRP-konjugeeritud anti-IgG sekundaarsed antikehad andis Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA).
Loomad
Emased C57BL/6 hiired (Harlan, Indianapolis, IN, USA), kes katsete ajal kaalusid 20-25 g, paigutati 5 hiirt ühe puuri kohta suurtes kingakastidega puurides valguse (12 h valguse/pimeduse) ja temperatuuri kontrollitud ruumis. Kasutati emaseid hiiri, sest nad on teadaolevalt väga tundlikud neurotoksiliste amfetamiinide tekitatud neuronaalsete kahjustuste suhtes ja et säilitada kooskõla meie varasemate metamfetamiini neurotoksilisuse uuringutega (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). Hiirtel oli vaba juurdepääs toidule ja veele. Wayne'i Riikliku Ülikooli institutsionaalne hooldus- ja kasutuskomitee kiitis loomade hoolduse ja katsemenetlused heaks. Kõik protseduurid vastasid ka NIHi laboriloomade hooldamise ja kasutamise juhendile.
Farmakoloogilised, füsioloogilised ja käitumisprotseduurid
Hiirte raviti mefedrooniga, kasutades joobesarnast raviskeemi, mis koosnes 4 süstist 10, 20 või 40 mg/kg, kusjuures iga süstimise vahel oli 2-tunnine intervall. See joomaravi skeem, kui seda kasutatakse asendavate amfetamiinide ja katinooni derivaatide süstimiseks, põhjustab ulatuslikku DA närvilõpmete kahjustust. Praegu kasutatavad mefedrooni annused on varem näidanud, et need ei ole DA-närvilõpmetele toksilised (Angoa-Perez et al. 2012). Hiiri raviti metamfetamiini (4X 2,5 või 5 mg/kg), amfetamiini (4X 5 mg/kg) või MDMA (4X 20 mg/kg) üksi või kombinatsioonis mefedrooniga. Kui hiiri raviti kahe ravimiga, said nad 30 minutit enne iga 4 metamfetamiini, amfetamiini või MDMA süsti mefedrooni. Kontrollid said füsioloogilise soolalahuse süstid samas ajakavas, mida kasutati mefedrooni puhul üksi või kombinatsioonis teiste amfetamiinidega. DAT-inhibiitori mõju kontrollimiseks metamfetamiini toksilisusele raviti hiiri nomifensiiniga (4X 5 mg/kg) 30 minutit enne iga metamfetamiini süstimist (4X 5 mg/kg). Kõik süstid manustati i.p. teel. Hiired ohverdati 2 päeva pärast viimast ravimi manustamist, kui amfetamiiniga seotud neurotoksilisus oli saavutanud maksimumi. Kehatemperatuuri jälgiti telemeetria abil, kasutades Bio Medic Data Systems, Inc. (Seaford, DE, USA) IPTT-300 implanteeritavaid temperatuuriandureid. Temperatuuri registreeriti mitteinvasiivselt iga 20 minuti järel, alustades 60 minutit enne esimest METH-süsti ja jätkates 9 tunni jooksul pärast seda, kasutades Bio Medic'i DAS-5001 konsoolisüsteemi.
Striataalse DA sisalduse määramine
Striataalkude lõigati pärast ravi kahepoolselt ajust välja ja säilitati -80 °C juures. Külmutatud koed kaaluti ja sonicated 10 mahus 0,16 N perkloriinhappes 4 ° C juures. Lahustumatu valk eemaldati tsentrifuugimise teel ja DA määrati HPLC abil elektrokeemilise avastamisega, nagu on varem kirjeldatud metamfetamiini puhul (Thomas et al. 2010, Thomas et al, 2009).
TH- ja DAT-valgu taseme määramine immunobloti abil
Ravimiga töötlemise mõju striataalse TH ja DAT tasemele määrati immunoblottinguga, mis on striataalse DA närvilõpmete toksilisuse indeksiks. Hiired ohverdati pärast ravi dekapiteerimise teel ja striatum tükeldati kahepoolselt. Kude säilitati -80 °C juures. Külmutatud koed purustati 1% SDSis 95°C juures sonikatsiooni teel ja lahustumatu materjal settesti tsentrifuugimise teel. Valgus määrati bikiinhappemeetodil ja võrdsed valgu kogused (70 μg/laine) eraldati SDS-polüakrüülamiid-geelelektroforeesiga ja seejärel elektrobloteeriti nitrotselluloosile. Blotid blokeeriti Tris-puhvrisoolalahuses, mis sisaldas Tween 20 (0,1% v/v) ja 5% rasvata kuivpiima, 1 tunni jooksul toatemperatuuril. Blotidele lisati TH (1:1000) või DAT (1:1000) vastased primaarsed antikehad ja lasksime inkubeerida 16 tundi 4 °C juures. Blote pesti 3X Tris-puhverdatud soolalahuses, et eemaldada reageerimata antikehad ja seejärel inkubeeriti HRP-konjugeeritud anti-IgG sekundaarse antikehaga (1:4000) 1 h toatemperatuuril. Immunoreaktiivsed ribad visualiseeriti tugevdatud kemiluminestsentsiga ning TH- ja DAT-reaktiivsete ribade suhteline tihedus määrati pildistamise teel Kodak Image Stationiga (Carestream Molecular Systems, Rochester, NY, USA) ja kvantifitseeriti ImageJ tarkvara (NIH) abil.
Andmete analüüs
Metamfetamiini ja mefedrooni annuse mõju analüüsimiseks DA-le, DAT-le ja TH-le viidi läbi kahesuunalised ANOVA-d. Ravimitöötluste mõju striataalse DA, TH ja DAT sisaldusele testiti olulisuse suhtes ühesuunalise ANOVA abil, millele järgnes Tukey mitmekordne võrdlustest. Ravimitega töötlemise tulemusi keha sisetemperatuurile aja jooksul analüüsiti kahesuunalise ANOVA abil, millele järgnes Bonferroni test, et määrata kindlaks temperatuuri erinevuste olulisus üksikutel ajahetkedel pärast ravi. Erinevusi peeti oluliseks, kui p < 0,05. Kõik statistilised analüüsid viidi läbi, kasutades GraphPad Prism versiooni 5.02 for Windows (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Siirdu edasi:
Tulemused
Mefedrooni mõju metamfetamiini põhjustatud neurotoksilisusele
Mefedrooni annustes (10, 20 või 40 mg/kg), mis teadaolevalt ei põhjusta DA närvilõpmete toksilisust (Angoa-Perez et al. 2012), manustati 30 minutit enne iga metamfetamiini süstimist. Metamfetamiini manustati annustes, mis põhjustavad mõõdukat (4X 2,5 mg/kg) või rasket (4X 5 mg/kg) kahjustust striatumi DA-närvilõpmetele (Thomas et al. 2004, Thomas et al. 2010). Joonisel 1 esitatud tulemused näitavad, et metamfetamiini annuse (F1,40 = 66,60, p < 0,0001) ja mefedrooni annuse (F4,40 = 131,3, p < 0,0001) peamine mõju DA tasemele striatumis oli kahesuunalise ANOVA abil väga oluline. Mefedrooni peamine mõju, mis anti koos 2,5 mg/kg (F4,22 = 35,96, p < 0,001) või 5,0 mg/kg metamfetamiiniga (F4,17 = 953,9, p < 0,0001), oli samuti väga oluline ühesuunalise ANOVA abil. Kõik töötlused metamfetamiini ± mefedrooni mõlema annusega põhjustasid DA märkimisväärselt suuremat vähenemist võrreldes vastava kontrolliga (p < 0,0001 kõigi puhul). Joonis 1 näitab ka, et mefedrooni annused 20 (p < 0,01) ja 40 mg/kg (p < 0,001) suurendasid märkimisväärselt 2,5 mg/kg metamfetamiini ammendavat mõju DA-le, samas kui kõik mefedrooni annused suurendasid märkimisväärselt 5,0 mg/kg metamfetamiini mõju DA tasemele (p < 0,0001 kõigi puhul).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/sywobkqrnd-jpg.47/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Joonis 1
Mefedrooni mõju metamfetamiini põhjustatud striataalse DA vähenemisele. Hiiri raviti näidatud mefedrooni (MEPH) annustega 30 minutit enne iga 2.5 (-) või 5.0 mg / kg (■) metamfetamiini (METH) süstimist ja ohverdati 2d hiljem striataalse DA taseme määramiseks HPLC abil. Andmed on keskmised ± SEM 5-7 hiire kohta rühma kohta. Mõned veabargad olid liiga väikesed, et ületada sümbolite suurust, ja need ei ole nähtavad. ***p < 0,001 vs kontrollid ja #p < 0,01, ##p < 0,001 või ###p < 0,0001 vs vastav metamfetamiini annus (Tukey mitmekordne võrdlustest).
Joonis 2a näitab, et mefedroon suurendas märkimisväärselt metamfetamiini poolt põhjustatud DAT-i taseme vähenemist, nagu on määratud immunoblottinguga. Immunoblotid kvantifitseeriti ja kooskõlas DA tulemustega olid metamfetamiini annuse (F1,92 = 9,48, p < 0,001) ja mefedrooni annuse (F4,92 = 37,56, p < 0,0001) peamised mõjud DAT-i tasemetele striatumis kahesuunalise ANOVA abil väga olulised (joonis 2b). Mefedrooni peamine mõju, mis anti koos 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) või 5,0 mg/kg metamfetamiiniga (F4,39 = 24,84, p < 0,0001), oli samuti väga oluline ühesuunalise ANOVA abil. Kõik ravimeetodid ükskõik millise metamfetamiini ± mefedrooni annusega põhjustasid DAT-i oluliselt suuremat vähenemist võrreldes vastava kontrolliga (p < 0,01 ainult 2,5 mg/kg metamfetamiini puhul; p < 0,0001 kõigi teiste ravimeetodite puhul). Joonis 2b näitab ka, et mefedrooni annused 20 mg/kg (p < 0,01) ja 40 mg/kg (p < 0,001) suurendasid märkimisväärselt 2,5 mg/kg metamfetamiini põhjustatud DAT-i vähenemist, samas kui ainult 40 mg/kg mefedrooni annus suurendas märkimisväärselt (p < 0,01) 5,0 mg/kg metamfetamiini mõju DAT-i vähenemisele.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/bfu3sx5dnr-jpg.4797/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Joonis 2
Mefedrooni mõju metamfetamiini poolt põhjustatud striataalse DAT-i vähenemisele. Hiiri raviti näidatud mefedrooni annustega (MEPH) 30 minutit enne iga 2,5 (●) või 5,0 mg / kg (■) metamfetamiini (METH) süstimist ja ohverdati 2d hiljem striataalse DAT-i taseme määramiseks immunobloti abil (a). Blotid kvantifitseeriti ImageJ abil ja andmed on keskmised ± SEM 10-12 hiire kohta rühma kohta (b). *p < 0,01 või ***p < 0,0001 vs kontroll (C) ja #p < 0,01 või ##p < 0,001 vs vastav metamfetamiini annus (Tukey mitmekordne võrdlustest).
Joonisel 3a on näidatud, et mefedroon suurendas märkimisväärselt metamfetamiini poolt põhjustatud TH taseme vähenemist, nagu on määratud immunoblottinguga. Immunoblotid kvantifitseeriti ja kooskõlas eespool toodud DA ja DAT tulemustega olid metamfetamiini annuse (F1,81 = 47,89, p < 0,0001) ja mefedrooni annuse (F4,81 = 63,57, p < 0,0001) peamised mõjud kahesuunalise ANOVA abil väga olulised (joonis 3b). Mefedrooni manustamise peamine mõju koos 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) või 5,0 mg/kg metamfetamiiniga (F4,49 = 99,16, p < 0,0001) oli samuti väga oluline ühesuunalise ANOVA abil. Kõik töötlused metamfetamiini ± mefedrooni kummagi annusega põhjustasid oluliselt suuremat TH vähenemist võrreldes vastava kontrolliga (p < 0,001 2,5 mg/kg metamfetamiini + 10 mg/kg mefedrooni puhul; p < 0,0001 kõigi teiste kombinatsioonide puhul), välja arvatud 2,5 mg/kg metamfetamiini üksi, mis ei muutnud oluliselt TH taset (st ei põhjustanud toksilisust). Joonisel 3b on samuti näha, et mefedrooni annused 20 mg/kg (p < 0,01) ja 40 mg/kg (p < 0,001) suurendasid märkimisväärselt 2,5 mg/kg metamfetamiini põhjustatud TH vähenemist ja kõik kolm mefedrooni annust suurendasid märkimisväärselt (p < 0,0001) 5,0 mg/kg metamfetamiini mõju TH vähenemisele.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/tggfrjpqru-jpg.4798/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Joonis 3
Mefedrooni mõju metamfetamiini poolt põhjustatud striataalse TH vähenemisele. Hiiri raviti näidatud mefedrooni annustega (MEPH) 30 minutit enne iga 2,5 (●) või 5,0 mg / kg (■) metamfetamiini (METH) süstimist ja ohverdati 2d hiljem striataalse TH taseme määramiseks immunoblottinguga (a). Blotid kvantifitseeriti ImageJ abil ja andmed on keskmised ± SEM 10-12 hiire kohta rühma kohta (b). Mõned veabargad olid liiga väikesed, et ületada sümbolite suurust, ja need ei ole nähtavad. **p < 0,001 või ***p < 0,0001 vs kontroll (C) ja #p < 0,01, ##p < 0,001 või ###p < 0,0001) vs vastav metamfetamiini annus (Tukey mitmekordne võrdlustest).
Mefedrooni mõju metamfetamiini poolt põhjustatud hüpertermiale
Mefedroon põhjustab sarnaselt metamfetamiiniga märkimisväärset hüpertermiat (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Kui mefedrooni manustati 30 minutit enne iga metamfetamiini süsti, on joonisel 4 näha, et metamfetamiini ja mefedrooni annuste (F1,300 = 11,99, p < 0,0001) peamine mõju aja (F4,300 = 51,73, p < 0,0001) oli kahesuunalise ANOVA abil väga oluline. Kahepoolse ANOVA abil olid samuti väga olulised mefedrooni ja 2,5 mg/kg metamfetamiini (F4,120 = 41,44, p < 0,0001, paneel a) kombinatsiooni peamised mõjud aja jooksul (F30,120 = 3,84, p < 0,0001) või 5,0 mg/kg metamfetamiini (F4,120 = 78,09, p < 0,0001, paneel b) aja jooksul (F30,120 = 9,98, p < 0,0001). Kõik töötlused metamfetamiini ± mefedrooni mõlema annusega erinesid oluliselt vastavatest kontrollidest (p < 0,0001 kõigi töötluste puhul).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/x0ik9hdwsw-jpg.4799/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Joonis 4
Mefedrooni mõju metamfetamiini põhjustatud hüpertermiale. Hiiri raviti näidatud annustega mefedrooni (MEPH) 30 minutit enne iga 2,5 (a) või 5,0 mg/kg (b) metamfetamiini (METH) süstimist. Tuuma temperatuuri mõõdeti 20-minutiliste intervallidega telemeetria abil, alustades 60 minutit enne esimest metamfetamiini süstimist. 4 metamfetamiini süstimist on tähistatud x-teljel asetsevate nooltega. Andmed on väljendatud 6-8 hiire kehatemperatuuri keskmisena rühma kohta. SEM oli alati < 10% keskmisest ja on selguse huvides välja jäetud.
Mefedrooni mõju amfetamiini ja MDMA poolt põhjustatud neurotoksilisusele
Selleks, et testida, kas mefedrooni tugevdav mõju metamfetamiinile võib laieneda ka teistele neurotoksilistele amfetamiinidele, raviti hiiri selle β-ketoamfetamiiniga (20 mg/kg) pluss amfetamiin (4X 5 mg/kg) või MDMA (4X 20 mg/kg) ja tulemused on esitatud joonisel 5. Tuletame meelde, et mefedroon ise ei vähenda striataalset DA-d, DAT-i või TH-d (Angoa-Perez et al. 2012). Ravimi peamine mõju (F5,27 = 27.18, p < 0.0001) oli ülimalt oluline ühepoolse ANOVA abil DA vähenemise puhul (joonis 5a). Samuti on joonisel 5a näha, et kõik ravid amfetamiini (p < 0.001) või MDMA (p < 0.001) üksi või kombinatsioonis mefedrooniga (p < 0.0001 mõlema ravimi puhul) vähendasid märkimisväärselt DA taset võrreldes kontrolliga. Mefedroon suurendas märkimisväärselt amfetamiini (p < 0,01) või MDMA (p < 0,01) põhjustatud DA vähenemist. Joonis 5b näitab sarnast mõju kombinatsioonravimite ravile DAT-i tasemele striatumis. Ravimi peamine mõju (F4,49 = 42.63, p < 0.0001) oli DAT-i jaoks ülimalt oluline ühepoolse ANOVA abil. Joonisel 5b on samuti näha, et kõik amfetamiini või MDMA-ga tehtud ravid olid võrreldes kontrolliga märkimisväärselt (p < 0,0001 kõigi puhul) madalamad. Mefedroon suurendas samuti märkimisväärselt DAT-i vähenemist, mida põhjustas kas amfetamiin või MDMA (p < 0,0001 mõlemal juhul). Lõpuks näitab joonis 5c, et ravimi peamine mõju (F4,50 = 75,06, p < 0,0001) oli väga oluline ühepoolse ANOVA abil TH vähenemise puhul. Samuti on joonisel 5c näha, et kõik amfetamiini või MDMA-ga tehtud ravid olid võrreldes kontrolliga märkimisväärselt (p < 0,0001 kõigi puhul) madalamad. Mefedroon suurendas samuti märkimisväärselt TH vähenemist, mida põhjustas kas amfetamiin või MDMA (p < 0,0001 mõlemal juhul).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/onvypkgxvn-jpg.4800/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Joonis 5
Mefedrooni mõju amfetamiini või MDMA põhjustatud DA närvilõpmete neurotoksilisusele. Hiiri raviti 20 mg/kg mefedrooniga (MEPH) 30 minutit enne iga 5,0 mg/kg amfetamiini (AMPH) või 20 mg/kg MDMA süstimist ja ohverdati 2d pärast ravi, et määrata striataalseid DA tasemeid (a) HPLC abil. (b) DAT ja (c) TH määrati immunobloti abil ja blotid kvantifitseeriti ImageJ abil. Representatiivsed immunoblotid DAT ja TH jaoks on lisatud vastavalt paneelide (b) ja (c) lisadena ning mõlema paneeli puhul on ravi märgitud 1,5: kontroll; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; ja 8: MDMA + MEPH. Andmed on keskmised ± SEM 5-12 hiire kohta igas rühmas. **p < 0,001 või ***p < 0,0001 vs kontroll ja #p < 0,01 või ###p < 0,0001 vs AMPH või MDMA (Tukey mitmekordne võrdlustest).
Nomifensiini mõju metamfetamiini põhjustatud neurotoksilisusele
Nomifensiini, võimsat DAT-blokaatorit, mille kuritarvitamise või neurotoksilise potentsiaali ei ole teada, testiti selle võime suhtes kaitsta metamfetamiini põhjustatud neurotoksilisuse eest ja kontrastiks mefedrooni toimele metamfetamiini, amfetamiini ja MDMA põhjustatud DA-närvilõpmete toksilisusele. Tulemused joonisel 6a näitavad, et ravimi peamine mõju (F3,16 = 63,39, p < 0,0001) DA-tasemetele oli ülimalt oluline ühesuunalise ANOVA abil. Nomifensiin üksi ei muutnud DA taset, kuid metamfetamiini põhjustatud vähenemine (p < 0,0001) tühistati nomifensiiniga veidi, kuid märkimisväärselt (p < 0,01). Ravimi peamine mõju (F3,20 = 16.78, p < 0.0001) DAT-tasemetele oli väga oluline ühepoolse ANOVA abil, nagu on näidatud joonisel 6b. Nomifensiin ei muutnud DAT-i taset, kuid pakkus märkimisväärset kaitset (p < 0,001) metamfetamiini põhjustatud striataalse DAT-i vähenemise eest (p < 0,0001) võrreldes kontrolliga. Lõpuks näitab joonis 6c, et ravimi peamine mõju (F3,15 = 14,10, p < 0,0001) TH-tasemetele oli ülimalt oluline ühesuunalise ANOVA abil. Nagu näha DA ja DAT puhul, vähendas nomifensiin (p < 0,0001) metamfetamiini põhjustatud TH vähenemist (p < 0,01) veidi, kuid märkimisväärselt (p < 0,01).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/daczg9cwfv-jpg.4801/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Joonis 6
Nomifensiini mõju metamfetamiini poolt põhjustatud DA närvilõpmete neurotoksilisusele. Hiiri raviti 5,0 mg / kg nomifensiini (NOM) 30 minutit enne iga 5,0 mg / kg metamfetamiini (METH) süstimist ja ohverdati 2d hiljem striataalse DA taseme määramiseks (a) HPLC abil. (b) DAT ja (c) TH määrati immunobloti abil ja blotid kvantifitseeriti ImageJ abil. DAT-i ja TH-i esinduslikud immunoblotid on lisatud paneelide (b) ja (c) lisadena. Andmed on keskmised pluss SEM 5-7 hiire kohta rühma kohta. ***p < 0,0001 vs kontroll (C) ja #p < 0,01 või ##p < 0,001 vs metamfetamiin üksi (Tukey mitmekordne võrdlustest).
Arutelu
Käesoleva uuringu eesmärk oli kindlaks teha, kas mefedroon takistab metamfetamiini põhjustatud DA närvilõpmete toksilisust. Lähtudes selle keemilisest sarnasusest metamfetamiini ja MDMA-ga, eeldati esialgu, et mefedroon avaldab DA-neuronisüsteemile kahjulikku mõju. Siiski tuvastati mitmes uuringus peaaegu samaaegselt, et mefedroon ei ole DA-närvilõpmetele toksiline (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Küsimus, kas see ravim põhjustab 5-HT neuronaalsüsteemi kahjustusi, jääb lahtiseks. Ühes uuringus teatati 5-HT närvilõpmete funktsiooni püsivast vähenemisest (Hadlock et al. 2011), samas kui teises uuringus leiti, et mefedroon ei põhjustanud kahju (Baumann et al. 2012). Mefedroon interakteerub DA närvilõpuga viisil, mis viitab sellele, et see tõepoolest stimuleerib vabanemist ja blokeerib DA tagasihaarde DAT-ga suhtlemise kaudu. Metamfetamiini neurotoksilise toimemehhanismi peamine tahk on selle võime pääseda DAT-i kaudu DA närvilõpmetele ja häirida DA homöostaasi (Sulzer 2011). Kui see metamfetamiini neurotoksilise kaskaadi varajane etapp on DAT-i inhibeerimisega takistatud, on toksilisus takistatud (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt ja Gibb 1985). Me arutlesime, et mefedroonil võiks olla sama kaitsev omadus nagu teistel DAT-i inhibiitoritel, kuid täheldasime selle asemel toksilisuse olulist suurenemist. Seda koostoimet täheldati, kasutades kahte erinevat metamfetamiini annust, mis põhjustavad DA-närvilõpmete mõõdukat või rasket kahjustust (vastavalt 4X 2,5 või 5,0 mg / kg). See mefedrooni võimendav toime ei piirdunud ainult metamfetamiiniga ja laienes amfetamiinile ja MDMA-le, kahele ravimile, mida sageli koos mefedrooni ja teiste β-ketoamfetamiinidega kuritarvitatakse (Feyissa ja Kelly 2008, Schifano et al. 2011, Kelly 2011). Seega, vaatamata sellele, et mefedroon ei põhjusta toksilisust vähemalt striatumi DA-närvilõpmetele, võimendab see teiste kuritarvitatavate uimastite neurotoksilist mõju. See uus leid peaks mefedrooni kuritarvitamist veelgi karmimaks muutma, sest selle sisemise neurotoksilisuse puudumine võib muuta selle süütuna näivaks.
Hüpertermia on metamfetamiini (Greene et al. 2008) ja β-ketoamfetamiini manustamise äge kõrvaltoime inimestel (Borek ja Holstege 2012, Prosser ja Nelson 2012). Nagu metamfetamiin, põhjustavad ka paljud β-ketoamfetamiini uimastid närilistel märkimisväärset südametemperatuuri tõusu (Angoa-Perez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Kuigi metamfetamiini põhjustatud hüpertermia võib aidata kaasa selle morfoloogilistele ja neuroneid kahjustavatele mõjudele, ei pruugi hüpertermia olla nende mõjude otsene põhjus (Kiyatkin ja Sharma 2009). Me registreerisime mefedrooni ja metamfetamiiniga ravitud hiirte keha sisetemperatuuri ja täheldasime, et kombineeritud ravi ei tõstnud temperatuuri rohkem kui maksimaalne tõus, mida täheldati pärast kummagi ravimi manustamist eraldi. Metamfetamiin põhjustas annusest sõltuva kehatemperatuuri tõusu ja see hüpertermia oli muutumatu kogu testitud mefedrooni annuste vahemikus. Tegelikult säilis kehatemperatuuri süstimisjärgne langus, mida täheldati pärast mefedroonravi (Angoa-Perez et al. 2012), ka suuremate mefedroon- ja metamfetamiini annuste puhul. Kuigi ravimi poolt põhjustatud hüpertermiat ei suurendanud kombineeritud ravimravi, olid neurotoksilised mõjud aditiivsed. Seega näib vähemalt käesoleval juhul, et metamfetamiini neurotoksilist mõju võib mefedroon suurendada hüpertermia toimest sõltumatult.
Mefedroon pärsib selgelt DAT-funktsiooni ja blokeerib DA tagasihaarde in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). Mefedroon tõrjub WIN-35,428 oma seondumiskohast DAT-is, mis viitab sellele, et see on DA tagasihaarde konkurentsivõimeline inhibiitor (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). Mefedrooni tugevus on selles osas väga sarnane metamfetamiini (Cozzi et al. 1999) ja MDMA (Escubedo et al. 2011) tugevusega. Ei ole teada, kas mefedroon transporditakse DAT-i kaudu, kuid metkatinoon küll (Cozzi ja Foley 2003). Nomifensiin ja amfooneliinhape, mis seonduvad DAT-ga ja inhibeerivad DA omastamist, pakuvad olulist kaitset metamfetamiini põhjustatud neurotoksilisuse eest (Pu et al. 1994, Marek et al. 1990, Schmidt ja Gibb 1985, Poth et al. 2012) ja hiired, kellel puudub DAT, on resistentsed metamfetamiini neuronaalse toksilisuse suhtes (Fumagalli et al. 1998). Teades, et mefedroon ei ole neurotoksiline ja DAT-blokaator, viib see prognoosini, et see peaks ennetama toksilisust. Me testisime selles osas positiivse kontrollina nomifensiini ja kinnitasime, et see kaitseb metamfetamiini poolt põhjustatud DA, DAT ja TH ammendumise eest. Nomifensiin inhibeerib ka noradrenaliini transporterit (Brogden et al. 1979), kuid see omadus ei saa seletada käesolevaid tulemusi, sest enamik β-ketoamfetamiine, sealhulgas mefedroon, inhibeerivad noradrenaliini transporterit ja blokeerivad noradrenaliini omastamist (Kelly 2011, Rothman et al. 2003, Cozzi et al. 1999, Sogawa et al. 2011, Lopez-Arnau et al. 2012). 5-HT neuronaalse süsteemi roll mõnes mefedrooni farmakoloogilises toimes on võimalik, arvestades selle ravimi, nagu ka MDMA (Yamamoto et al. 1995), võimet põhjustada striataalse DA väljavoolu selle koostoimete kaudu 5-HT2A retseptoritega (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). Mefedrooni poolt põhjustatud hüperlokatsioon sõltub endogeensest 5-HT-st (Lopez-Arnau et al. 2012) ja see ravim stimuleerib ka 5-HT vabanemist ja inhibeerib selle omastamist in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) ja in vivo (Baumann et al. 2012, Kehr et al. 2011). Kuid me võime välistada endogeense 5-HT rolli vähemalt metamfetamiini DA neurotoksilisuses, näidates, et 5-HT geneetiliselt vähendatud hiired säilitavad oma tundlikkuse neurotoksilisuse suhtes (Thomas et al. 2010).
Mefedroon võib suurendada metamfetamiini neurotoksilisust mitme võimaliku mehhanismi abil. Esiteks võib mefedroon suhelda VMAT-iga, et põhjustada DA lekkimist presünaptilise närvilõpu tsütoplasmasse. Ravimid, mis suurendavad DA tsütoplasma basseini (st ravimi vabastamist), suurendavad metamfetamiini neurotoksilisust (Thomas et al. 2008, Thomas et al. 2009, Schmidt et al. 1985). See mehhanism ei ole tõenäoline, sest metkatinoon interakteerub VMAT-iga ainult nõrgalt (Cozzi et al. 1999). Teiseks, mefedrooni ja metamfetamiini kombinatsioonil võib olla sünergistlik mõju DA mittevesikulaarsele vabanemisele, kuid ka see võimalus tundub ebatõenäoline, arvestades tulemusi, mis näitavad, et DAT- või SERT-i ekspresseerivate CHO-rakkude töötlemine metetooni ja metamfetamiiniga ei avalda aditiivset mõju DA või 5-HT vabanemisele (Sogawa et al. 2011). Kolmandaks võib mefedroon suhelda DAT-iga uudsel viisil, mis aitab kaasa additiivsele toksilisusele. On näidatud, et metepedroon koos metamfetamiiniga põhjustab sünergistlikku tsütotoksilisust CHO rakkudes, mis ekspresseerivad DAT-i või SERT-i, kuid mitte metsikut tüüpi CHO rakkudes, kus puuduvad need transporterid (Sogawa et al. 2011). Kultuuritud rakkudes nendes uuringutes täheldatud tsütotoksilisus (st LDH vabanemine) erineb suuresti metamfetamiini poolt põhjustatud DA-närvilõpmete kahjustusest, kuid see mehhanism viitab DAT-i huvitavale, kuid määratlemata rollile kõrgendatud tsütotoksilisuses. Lõpuks võib mefedroon muuta metamfetamiini metabolismi. Mefedroon metaboliseerub peamiselt N-demetüleerimise teel (Meyer ja Maurer 2010), nagu ka metamfetamiin ja MDMA (Caldwell 1976). Seda mehhanismi toetab tõend, et metamfetamiin ja MDMA pärsivad vastastikku oma vastavate esmaste metaboliitide tootmist ja tõstavad narkootikumide plasmatasemeid kõrgemaks kui pärast kummagi ravimi manustamist üksi (Kuwayama et al. 2012). Praegu ja meie eelmises uuringus (Angoa-Perez et al. 2012) kasutatud mefedrooni annused on küll suured, kuid mitte neurotoksilised ja jäävad inimeste poolt kuritarvitatud annuste vahemikku (McErath ja O'Neill 2011). Seega võib mefedroon toimida nagu MDMA, et suurendada metamfetamiini plasmataset, inhibeerides selle metabolismi. Viimase võimaluse kinnitamiseks on vaja põhjalikku farmakokineetilist analüüsi.
β-ketoamfetamiinide kuritarvitamine suureneb murettekitavalt ja mefedroon on praegu üks kõige sagedamini kasutatavaid uimasteid kanepi, MDMA ja kokaiini järel (Morris 2010, Winstock et al. 2011b). Lisaks sellele tekitab mefedroon inimestes MDMAga võrreldes tugevamat iha (Brunt et al. 2011) ja mefedrooni nuusutanud kasutajad hindavad seda sõltuvust tekitavamaks kui kokaiini (Winstock et al. 2011b). Mefedrooni tarbivad inimesed joobesarnaselt ("stacking") ja seda tarvitatakse sageli koos teiste uimastitega, nagu kanepi ja amfetamiini psühhostimulantidega (Schifano et al. 2011, Fass et al. 2012, Winstock et al. 2011a, Kelly 2011, Torrance ja Cooper 2010). Mefedrooni leidub üha enam MDMA-na müüdavates tablettides (Brunt et al. 2011) ja selle kasutamine ületab tõenäoliselt MDMA kasutamise, kuna viimase puhtusaste langeb jätkuvalt (Brunt et al. 2011, Tanner-Smith 2006, Teng et al. 2006). Mefedrooni ja teiste "vannisoolade" koostisosade levinud kuritarvitamise mustrite põhjal on oluline kaaluda, kas nende uimastite tahtlikul või tahtmatul kombineerimisel amfetamiinidega tekivad inimestel täiendavad terviseriskid. Meie tulemused, mis näitavad, et vähemalt mefedroon suurendab märkimisväärselt metamfetamiini, amfetamiini ja MDMA põhjustatud neurotoksilisust striatumi DA-närvilõpmetele, näitavad selle β-ketoamfetamiini eriti ohtlikku ja ootamatut omadust.
Kasutatud lühendid
5-HT serotoniin
DA dopamiin
DAT DA transporter
MDMA 3,4-metüleendioksümetamfetamiin
TH türosiinhüdroksülaas
VMAT vesikulaarne monoamiini transporter