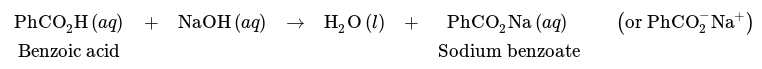G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,654
- Solutions
- 3
- Reaction score
- 2,732
- Points
- 113
- Deals
- 1
Théorie de l'extraction.
Le terme "extraction" désigne le transfert d'un ou de plusieurs composés d'un solide ou d'un liquide dans un solvant ou une phase différente. Lorsqu'un sachet de thé est ajouté à de l'eau chaude, les composés responsables de la saveur et de la couleur du thé sont extraits du thé dans l'eau. Le café décaféiné est obtenu en utilisant des solvants ou du dioxyde de carbone supercritique pour extraire la caféine des grains de café. En laboratoire de chimie, on utilise le plus souvent l'extraction liquide-liquide, un processus qui se déroule dans une ampoule à décanter. Une solution contenant des composants dissous est placée dans l'entonnoir et un solvant non miscible est ajouté, ce qui donne deux couches qui sont agitées l'une contre l'autre. Le plus souvent, une couche est aqueuse et l'autre est un solvant organique. Les composants sont "extraits" lorsqu'ils passent d'une couche à l'autre. La forme de l'ampoule à décanter permet un drainage efficace et la séparation des deux couches.
Fig.1 Schéma de l'extraction

Les composés passent d'un liquide à l'autre en fonction de leur solubilité relative dans chaque liquide. Un guide rapide de la solubilité est le principe "pareil dissout pareil", ce qui signifie que les composés non polaires devraient être facilement extraits dans des solvants non polaires (et vice versa). Les composés responsables du goût et de la couleur du thé doivent être polaires s'ils sont facilement extraits dans l'eau chaude. Lorsqu'on laisse deux liquides s'équilibrer dans une ampoule à décanter, la majorité d'un composé se retrouve souvent dans la couche où il est le plus soluble.
Fig.2

Procédures d'extraction étape par étape.
Extraction liquide-liquide
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/threads/extraction.553/
Extraction simple.
Les images de cette section montrent une extraction unique du rouge de méthyle (composé coloré, Fig. 3) d'une solution aqueuse (couche inférieure) dans 25 ml d'acétate d'éthyle (couche supérieure). La solution aqueuse a initialement une couleur rose, car le rouge de méthyle apparaît rouge dans une solution acide (la solution aqueuse a été préparée à partir de 50 ml d'eau, de 5 gouttes de 0,1MHCl et de 5 gouttes de solution d'indicateur de rouge de méthyle à 1%). Le rouge de méthyle a un coefficient de partage élevé et est extrait de la couche aqueuse dans l'acétate d'éthyle au cours de ce processus.
Progression de l'extraction du rouge de méthyle (le composé coloré) de la couche aqueuse acide (en bas) vers la couche organique (en haut). Les inversions ont été effectuées lentement afin de voir l'extraction par étapes. Même en mélangeant doucement, le rouge de méthyle s'extrait rapidement.


Préparation de l'installation (pour une extraction unique)
1. Se procurer une ampoule à décanter (Fig.4 a).- a) Si l'ampoule à décanter est munie d'un robinet en téflon, remonter le robinet s'il a été démonté pour sécher, en plaçant les pièces dans l'ordre approprié (Fig.4 b). Veiller à ce que le robinet en téflon soit modérément serré afin qu'il puisse encore tourner facilement, mais qu'il ne soit pas trop lâche pour que le liquide puisse s'infiltrer autour du joint.
- b) Si vous utilisez un robinet en verre (Fig.4 c), il ne nécessite probablement aucune autre préparation. Une très fine couche de graisse doit être utilisée pour sceller le robinet et empêcher le gel. Si des robinets en verre et en téflon sont disponibles, le téflon est un meilleur choix, car il est toujours possible qu'un solvant dissolve la graisse utilisée avec les robinets en verre et contamine l'échantillon.
- c) Se procurer également un bouchon (téflon ou verre rodé) qui s'insère bien dans le joint supérieur de l'entonnoir (Fig.4 a).
2. Placer l'ampoule à décanter dans une pince à anneau fixée à un support à anneau ou à un treillis. Les entonnoirs se cassent facilement, c'est pourquoi il faut les caler dans la pince métallique à l'aide de morceaux de tuyau en caoutchouc ou en plastique fendu (Fig.4 d).
.4

a) Entonnoir de séparation, b) Ordre correct des composants du robinet d'arrêt, c) Robinet d'arrêt en verre, d) Entonnoir dans le collier de serrage amorti.Ajouter les solutions (pour une extraction unique)
3. Avant de verser quoi que ce soit dans une ampoule à décanter, assurez-vous que le robinet est en position "fermée", c'est-à-dire qu'il est à l'horizontale (figure 5 a). En guise de sécurité, placez toujours un erlenmeyer sous l'ampoule à décanter avant de la verser (figure 5 b). Cela permet de récupérer le liquide au cas où le robinet d'arrêt serait accidentellement laissé ouvert, ou si le robinet d'arrêt est desserré et que le liquide s'écoule par inadvertance.
4. À l'aide d'un entonnoir, verser le liquide à extraire dans l'ampoule à décanter (Fig.5 b). L'ampoule à décanter ne doit jamais être utilisée avec un liquide chaud ou tiède. Le joint en verre rodé de l'ampoule à décanter est plus susceptible de coller au bouchon s'il y a eu du liquide dans le joint à un moment ou à un autre. En versant le liquide dans l'ampoule à décanter à l'aide d'un entonnoir à pied court, on évite de mouiller le joint, qui risque donc moins de geler pendant le mélange.
3. Avant de verser quoi que ce soit dans une ampoule à décanter, assurez-vous que le robinet est en position "fermée", c'est-à-dire qu'il est à l'horizontale (figure 5 a). En guise de sécurité, placez toujours un erlenmeyer sous l'ampoule à décanter avant de la verser (figure 5 b). Cela permet de récupérer le liquide au cas où le robinet d'arrêt serait accidentellement laissé ouvert, ou si le robinet d'arrêt est desserré et que le liquide s'écoule par inadvertance.
4. À l'aide d'un entonnoir, verser le liquide à extraire dans l'ampoule à décanter (Fig.5 b). L'ampoule à décanter ne doit jamais être utilisée avec un liquide chaud ou tiède. Le joint en verre rodé de l'ampoule à décanter est plus susceptible de coller au bouchon s'il y a eu du liquide dans le joint à un moment ou à un autre. En versant le liquide dans l'ampoule à décanter à l'aide d'un entonnoir à pied court, on évite de mouiller le joint, qui risque donc moins de geler pendant le mélange.
Verser une quantité de solvant extractif dans l'ampoule à décanter, comme indiqué par la procédure (Fig.5 c). Il n'est pas nécessaire d'utiliser des quantités précises de solvant pour les extractions et les volumes peuvent être mesurés dans une éprouvette graduée. Si une procédure prévoit 20 ml de solvant, il est acceptable d'en utiliser entre 20 et 25 ml à chaque fois.
Mélanger les solutions (pour une extraction unique)
6. Placer le bouchon sur l'entonnoir et tenir l'entonnoir de manière à ce que les doigts d'une main couvrent fermement le bouchon, tandis que l'autre main saisit le fond de l'entonnoir (Fig.6 a).
7. Retourner doucement l'entonnoir (Fig.6 b) et faire tourner un peu le mélange. Bien qu'il ne soit pas rare qu'un peu de liquide s'infiltre dans le joint de verre pilé lorsqu'il est inversé, cette infiltration doit être minime. Si du liquide coule sur vos doigts ou vos gants lorsque vous retournez l'entonnoir, le bouchon n'est probablement pas de la bonne taille.
Mélanger les solutions (pour une extraction unique)
6. Placer le bouchon sur l'entonnoir et tenir l'entonnoir de manière à ce que les doigts d'une main couvrent fermement le bouchon, tandis que l'autre main saisit le fond de l'entonnoir (Fig.6 a).
7. Retourner doucement l'entonnoir (Fig.6 b) et faire tourner un peu le mélange. Bien qu'il ne soit pas rare qu'un peu de liquide s'infiltre dans le joint de verre pilé lorsqu'il est inversé, cette infiltration doit être minime. Si du liquide coule sur vos doigts ou vos gants lorsque vous retournez l'entonnoir, le bouchon n'est probablement pas de la bonne taille.
8. La pression peut s'accumuler à l'intérieur de l'ampoule à décanter lorsque les solutions sont mélangées. C'est pourquoi, immédiatement après avoir agité l'ampoule à décanter, et alors que l'ampoule est toujours inversée, il faut "purger" l'ampoule en ouvrant brièvement le robinet d'arrêt pour permettre à la pression de s'échapper (Fig.6 c). La pression augmente dans l'entonnoir à mesure que le solvant s'évapore dans l'espace de tête et apporte de la vapeur supplémentaire à la pression d'air initiale de ∼1 atmosphère dans l'entonnoir. Dans le cas de solvants très volatils (comme l'éther diéthylique), on peut entendre un "swoosh" net lors de la mise à l'air libre, et de petites quantités de liquide peuvent même jaillir du robinet d'arrêt. Si du liquide sort du robinet, essayez de le laisser s'écouler dans l'entonnoir. Le bruit associé à la mise à l'air libre cesse normalement après la deuxième ou la troisième inversion, car l'espace de tête est saturé de vapeurs de solvant et les pressions à l'intérieur et à l'extérieur de l'entonnoir s'équilibrent.
Note de sécurité : ne dirigez jamais le robinet d'arrêt vers quelqu'un pendant que vous purgez, car il est possible qu'une partie du liquide lui soit projetée.
9. Fermez le robinet et mélangez les solutions un peu plus vigoureusement, en vous arrêtant périodiquement pour purger le système. Il existe des divergences d'opinion sur la vigueur avec laquelle les solutions doivent être mélangées dans les ampoules à décanter et sur la durée de ce mélange. En règle générale, un mélange léger pendant 10 à 20 secondes devrait suffire. Avec certaines solutions (par exemple le dichlorométhane), il faut veiller à ne pas agiter trop vigoureusement, car ces solutions forment souvent des émulsions (où l'interface entre les solutions ne se clarifie pas). Pour les solutions sujettes aux émulsions, il convient de secouer doucement un entonnoir pendant une minute.
10. Placer l'ampoule à décanter à la verticale dans la pince à anneaux pour permettre aux couches de se séparer complètement. L'interface entre les couches devrait se stabiliser assez rapidement, souvent en l'espace de 10 secondes environ. Si l'interface est trouble ou mal définie (une émulsion s'est formée), voir la section "Dépannage" pour des conseils.
Séparer les couches (pour une extraction unique)
11. Le liquide ne s'écoulera pas bien d'une ampoule à décanter si le bouchon reste en place, car l'air ne peut pas entrer dans l'ampoule pour remplacer le liquide déplacé. Si le liquide s'écoule de l'ampoule sans être remplacé par un volume égal d'air, une pression négative se formera dans l'ampoule. Par conséquent, avant de vider le liquide d'une ampoule à décanter, il faut retirer le bouchon (Fig.7 a).
12. Vider la plus grande partie de la couche inférieure dans un erlenmeyer propre, en positionnant le collier de serrage de manière à ce que l'extrémité de l'ampoule à décanter soit nichée dans l'erlenmeyer pour éviter les éclaboussures (figure 7 b). Arrêter la vidange lorsque l'interface se trouve à moins de 1 cm du fond du robinet.
13. Agiter doucement l'entonnoir pour déloger les gouttelettes accrochées au verre (Fig.7 c). Un agitateur en verre peut être utilisé pour faire tomber les gouttelettes qui restent accrochées.
14. Poursuivre la vidange de la couche inférieure, en s'arrêtant lorsque l'interface pénètre juste dans la chambre du robinet d'arrêt (Fig.7 d). Etiqueter l'erlenmeyer (par exemple "couche inférieure").
Note de sécurité : ne dirigez jamais le robinet d'arrêt vers quelqu'un pendant que vous purgez, car il est possible qu'une partie du liquide lui soit projetée.
9. Fermez le robinet et mélangez les solutions un peu plus vigoureusement, en vous arrêtant périodiquement pour purger le système. Il existe des divergences d'opinion sur la vigueur avec laquelle les solutions doivent être mélangées dans les ampoules à décanter et sur la durée de ce mélange. En règle générale, un mélange léger pendant 10 à 20 secondes devrait suffire. Avec certaines solutions (par exemple le dichlorométhane), il faut veiller à ne pas agiter trop vigoureusement, car ces solutions forment souvent des émulsions (où l'interface entre les solutions ne se clarifie pas). Pour les solutions sujettes aux émulsions, il convient de secouer doucement un entonnoir pendant une minute.
10. Placer l'ampoule à décanter à la verticale dans la pince à anneaux pour permettre aux couches de se séparer complètement. L'interface entre les couches devrait se stabiliser assez rapidement, souvent en l'espace de 10 secondes environ. Si l'interface est trouble ou mal définie (une émulsion s'est formée), voir la section "Dépannage" pour des conseils.
Séparer les couches (pour une extraction unique)
11. Le liquide ne s'écoulera pas bien d'une ampoule à décanter si le bouchon reste en place, car l'air ne peut pas entrer dans l'ampoule pour remplacer le liquide déplacé. Si le liquide s'écoule de l'ampoule sans être remplacé par un volume égal d'air, une pression négative se formera dans l'ampoule. Par conséquent, avant de vider le liquide d'une ampoule à décanter, il faut retirer le bouchon (Fig.7 a).
12. Vider la plus grande partie de la couche inférieure dans un erlenmeyer propre, en positionnant le collier de serrage de manière à ce que l'extrémité de l'ampoule à décanter soit nichée dans l'erlenmeyer pour éviter les éclaboussures (figure 7 b). Arrêter la vidange lorsque l'interface se trouve à moins de 1 cm du fond du robinet.
13. Agiter doucement l'entonnoir pour déloger les gouttelettes accrochées au verre (Fig.7 c). Un agitateur en verre peut être utilisé pour faire tomber les gouttelettes qui restent accrochées.
14. Poursuivre la vidange de la couche inférieure, en s'arrêtant lorsque l'interface pénètre juste dans la chambre du robinet d'arrêt (Fig.7 d). Etiqueter l'erlenmeyer (par exemple "couche inférieure").
Fig.

a) Enlever le bouchon avant de vider l'entonnoir, b) Vider jusqu'à l'interface, c) Gouttelettes accrochées (en utilisant un système différent), d) S'arrêter lorsque l'interface est dans le robinet.15. Verser la couche supérieure de l'ampoule à décanter dans un autre erlenmeyer propre (figure 8 a), en veillant à étiqueter à nouveau cet erlenmeyer (figure 8 b). La technique appropriée consiste à drainer la couche inférieure par le robinet d'arrêt et à verser la couche supérieure par le haut de l'ampoule à décanter. Cette méthode minimise le remélange des solutions, car seule la couche inférieure touche la tige de l'entonnoir.
16. Ne jetez jamais les liquides d'une extraction tant que vous n'êtes pas absolument sûr d'avoir obtenu le composé désiré. Les couches non désirées peuvent être éliminées correctement lorsque le composé désiré est entre vos mains (par exemple, après que l'évaporateur rotatif a éliminé le solvant).
Les erreurs commises pendant les extractions (par exemple, continuer avec la mauvaise couche) peuvent être résolues tant que les solutions n'ont pas été placées dans le conteneur à déchets ! Les couches doivent également être conservées jusqu'à ce qu'elles soient évaporées, car le composé souhaité peut ne pas être très soluble dans le solvant utilisé. Si le composé n'est pas extrait dans un solvant, un autre solvant peut être essayé plus tard, mais seulement si les couches n'ont pas encore été jetées.
Nettoyage (pour une extraction unique)
Pour nettoyer une ampoule à décanter, il faut d'abord la rincer à l'acétone dans un conteneur à déchets. Lavez ensuite l'entonnoir avec de l'eau et du savon sur votre paillasse. Démontez le robinet en téflon (le cas échéant). Après avoir été rincées à l'eau distillée, les pièces doivent sécher séparément dans votre casier (Fig.8 c).
Les erreurs commises pendant les extractions (par exemple, continuer avec la mauvaise couche) peuvent être résolues tant que les solutions n'ont pas été placées dans le conteneur à déchets ! Les couches doivent également être conservées jusqu'à ce qu'elles soient évaporées, car le composé souhaité peut ne pas être très soluble dans le solvant utilisé. Si le composé n'est pas extrait dans un solvant, un autre solvant peut être essayé plus tard, mais seulement si les couches n'ont pas encore été jetées.
Nettoyage (pour une extraction unique)
Pour nettoyer une ampoule à décanter, il faut d'abord la rincer à l'acétone dans un conteneur à déchets. Lavez ensuite l'entonnoir avec de l'eau et du savon sur votre paillasse. Démontez le robinet en téflon (le cas échéant). Après avoir été rincées à l'eau distillée, les pièces doivent sécher séparément dans votre casier (Fig.8 c).
Extractions multiples.
Cette section contient des instructions progressives sur la manière d'extraire une solution aqueuse avec un solvant organique moins dense que l'eau (la couche organique sera en haut). À titre d'exemple, les instructions sont écrites pour extraire une solution aqueuse trois fois en utilisant 25 ml d'éther diéthylique à chaque fois (3×25 ml d'éther diéthylique). Un résumé de la procédure des deux premières extractions est présenté dans la Fig.9. Deux extractions lorsque la couche organique est en haut.
Fig.9 Deux extractions lorsque la couche organique est sur le

Extraction #1
1. Effectuer une seule extraction en utilisant environ 25 ml d'éther diéthylique (une quantité exacte n'est pas nécessaire), comme décrit précédemment, en veillant à étiqueter correctement chaque couche (par exemple, "couche organique supérieure" et "couche aqueuse inférieure").
Extraction n° 2
2. Remettre la couche aqueuse dans l'ampoule à décanter. Il n'est pas nécessaire de laver l'entonnoir entre les extractions.
3. Ajouter une nouvelle portion de 25 ml d'éther diéthylique dans l'ampoule à décanter. Boucher l'ampoule, la retourner et l'agiter en la ventilant, puis laisser les couches se séparer.
À ce stade, il doit y avoir deux couches dans l'ampoule à décanter. Si ce n'est pas le cas, il est probable que la mauvaise couche a été ajoutée dans l'ampoule à décanter à l'étape 2 (une erreur courante). Une façon de vérifier si c'est le cas est d'ajouter un peu d'eau à l'aide d'un flacon pulvérisateur. Si la couche replacée dans l'ampoule à décanter est la couche organique (incorrecte), l'eau du flacon ne se mélangera pas à la solution et tombera sous forme de gouttelettes au fond de l'ampoule. Si la couche organique (incorrecte) a été accidentellement remise dans l'ampoule à décanter, il n'y a pas de mal, car la couche organique a simplement été diluée. Reversez le liquide dans la fiole destinée à la couche organique et ajoutez plutôt la solution aqueuse dans l'ampoule à décanter.
4. Drainer la couche aqueuse inférieure dans un erlenmeyer : il est acceptable d'utiliser le même erlenmeyer que celui qui a été utilisé pour la couche aqueuse lors de la première extraction (qui peut avoir été étiqueté "couche aqueuse inférieure").
5. Étant donné qu'il est plus courant de combiner les couches organiques lors d'extractions multiples, la couche organique supérieure peut être versée de l'ampoule à décanter dans le même ballon que celui utilisé pour la couche organique lors de la première extraction (qui peut avoir été étiqueté "couche organique supérieure"). Dans ce ballon, il devrait y avoir environ 50 ml d'éther diéthylique provenant des deux extractions.
Extraction n° 3
6. Répéter l'extraction une troisième fois en ajoutant la couche aqueuse de la deuxième extraction dans l'ampoule à décanter, suivie d'une nouvelle portion de 25 ml d'éther diéthylique. Boucher l'ampoule, la retourner et l'agiter en la ventilant, puis laisser les couches se séparer.
7. Drainer la couche aqueuse dans le ballon approprié, et verser à nouveau la couche supérieure dans le ballon de la couche organique, où il devrait y avoir environ 75 ml d'éther diéthylique provenant des trois extractions.
1. Effectuer une seule extraction en utilisant environ 25 ml d'éther diéthylique (une quantité exacte n'est pas nécessaire), comme décrit précédemment, en veillant à étiqueter correctement chaque couche (par exemple, "couche organique supérieure" et "couche aqueuse inférieure").
Extraction n° 2
2. Remettre la couche aqueuse dans l'ampoule à décanter. Il n'est pas nécessaire de laver l'entonnoir entre les extractions.
3. Ajouter une nouvelle portion de 25 ml d'éther diéthylique dans l'ampoule à décanter. Boucher l'ampoule, la retourner et l'agiter en la ventilant, puis laisser les couches se séparer.
À ce stade, il doit y avoir deux couches dans l'ampoule à décanter. Si ce n'est pas le cas, il est probable que la mauvaise couche a été ajoutée dans l'ampoule à décanter à l'étape 2 (une erreur courante). Une façon de vérifier si c'est le cas est d'ajouter un peu d'eau à l'aide d'un flacon pulvérisateur. Si la couche replacée dans l'ampoule à décanter est la couche organique (incorrecte), l'eau du flacon ne se mélangera pas à la solution et tombera sous forme de gouttelettes au fond de l'ampoule. Si la couche organique (incorrecte) a été accidentellement remise dans l'ampoule à décanter, il n'y a pas de mal, car la couche organique a simplement été diluée. Reversez le liquide dans la fiole destinée à la couche organique et ajoutez plutôt la solution aqueuse dans l'ampoule à décanter.
4. Drainer la couche aqueuse inférieure dans un erlenmeyer : il est acceptable d'utiliser le même erlenmeyer que celui qui a été utilisé pour la couche aqueuse lors de la première extraction (qui peut avoir été étiqueté "couche aqueuse inférieure").
5. Étant donné qu'il est plus courant de combiner les couches organiques lors d'extractions multiples, la couche organique supérieure peut être versée de l'ampoule à décanter dans le même ballon que celui utilisé pour la couche organique lors de la première extraction (qui peut avoir été étiqueté "couche organique supérieure"). Dans ce ballon, il devrait y avoir environ 50 ml d'éther diéthylique provenant des deux extractions.
Extraction n° 3
6. Répéter l'extraction une troisième fois en ajoutant la couche aqueuse de la deuxième extraction dans l'ampoule à décanter, suivie d'une nouvelle portion de 25 ml d'éther diéthylique. Boucher l'ampoule, la retourner et l'agiter en la ventilant, puis laisser les couches se séparer.
7. Drainer la couche aqueuse dans le ballon approprié, et verser à nouveau la couche supérieure dans le ballon de la couche organique, où il devrait y avoir environ 75 ml d'éther diéthylique provenant des trois extractions.
Résolution des problèmes.
Cette section décrit les problèmes et les solutions les plus courants dans les extractions.Il n'y a qu'une seule couche
La raison la plus courante pour laquelle il n'y a qu'une seule couche dans une ampoule à décanter alors qu'il devrait y en avoir deux (comme lorsque la procédure vous demande de "séparer les couches") est que l'on a fait une erreur. Ce qui s'est probablement passé, c'est que la mauvaise couche a été ajoutée à l'ampoule à décanter - par exemple, la couche organique a été ajoutée à la place de la couche aqueuse sans que l'on s'en rende compte. Lorsque le solvant organique est ajouté à une couche organique dans l'ampoule à décanter, il n'y a qu'une seule couche. L'erreur peut être corrigée tant que les couches n'ont pas été jetées ! Si la bonne couche est ajoutée dans l'ampoule à décanter, tout se passera comme prévu. Pour éviter de commettre cette erreur à l'avenir, veillez à étiqueter les fioles d'Erlenmeyer. Veillez également à ne jamais jeter une couche avant d'être absolument sûr d'avoir tout fait correctement.
Une raison occasionnelle pour laquelle une seule couche se forme dans une ampoule à décanter est la présence de grandes quantités de composés qui se dissolvent dans les deux solvants, par exemple en présence de grandes quantités d'éthanol, qui se dissout bien dans les solvants aqueux et organiques. Dans ce cas, la meilleure approche consiste à éliminer le composé gênant (c'est-à-dire l'éthanol) sur un évaporateur rotatif avant l'extraction.
Il y a trois couches
La raison la plus courante de la présence de trois couches dans une ampoule à décanter est un mélange inadéquat (Fig.10 a). Si l'ampoule est secouée plus vigoureusement, il est probable qu'elle se sépare en deux couches (Fig.10 b). Il est également possible que la troisième couche du milieu soit une émulsion, où les deux couches ne sont pas complètement séparées.
La raison la plus courante pour laquelle il n'y a qu'une seule couche dans une ampoule à décanter alors qu'il devrait y en avoir deux (comme lorsque la procédure vous demande de "séparer les couches") est que l'on a fait une erreur. Ce qui s'est probablement passé, c'est que la mauvaise couche a été ajoutée à l'ampoule à décanter - par exemple, la couche organique a été ajoutée à la place de la couche aqueuse sans que l'on s'en rende compte. Lorsque le solvant organique est ajouté à une couche organique dans l'ampoule à décanter, il n'y a qu'une seule couche. L'erreur peut être corrigée tant que les couches n'ont pas été jetées ! Si la bonne couche est ajoutée dans l'ampoule à décanter, tout se passera comme prévu. Pour éviter de commettre cette erreur à l'avenir, veillez à étiqueter les fioles d'Erlenmeyer. Veillez également à ne jamais jeter une couche avant d'être absolument sûr d'avoir tout fait correctement.
Une raison occasionnelle pour laquelle une seule couche se forme dans une ampoule à décanter est la présence de grandes quantités de composés qui se dissolvent dans les deux solvants, par exemple en présence de grandes quantités d'éthanol, qui se dissout bien dans les solvants aqueux et organiques. Dans ce cas, la meilleure approche consiste à éliminer le composé gênant (c'est-à-dire l'éthanol) sur un évaporateur rotatif avant l'extraction.
Il y a trois couches
La raison la plus courante de la présence de trois couches dans une ampoule à décanter est un mélange inadéquat (Fig.10 a). Si l'ampoule est secouée plus vigoureusement, il est probable qu'elle se sépare en deux couches (Fig.10 b). Il est également possible que la troisième couche du milieu soit une émulsion, où les deux couches ne sont pas complètement séparées.
Fig.

a) Trois couches initiales dues à un mélange inadéquat, b) Deux couches résultant d'un mélange plus vigoureux.Il y a des matières insolubles à l'interface.
Une petite quantité de film insoluble entre deux couches n'est pas rare au cours d'une extraction. Les matériaux polymériques ont tendance à rester entre les couches, car les interactions avec les solvants sont minimisées à l'interface. Il n'y a pas lieu de s'inquiéter d'un petit film, car si une petite quantité se retrouve dans la couche organique, une étape ultérieure de séchage et de filtration l'éliminera souvent.
L'interface est invisible.
Il arrive que les composés présents dans une ampoule à décanter soient si sombres qu'ils masquent l'interface entre les deux couches. Dans ce cas, plusieurs méthodes peuvent vous aider à voir l'interface. L'une d'entre elles consiste à tenir l'ampoule à décanter à la lumière ou à éclairer le verre avec une lampe de poche (Fig.11 b). Une lumière supplémentaire permet parfois de voir l'interface. Une deuxième méthode consiste à observer attentivement les couches en inclinant l'ampoule à décanter d'avant en arrière sur le côté (figure 11 c). L'œil peut parfois déceler des différences subtiles dans la façon dont les liquides s'écoulent. Une troisième méthode consiste à ajouter un peu plus de solvant dans l'entonnoir pour diluer quelque peu l'une des couches, ou à ajouter un solvant différent pour modifier l'indice de réfraction.
Les couches ne se séparent pas bien (une émulsion s'est formée)
Les émulsions peuvent se produire pour plusieurs raisons.
1. La densité de chaque couche peut être si similaire que les liquides ont peu de raisons de se séparer.2. Des composés de type savon ou d'autres agents émulsifiants peuvent être présents et dissoudre certains composants les uns dans les autres.
Les émulsions peuvent être très difficiles à rectifier et il est préférable de les éviter en agitant doucement dans l'ampoule à décanter les solutions susceptibles de former des émulsions (par exemple, le dichlorométhane avec des solutions très basiques ou denses). Néanmoins, si une émulsion se forme, il existe quelques moyens d'essayer de la clarifier.
- a) Pour les émulsions légères, agiter doucement les couches et essayer de faire tomber les gouttelettes en suspension à l'aide d'un agitateur en verre.
- b) Laissez la solution reposer pendant un certain temps (même jusqu'à la prochaine séance de laboratoire) si possible. Avec suffisamment de temps, certaines solutions se décantent d'elles-mêmes. Ceci n'est bien sûr pas toujours pratique.
- c) Pour les petits volumes, utilisez une centrifugeuse si vous en avez une à votre disposition. Une centrifugeuse accélère le processus de décantation d'une émulsion. N'oubliez pas qu'une centrifugeuse doit être équilibrée, sinon elle risque d'osciller sur la paillasse. Répartissez les solutions de manière égale, en plaçant des tubes de même volume l'un en face de l'autre à l'intérieur de la centrifugeuse.
- d) Si une émulsion se forme parce que les deux couches ont des densités similaires, essayez de modifier la densité de chaque couche pour les rendre plus différentes. Pour clarifier une émulsion, essayez de diminuer la densité de la couche supérieure ou d'augmenter la densité de la couche inférieure. Par exemple, si une émulsion se produit avec de l'acétate d'éthyle (couche supérieure) et une solution aqueuse (couche inférieure), ajoutez du NaCl. Le NaCl se dissoudra dans la couche aqueuse et augmentera la densité de la solution aqueuse. Une autre solution consiste à ajouter de l'acétate d'éthyle, qui diluera la couche organique et abaissera sa densité. En dernier recours, ajoutez du pentane, qui se mélangera à la couche organique supérieure et diminuera sa densité (le pentane est l'un des solvants organiques les moins denses). L'ajout de pentane est utilisé en dernier recours, car il affecte négativement la capacité de la couche organique à extraire des composés quelque peu polaires.
Si une émulsion se produit avec une solution aqueuse (couche supérieure) et du dichlorométhane (couche inférieure), ajoutez un peu d'eau à partir d'un flacon pulvérisateur pour diluer la couche supérieure et diminuer sa densité. Cette méthode a bien fonctionné pour clarifier l'émulsion de la figure 13 c, comme le montre la figure 13 d. - c) Essayez de réduire la solubilité d'un composant dans l'autre. Une méthode consiste à ajouter du NaCl ou du NH4Cl dans l'ampoule à décanter, qui se dissout dans la couche aqueuse et diminue la capacité des composés organiques à se dissoudre dans l'eau ("salage").
Extraction acide-base
Extractionacide-base
- G.Patton
- 2
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/threads/extraction.553/
Comment cela fonctionne-t-il?
Une modification des extractions précédemment abordées dans ce chapitre consiste à effectuer une réaction chimique dans l'ampoule à décanter afin de modifier la polarité et donc le partage d'un composé dans les couches aqueuse et organique. Une méthode courante consiste à effectuer une réaction acide-base, qui peut convertir certains composés de formes neutres en formes ioniques (ou vice versa).
Par exemple, imaginons qu'un mélange d'acide benzoïque et de cyclohexane soit dissous dans un solvant organique tel que l'acétate d'éthyle dans une ampoule à décanter. Pour séparer les composants, on peut tenter un lavage à l'eau pour éliminer l'acide benzoïque, mais celui-ci n'est pas particulièrement soluble dans l'eau en raison de son anneau aromatique non polaire, et seules de petites quantités seraient extraites dans la couche aqueuse (Fig.14 a).
Par exemple, imaginons qu'un mélange d'acide benzoïque et de cyclohexane soit dissous dans un solvant organique tel que l'acétate d'éthyle dans une ampoule à décanter. Pour séparer les composants, on peut tenter un lavage à l'eau pour éliminer l'acide benzoïque, mais celui-ci n'est pas particulièrement soluble dans l'eau en raison de son anneau aromatique non polaire, et seules de petites quantités seraient extraites dans la couche aqueuse (Fig.14 a).
Fig.

Lavage d'un mélange d'acide benzoïque et de cyclohexane avec : a) de l'eau, b) du NaOH aqueux.La séparation d'un mélange d'acide benzoïque et de cyclohexane est toutefois possible par un lavage avec une base, telle que NaOH. En raison de sa nature acide, l'acide benzoïque peut subir une réaction avec NaOH comme suit, ce qui donne le sel carboxylate de benzoate de sodium.
Les propriétés de solubilité des acides carboxyliques sont sensiblement différentes de celles de leurs sels de carboxylate correspondants. Le salicylate de sodium est environ 350 fois plus soluble dans l'eau que l'acide salicylique en raison de son caractère ionique (Fig.15), et il est plutôt insoluble dans les solvants organiques tels que l'éther diéthylique.
Par conséquent, un lavage au NaOH convertirait l'acide benzoïque en sa forme carboxylate ionique, qui serait alors plus soluble dans la couche aqueuse, ce qui permettrait d'extraire le benzoate de sodium dans la couche aqueuse. Le cyclohexane reste dans la couche organique car il n'a aucune affinité avec la phase aqueuse et ne peut en aucun cas réagir avec le NaOH. De cette manière, un mélange d'acide benzoïque et de cyclohexane peut être séparé (Fig.14 b). La couche aqueuse peut être acidifiée ultérieurement avec du HCl(aq) si on le souhaite pour ramener l'acide benzoïque à sa forme neutre.
Lavages au bicarbonate de sodium
Une extraction acide-base peut être utilisée pour extraire les acides carboxyliques de la couche organique vers la couche aqueuse. Comme nous l'avons vu dans la section précédente, le NaOH peut être utilisé pour convertir un acide carboxylique en sa forme carboxylate ionique, plus soluble dans l'eau. Toutefois, si le mélange contient un composé désiré qui peut réagir avec le NaOH, il convient d'utiliser une base plus douce telle que le bicarbonate de sodium. Une réaction similaire se produit.
Lavages au bicarbonate de sodium
Une extraction acide-base peut être utilisée pour extraire les acides carboxyliques de la couche organique vers la couche aqueuse. Comme nous l'avons vu dans la section précédente, le NaOH peut être utilisé pour convertir un acide carboxylique en sa forme carboxylate ionique, plus soluble dans l'eau. Toutefois, si le mélange contient un composé désiré qui peut réagir avec le NaOH, il convient d'utiliser une base plus douce telle que le bicarbonate de sodium. Une réaction similaire se produit.
L'utilisation de la base NaHCO3 au lieu de NaOH présente une différence : le sous-produit, l'acide carbonique (H2CO3), peut se décomposer en eau et en dioxyde de carbone. Lors de l'agitation d'une solution acide avec du bicarbonate de sodium dans une ampoule à décanter, il faut veiller à agiter doucement et à ventiler plus fréquemment pour libérer la pression du gaz.
La réaction d'estérification de Fischer est un exemple de réaction pour laquelle le lavage au bicarbonate de sodium est souvent utilisé. Pour illustrer cette réaction, de l'acide benzoïque a été chauffé à reflux dans de l'éthanol avec de l'acide sulfurique concentré afin de former du benzoate d'éthyle (Fig.16 a et b). Une plaque CCM du mélange réactionnel après 1 heure de reflux a montré un acide carboxylique résiduel n'ayant pas réagi (Fig.16 c), ce qui n'est pas rare en raison de l'énergie de la réaction.
La réaction d'estérification de Fischer est un exemple de réaction pour laquelle le lavage au bicarbonate de sodium est souvent utilisé. Pour illustrer cette réaction, de l'acide benzoïque a été chauffé à reflux dans de l'éthanol avec de l'acide sulfurique concentré afin de former du benzoate d'éthyle (Fig.16 a et b). Une plaque CCM du mélange réactionnel après 1 heure de reflux a montré un acide carboxylique résiduel n'ayant pas réagi (Fig.16 c), ce qui n'est pas rare en raison de l'énergie de la réaction.
Fig.

a) Réactifs à reflux, b) Schéma de réaction, c) CCM après 1 heure de reflux, où la première voie (BA) est l'acide benzoïque, la deuxième voie (Co) est le co-spot et la troisième voie (Pr) est le mélange réactionnel (réalisé avec 1:1 hexanes:acétate d'éthyle et visualisé à la lumière UV).L'acide carboxylique résiduel peut être éliminé du produit ester désiré par une extraction acide-base dans une ampoule à décanter. Un lavage au bicarbonate de sodium convertit l'acide benzoïque en sa forme plus soluble dans l'eau, le benzoate de sodium, et l'extrait dans la couche aqueuse (Fig. 17). En outre, le bicarbonate de sodium neutralise l'acide catalytique dans cette réaction.
L'.

Le bicarbonate de sodium est préférable au NaOH dans ce processus, car il s'agit d'une base beaucoup plus faible ; le lavage au NaOH pourrait provoquer l'hydrolyse du produit ester.
Mélanges d'acides et de bases
Comme nous l'avons vu précédemment, les propriétés acido-basiques des composés peuvent être utilisées pour extraire sélectivement certains composés de mélanges. Cette stratégie peut être étendue à d'autres exemplesMélanges d'acides et de bases
Extraction de bases
Les composés basiques tels que les amines peuvent être extraits de solutions organiques en les agitant avec des solutions acides pour les convertir en sels plus solubles dans l'eau. Ils peuvent ainsi être extraits d'une couche organique vers une couche aqueuse.Extraction des acides carboxyliques et des phénols
Comme nous l'avons vu précédemment, les acides carboxyliques peuvent être extraits d'une couche organique vers une couche aqueuse en les agitant avec des solutions basiques, ce qui les convertit en leurs sels plus solubles dans l'eau.
Comme nous l'avons vu précédemment, les acides carboxyliques peuvent être extraits d'une couche organique vers une couche aqueuse en les agitant avec des solutions basiques, ce qui les convertit en leurs sels plus solubles dans l'eau.
Une réaction similaire se produit avec les phénols (PhOH), et ils peuvent également être extraits dans une couche aqueuse de NaOH (Fig.18 a).
Cependant, les phénols sont beaucoup moins acides que les acides carboxyliques et ne sont pas assez acides pour réagir complètement avec NaHCO3, une base plus faible. Par conséquent, une solution de bicarbonate peut être utilisée pour séparer les mélanges de phénols et d'acides carboxyliques (Fig.18 b).
Cependant, les phénols sont beaucoup moins acides que les acides carboxyliques et ne sont pas assez acides pour réagir complètement avec NaHCO3, une base plus faible. Par conséquent, une solution de bicarbonate peut être utilisée pour séparer les mélanges de phénols et d'acides carboxyliques (Fig.18 b).
Fig.

a) Extraction des acides carboxyliques et des phénols dans une solution de NaOH(aq) à 5%, b) Extraction des acides carboxyliques dans une solution de NaHCO3(aq) à 5%.Extraction des composés acides, basiques et neutres
Les propriétés acido-basiques discutées précédemment permettent de purifier un mélange contenant des composants acides (par exemple RCO2H), basiques (par exemple RNH2) et neutres par une série d'extractions, comme le résume la Fig.19 (qui utilise un solvant organique moins dense que l'eau).
Les propriétés acido-basiques discutées précédemment permettent de purifier un mélange contenant des composants acides (par exemple RCO2H), basiques (par exemple RNH2) et neutres par une série d'extractions, comme le résume la Fig.19 (qui utilise un solvant organique moins dense que l'eau).
Fig.19


On suppose que les lecteurs qui réalisent ce type d'expérience sont familiarisés avec la réalisation d'extractions simples et multiples. Cette section décrit les différences entre les procédures d'extraction générales et le processus résumé dans la figure 19.
1. Isolement du composant acide :
a) Lorsque le composant acide se trouve dans la couche aqueuse d'un erlenmeyer, il peut être reconverti en composant neutre par addition de HCl (aq) 2M jusqu'à ce que la solution donne un pH de 3-4 (déterminé par un papier pH). Si de grandes quantités d'acide sont présentes, de sorte que l'acidification nécessiterait un volume trop important de HCl(aq) 2M, du HCl(aq) concentré peut être ajouté goutte à goutte. Des concentrations plus faibles de HCl(aq) sont moins dangereuses, mais une augmentation importante du volume de la couche aqueuse affecterait l'efficacité des extractions et des filtrations ultérieures.
b) Après l'acidification, deux voies peuvent être suivies, selon que le composant acide est solide ou liquide.
1. Isolement du composant acide :
a) Lorsque le composant acide se trouve dans la couche aqueuse d'un erlenmeyer, il peut être reconverti en composant neutre par addition de HCl (aq) 2M jusqu'à ce que la solution donne un pH de 3-4 (déterminé par un papier pH). Si de grandes quantités d'acide sont présentes, de sorte que l'acidification nécessiterait un volume trop important de HCl(aq) 2M, du HCl(aq) concentré peut être ajouté goutte à goutte. Des concentrations plus faibles de HCl(aq) sont moins dangereuses, mais une augmentation importante du volume de la couche aqueuse affecterait l'efficacité des extractions et des filtrations ultérieures.
b) Après l'acidification, deux voies peuvent être suivies, selon que le composant acide est solide ou liquide.
- Si un solide se forme lors de l'acidification du sel ionique, il peut être recueilli par filtration par aspiration. Cette méthode ne doit être utilisée que si de grandes quantités de cristaux de grande taille sont observées. Si de fins cristaux se forment (ce qui est assez fréquent), ils boucheront le papier filtre et empêcheront un drainage adéquat. Si l'on n'observe qu'une petite quantité de solide par rapport à la quantité théorique, il est probable que le composé soit très soluble dans l'eau et que la filtration ne permette qu'une faible récupération.
- Si aucun solide ne se forme lors de l'acidification (ou si de fins cristaux ou une faible quantité de solide se forment), extraire à nouveau le composant acide dans un solvant organique (×3). En règle générale, utiliser un tiers de solvant pour les extractions par rapport à la couche d'origine (par exemple, si l'on utilise une solution aqueuse de 100 ml, extraire avec 33 ml de solvant organique à chaque fois). Veillez à refroidir la solution aqueuse dans un bain de glace avant l'extraction si l'acidification a créé une chaleur notable. Procéder ensuite à un lavage à la saumure (×1) si l'on utilise de l'éther diéthylique ou de l'acétate d'éthyle, sécher avec un agent de séchage et éliminer le solvant par évaporateur rotatif pour laisser le composant acide pur.
2. Isolement du composant basique :
Procéder de la même manière que pour l'isolement du composant acide, mais en basifiant la solution à l'aide de NaOH(aq) 2M jusqu'à ce qu'elle atteigne un pH de 9-10, déterminé à l'aide d'un papier pH.
3. Isolation du composant neutre :
Le composant neutre sera le composé "restant" dans la couche organique. Pour l'isoler, laver avec de la saumure (×1) si l'on utilise de l'éther diéthylique ou de l'acétate d'éthyle, sécher avec un agent desséchant et éliminer le solvant à l'aide d'un évaporateur rotatif pour laisser le composant neutre pur.
Procéder de la même manière que pour l'isolement du composant acide, mais en basifiant la solution à l'aide de NaOH(aq) 2M jusqu'à ce qu'elle atteigne un pH de 9-10, déterminé à l'aide d'un papier pH.
3. Isolation du composant neutre :
Le composant neutre sera le composé "restant" dans la couche organique. Pour l'isoler, laver avec de la saumure (×1) si l'on utilise de l'éther diéthylique ou de l'acétate d'éthyle, sécher avec un agent desséchant et éliminer le solvant à l'aide d'un évaporateur rotatif pour laisser le composant neutre pur.
Conclusion.
Les méthodes d'extraction sont utilisées pour extraire certaines substances d'un mélange. Ces substances peuvent être des bases, des acides ou des neutres (polaires ou non polaires). Par exemple, cette méthode est utilisée lors de la production d'amphétamine à l'étape de la décantation : recueillir la couche supérieure contenant la base d'amphétamine dans l'alcool. Elle peut être légèrement séchée avec du sulfate de magnésium anhydre, et les scories peuvent être en outre extraites avec un solvant non polaire (éther, benzène, toluène), le solvant étant ensuite évaporé. La production de méphédrone comprend la manipulation avec une ampoule à décanter et l'extraction. L'extraction acide-base est également utilisée pour purifier certaines substances psychoactives de leurs impuretés.
Attachments
Last edited: