Brain
Expert Pharmacologist
- Joined
- Jul 6, 2021
- Messages
- 240
- Reaction score
- 270
- Points
- 63
Lapsilocybine (3-[2-(Dimethylamino)ethyl]-1H-indol-4-yl dihydrogen phosphate) est un alcaloïde de la famille des tryptamines, dérivé phosphorylé de la psilocine, qui possède des propriétés psychédéliques. Parmi toutes les sources biologiques de psilocybine, les espèces de champignons des genres Psilocybe, Panaeolus, Stropharia, Gymnopilus, Inocybe en contiennent la plus grande quantité ; cependant, environ 200 autres espèces de champignons contiennent de la psilocybine. Une famille de champignons contenant de la psilocybine, connue sous le nom de "champignons magiques", a été utilisée pour ses effets hallucinogènes tout au long de l'histoire. À la fin des années 1950, Albert Hoffman, des laboratoires Sandoz, a isolé et synthétisé des composés psychoactifs, la psilocybine et la psilocine, à partir de champignons contenant de la psilocybine. La psilocybine a été vendue par Sandoz sous le nom d'indocybine pour des essais cliniques psychopharmacologiques et thérapeutiques fondamentaux. Actuellement, des espèces de Psilocybe sont connues en Asie, en Australie, aux États-Unis, au Canada, au Mexique, en Amérique centrale et en Amérique du Sud, en Afrique et en Europe. De nombreux éléments indiquent que les espèces contenant de la psilocybine sont apparues en Afrique et en Europe, et que le Psilocybe était présent dans l'Ancien Monde avant l'apparition de l'homme moderne. Les champignons contenant de la psilocybine peuvent être trouvés dans la nature ou cultivés dans un environnement contrôlé à partir d'empreintes de spores. La popularité de la psilocybine s'est rapidement accrue dans les années 1960. En 1970, la psilocybine a été inscrite à l'annexe I, ce qui a entraîné une réduction significative de la recherche sur la psilocybine. Toutefois, des études préliminaires récentes sur la psilocybine ont montré les perspectives de son application dans le traitement des troubles obsessionnels compulsifs, de la dépendance à l'alcool, des troubles dépressifs majeurs et de la dépression chez les patients atteints d'un cancer en phase terminale. Aux États-Unis, la psilocybine est classée comme une substance de l'annexe I dans le cadre du Controlled Substances Act de 1971 ; par conséquent, seules des quantités limitées peuvent être produites chaque année. En dépit de ce classement, la psilocybine est une drogue récréative populaire depuis les années 1960 et, bien que son usage ait diminué depuis qu'elle est devenue une substance contrôlée, elle continue d'être utilisée à des fins récréatives. La plupart des autres pays développés ont également classé la psilocybine et les champignons contenant de la psilocybine comme illégaux. La principale exception à cette règle générale étant les Pays-Bas, qui disposent d'un vide juridique permettant la culture, la vente et l'ingestion de "truffes" psychoactives contenant de la psilocybine. Les premières preuves d'utilisation par les chamans d'Amérique centrale et d'Amérique du Sud ont été identifiées en de nombreux endroits. L'étude moderne a commencé à la fin des années 1950 avec l'ethnomycologue R. Gordon Wasson et s'est poursuivie avec les célèbres chercheurs psychédéliques Timothy Leary, Ralph Metzner et Ram Dass de l'université de Harvard, Albert Hofmann des laboratoires Sandoz, Terrence McKenna et Jonathan Ott dans les années 1960 et au début des années 1970. L'intérêt des psychiatres et des psychologues pour les psychédéliques s'est manifesté dans les années 1950 en raison de leur capacité à raccourcir la durée des psychothérapies. La recherche sur le traitement psychédélique de la toxicomanie a commencé dès les années 1950. Souvent, les effets observés étaient très intéressants et aidaient à la sobriété, ce qui a incité Humphry Osmond à inventer le terme "psychédélique" pour décrire les capacités de "manifestation de l'esprit" de cette classe de drogues". La plupart des recherches cliniques ont été menées dans les années 1960, souvent en utilisant la version synthétique de l'indocybine.
Synthèse dela pcilocybine
Synthèsede la pcilocine
La psilocybine a été trouvée dans plus de 100 espèces de champignons, dont beaucoup appartiennent au genre Psilocybe. L'alcaloïde psilocybine de la famille Inocybeacede apparaît entre 10 et 20 millions d'années, et il est probable que l'apparition de la psilocybine dans la famille Psilocybe date également de cette époque. Actuellement, des espèces de Psilocybe sont connues en Asie, en Australie, aux États-Unis, au Canada, au Mexique, en Amérique centrale et en Amérique du Sud, en Afrique et en Europe. De nombreux éléments indiquent que les espèces contenant de la psilocybine sont apparues en Afrique et en Europe, et que le Psilocybe était présent dans l'Ancien Monde avant l'apparition de l'homme moderne. Les champignons contenant de la psilocybine peuvent être trouvés dans la nature ou cultivés dans un environnement contrôlé à partir d'empreintes de spores, qui sont créées en plaçant le chapeau d'un champignon connu sur une feuille de papier ciré et en laissant les spores tomber sur le papier, créant ainsi une empreinte unique du champignon. Bien que cette dernière méthode soit beaucoup plus courante et beaucoup plus sûre, certains utilisateurs continuent à chercher des "champignons magiques" dans la nature. Le risque d'erreur d'identification est toujours présent et même les mycologues les plus expérimentés sont susceptibles de commettre une erreur. Une erreur d'identification peut conduire à une erreur que même les mycologues les plus expérimentés sont susceptibles de commettre. Une erreur d'identification peut conduire à une situation allant d'un léger inconfort à la mort. Les mycologues amateurs à la recherche de champignons contenant de la psilocybine et d'un autre type de champignon psychoactif communément appelé "amanite tue-mouches" (Amanita muscaria), qui est l'emblématique chapeau de champignon à points rouges et blancs que l'on voit souvent dans les contes de fées (au lieu de la psilocybine, A. muscaria contient les substances psychoactives que sont le muscimol et l'acide iboténique), meurent le plus souvent de façon brutale. Malheureusement, plusieurs espèces d'Amanita sont mortelles, notamment le bien nommé "chapeau de la mort" (Amanita phalloides) et "l'ange destructeur" (Amanita virosa), qui peut ressembler beaucoup à l'Amanita muscaria et aux espèces apparentées. L'héritage et l'utilisation des "champignons magiques" se retrouvent tout au long de l'histoire et se poursuivent à l'ère moderne. Les premières preuves d'utilisation par les chamans d'Amérique centrale et d'Amérique du Sud ont été identifiées à de nombreux endroits. L'étude moderne a commencé à la fin des années 1950 avec l'ethnomycologue R. Gordon Wasson et s'est poursuivie dans les années 1960 et au début des années 1970 avec les célèbres chercheurs en psychédélisme Timothy Leary, Ralph Metzner et Ram Dass de l'université de Harvard, Albert Hofmann des laboratoires Sandoz, Terrence McKenna et Jonathan Ott. Les psychiatres et les psychologues s'y sont intéressés dans les années 1950 en raison de son potentiel perçu comme un outil permettant de raccourcir les psychothérapies. La recherche sur le traitement psychédélique de la toxicomanie a commencé dès les années 1950. Les effets observés, souvent perspicaces, aidaient à la sobriété, ce qui a incité Humphry Osmond à inventer le terme "psychédélique" pour décrire les capacités de "manifestation de l'esprit" de cette classe de drogues.
La structure de la psilocybine et d'autres hallucinogènes indolealkylamines est similaire à celle de la sérotonine, un neurotransmetteur endogène, de la mélatonine, une hormone, et de la N, N-diméthyltryptamine, un psychédélique endogène supposé. Ils dérivent tous du même composé, la tryptamine. La psilocybine (O-phosphoryl-4-hydroxy-N, N-diméthyltryptamine) et son métabolite actif déphosphorylé, la psilocine (N, N-diméthyltryptamine), appartiennent structurellement au groupe des hallucinogènes tryptamine/indolamine et sont structurellement liés à la sérotonine. Une dose équimolaire de 1 mole de psilocine est de 1,4 mole de psilocybine. La substitution du noyau indole en position 4 joue probablement un rôle important dans ses effets hallucinogènes. La psilocybine et la psilocine sous leur forme pure sont des poudres cristallines blanches. Alors que la psilocybine est soluble dans l'eau, la psilocine est plus soluble dans les lipides. Cependant, la psilocine peut également être diluée dans une solution aqueuse acidifiée et dans le diméthylsulfoxyde (DMSO ; jusqu'à 100 mM). En outre, les deux substances sont solubles dans le méthanol et l'éthanol, mais presque insolubles dans l'éther de pétrole et le chloroforme. Les deux drogues sont instables à la lumière (en particulier sous forme de solutions), mais leur stabilité à basse température dans l'obscurité et sous atmosphère inerte est très bonne. La psilocybine est un composé thermolabile, soluble dans l'eau, le méthanol, l'éthanol, mais insoluble dans les solvants organiques. Son activité propre est extrêmement faible ; elle agit principalement en tant que promédicament de la psilocine. Les valeurs du pKa varient de 1,3 à 6,5. Exposée à la lumière ultraviolette, sa stabilité en solution est perturbée, ce qui provoque une oxydation. Soluble dans 120 parties de méthanol bouillant ; difficilement soluble dans l'éthanol ; pratiquement insoluble dans le chloroforme, le benzène, pression de vapeur - 1,9X10-12 mm Hg à 25 °C. Le poids moléculaire est de 285,25 ; elle a un goût ammoniacal, un point de fusion de 224 degrés Celsius, un pH de 5,2 dans 50 % d'eau et d'éthanol, une DLC de 75 mkg/kg lorsqu'elle est administrée par voie intramusculaire chez l'homme, une DLC de 60 mkg/kg lorsqu'elle est administrée par voie orale chez l'homme, une DL50 de 280 mg/kg lorsqu'elle est administrée par voie intraveineuse chez les rats. La psilocybine est considérée comme pénétrant difficilement la barrière hémato-encéphalique, par rapport à la psilocine. Cela est dû à la différence de liaisons hydrogène, qui rend cette dernière plus lypophile, ce qui facilite le passage de la barrière hémato-encéphalique. À l'examen visuel, on peut distinguer la psilocybine purifiée de la psilocine. L'une a l'apparence d'un cristal blanc ou presque blanc, l'autre forme une couleur huileuse allant du brun foncé au noir.
Statut juridique.
Le gouvernement a interdit la possession de psilocybine et de psilocine en 1968. En 1970, la psilocybine et la psilocine ont été inscrites sur la liste des drogues de l'annexe I. Aux États-Unis, Denver, Oakland, Chicago, Ann Arbor et Santa Cruz ont dépénalisé la possession de champignons magiques, mais la vente de champignons reste interdite. En 2020, l'Oregon a légalisé la psilocybine et le district de Columbia a dépénalisé l'usage des champignons magiques. La vente et le transport de psilocybine depuis l'Autriche sont illégaux. La possession a été décriminalisée et la culture est légale tant que les champignons ne sont pas destinés à la consommation. Les personnes prises en possession de champignons destinés à un usage personnel peuvent être obligées de suivre une thérapie gratuite. Au Portugal, les champignons à psilocybine sont illégaux mais décriminalisés. Les personnes prises en possession de quantités destinées à un usage personnel peuvent être obligées de suivre une rééducation ou une thérapie. Aux Pays-Bas, les champignons à psilocybine sont légaux sous forme de truffes. Conformément à la politique des Nations unies, la psilocybine est illégale en Italie, mais les champignons psilocybes sont décriminalisés. La vente et l'obtention de kits de culture et de spores sont légales, mais des sanctions administratives telles que la perte du permis de conduire peuvent être infligées aux personnes qui se font prendre en possession de champignons. L'Espagne a dépénalisé la possession personnelle et la consommation de champignons à psilocybine, mais la psilocybine elle-même reste illégale. La culture et la vente sont illégales, et la légalité des spores et des kits de culture reste vague. Les îles Vierges britanniques autorisent la possession et la culture de champignons à psilocybine. Il est toutefois illégal (mais non appliqué) de les vendre ou de les transporter. La possession, la vente, le transport et la culture de champignons à psilocybine sont tous légaux en Jamaïque. La Jamaïque vend ouvertement des champignons à psilocybine. La possession, la vente, le transport et la culture de champignons magiques sont légaux au Brésil. La psilocybine et la psilocine sont considérées comme illégales, mais les champignons eux-mêmes ne le sont pas. La possession de champignons magiques est illégale au Mexique, bien qu'il n'y ait pas d'application de la loi si les champignons magiques proviennent de cultures indigènes. La culture de champignons est illégale, sauf si les champignons sont cultivés à l'état sauvage. La vente et le transport sont illégaux. Les champignons magiques sont légaux à Samoa. Depuis 2018, ils sont illégaux au Viêt Nam.
Actuellement classés comme substance de l'annexe I, les chercheurs de l'université Johns Hopkins affirment que les champignons à psilocybine devraient être rétrogradés de l'annexe I à l'annexe IV. En 2019, la ville d'Oakland, en Californie, a voté en faveur de la dépénalisation des champignons magiques, un mois seulement après que Denver, dans le Colorado, a décidé de faire de même. La Californie fait pression pour décriminaliser les champignons psilocybines à l'échelle de l'État, de nombreux groupes de sensibilisation et de défense des psychédéliques soutenant ce changement. En outre, le corps législatif de l'Oregon envisage d'adopter un projet de loi visant à dépénaliser les champignons à psilocybine et à délivrer des licences de culture. Une grande partie de ces recherches prometteuses sont menées par la Multidisciplinary Association of Psychedelic Studies (MAPS), qui effectue actuellement des recherches médicales sur la MDMA, la psilocybine, le LSD, la marijuana, l'ibogaïne et l'ayahuasca. Une autre organisation, le Heffter Research Institute, est spécialisée dans la recherche sur la psilocybine. Parmi les membres du conseil d'administration de l'Institut de recherche Heffter, on trouve le cofondateur, le Dr David Nichols, chercheur, professeur et expert en chimie des hallucinogènes, dont la réputation n'est plus à faire. Dennis McKenna, écrivain estimé, ethnopharmacologue, psychonaute et frère du regretté Terrence McKenna, et le Dr Roland Griffiths, qui mène des recherches phénoménales à Johns Hopkins sur la psilocybine et la toxicomanie, comptent parmi les autres chercheurs. Plusieurs études sur la psilocybine sont également en cours au niveau international. La Beckley Foundation, basée au Royaume-Uni, finance certaines des recherches les plus progressives sur la psilocybine aujourd'hui. Fondée en 1996 par Amanda Fielding, elle-même psychonaute et scientifique de renom, la Beckley Foundation finance actuellement des recherches sur les neurosciences de la psilocybine, en collaboration avec MAPS et Heffter. Ces recherches se déroulent à l'Imperial College de Londres avec le Dr David Nutt et le Dr Robin Carhart-Harris, qui ont tous deux publié des recherches sur la psilocybine dans le passé, notamment le "Entropic Brain Model". Heffter finance également une étude en Suisse intitulée "Psilocybin Effects on Attention, Perception, and Cognition" (Effets de la psilocybine sur l'attention, la perception et la cognition). De même, MAPS finance une étude intitulée "Experimental Studies on the Effects of Psilocybin on Binocular Depth Inversion, Binocular Rivalry" (études expérimentales sur les effets de la psilocybine sur l'inversion de la profondeur binoculaire et la rivalité binoculaire) en Allemagne.
Pharmacocinétique et pharmacodynamie.
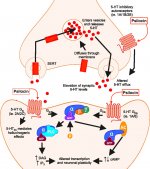
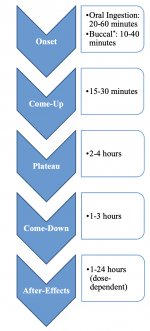
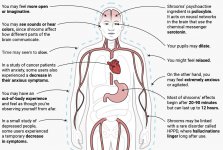
Lorsqu'elle est ingérée, la psilocybine subit une biotransformation dans le foie, où elle est déphosphorylée en psilocine par une enzyme inconnue. Après avoir pénétré dans le flux sanguin systémique, la psilocine pénètre dans le cerveau, où elle exerce un effet psychoactif. Selon d'autres données, après administration orale, la psilocybine est rapidement déphosphorylée dans l'environnement acide de l'estomac ou sous l'action de la phosphatase alcaline (et d'autres estérases non spécifiques) dans l'intestin, les reins et éventuellement dans le sang, avec formation d'un composé phénolique, la psilocine, qui peut facilement passer la barrière hémato-encéphalique. Il convient de noter que la puissance relative de la psilocine par rapport à la psilocybine est presque identique au rapport du poids moléculaire de ces composés. Le blocage de la phosphotase alcaline par des substrats compétitifs de β-glycérophosphate atténue les symptômes d'intoxication. La psilocine subit les deux phases du métabolisme. La première phase du métabolisme comprend la désamination oxydative de la psilocine en 4-hydroxy-indole-3-acétaldéhyde, catalysée par la monoamine oxydase ou l'aldéhyde déshydrogénase du foie, et l'oxydation consécutive en acide 4-hydroxy-indole-3-acétique, 4-hydroxy-indole-3-acétaldéhyde et 4-hydroxytryptophole. Les enzymes qui participent à ce processus n'ont pas encore été identifiées. C'est pourquoi les inhibiteurs de la MAO peuvent renforcer les effets hallucinogènes de la psilocybine, tout comme l'éthanol peut renforcer le trip, car son métabolite primaire, l'acétaldéhyde, réagit in vivo avec les amines endogènes, ce qui entraîne la formation de tétrahydroisoquinolines et de β-carbolines, qui sont des inhibiteurs de la MAO. Comme la psilocybine induit une inhibition compétitive de la MAO (qui métabolise la sérotonine), le niveau de sérotonine dans le cerveau augmente et la concentration de 5-HIAA diminue simultanément. En outre, la voie métabolique est insignifiante en termes d'effets cliniques. Elle implique une oxydation qui aboutit à la formation d'un produit bleu foncé, dont la structure est celle de l'o-quinone ou de l'iminoquinone. Cette voie est catalysée par les hydroxyindol oxydases (céruloplasmine, l'oxydase du plasma des mammifères contenant du cuivre, et cytochrome oxydase). Les métabolites ci-dessus ont une activité physiologique insignifiante. Lorsque la psilocybine est administrée par voie parentérale, les phosphatases tissulaires jouent le même rôle, et celles des reins sont parmi les plus actives. Si l'on considère que le blocage compétitif de la déphosphorylation bloque l'action psychotrope de la psilocybine, il est clair que la psilocine est le principal métabolite actif de la psilocybine. Dans les 5 heures suivant l'administration orale de psilocybine, jusqu'à 80 % de la psilocine est présente dans le sang sous forme de O-glucuronide conjugué et est excrétée dans l'urine sous forme inchangée. La glucuronidation du groupe hydroxyle en O-glucuronide de psilocine est une étape importante de la détoxification, c'est pourquoi l'hydrolyse enzymatique augmente le temps de détection dans les échantillons d'urine. Alors que la psilocine subit une glucoronidation importante par les UDP-glucuronosyltransférases (UGT)1A10 dans l'intestin grêle, l'UGT1A9 contribue principalement à la glucoronidation après son absorption dans le sang. Dans ce cas, la N-glucuronidation ne se produit pas tout au long du métabolisme. Outre la voie mentionnée ci-dessus, la psilocine elle-même subit également un métabolisme oxydatif. La déméthylation et la désamination du 4-hydroxyindol-3-yl-acétaldéhyde (4-HIA), suivies d'une oxydation (probablement par l'aldéhyde déshydrogénase hépatique et la monoamine oxydase), aboutissent à la formation d'acide 4-hydroxyindol-3-acétique (4-HIAA) et de 4-hydroxytryptofol (4-HT). Ces métabolites insignifiants (environ 4 % se désintègrent de la manière décrite ci-dessus) peuvent être détectés dans le plasma sanguin humain. La troisième voie de métabolisation de la psilocine implique l'oxydation par les hydroxyindol oxydases, comme indiqué ci-dessus. La psilocine est distribuée dans tous les tissus, y compris le cerveau, et est éliminée dans les 24 heures. La plus grande partie est éliminée dans les 8 premières heures (environ 65% dans l'urine et 15-20% dans la bile et les fèces). La psilocine peut être détectée dans l'urine pendant 2 semaines. Les concentrations les plus élevées de psilocine se trouvent dans le néocortex, l'hippocampe, le système moteur extrapyramidal et la formation réticulaire. Chez l'homme, la psilocybine et la psilocine peuvent être détectées dans le plasma sanguin 20 à 40 minutes après l'administration orale. Les concentrations maximales sont atteintes en 80-100 minutes et peuvent être détectées dans les six heures. La demi-vie de la psilocine dans le plasma sanguin est d'environ 2/5 heures après l'administration orale, et de 1,23 heures après l'administration parentérale. Comme cela a déjà été mentionné, environ 80 % de la psilocine dans le plasma est sous forme conjuguée. La psilocine (90-97%) et la psilocybine (3-10%) peuvent être détectées dans l'urine sous forme inchangée ou conjuguée à l'acide glucoronique. La demi-vie d'élimination est d'environ 50 minutes, la constante d'élimination est de 0,307/h. La majeure partie de la substance est éliminée dans les trois premières heures suivant l'administration orale et est complètement excrétée dans l'urine dans les 24 heures. La voie métabolique complète de la psilocybine a été très peu étudiée et de nombreuses informations doivent encore être recueillies pour déterminer les mécanismes exacts impliqués dans son métabolisme.
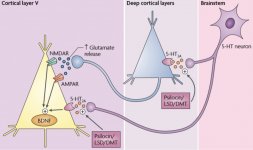
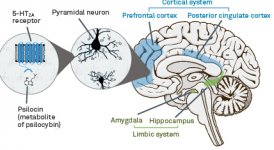
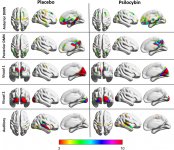
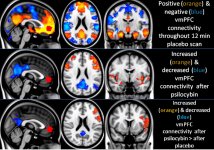
La pharmacologie de la psilocybine est très complexe et n'a pas été suffisamment étudiée. La psilocybine peut vraisemblablement avoir une activité propre insignifiante, mais elle agit surtout comme un promédicament de la psilocine. Cette dernière traverse facilement la barrière hémato-encéphalique et y exerce son effet psychoactif. Les principaux sites de liaison sont résumés dans le tableau ci-dessus. La psilocine se lie le plus fortement aux récepteurs de la sérotonine : 5-HT1D, 2B, 2C, 5, 6, 7), elle a également un potentiel de liaison modéré avec les récepteurs de la sérotonine (5-HT1A, 1B, 2A). Outre les récepteurs sérotoninergiques, la psilocine présente une certaine affinité pour les récepteurs histaminiques du premier type (H1), les récepteurs alpha-2A et -2B, et les récepteurs dopaminergiques du troisième type (D3). Dans les neurones exprimant le récepteur 5HT2A, mais pas dans les knockouts 5HT2A, la psilocybine augmente l'expression des gènes précoces (erg-1, erg-2, c-fos, jun-B, period-1, gpcr-26, fra-1, N- 10, I-κBα) et réduit l'expression de la sty-kinase. Il va sans dire que la voie de signalisation précise menant du récepteur à l'activation des gènes précoces n'est pas encore connue. Étant donné qu'un lisuride non hallucinogène active également le c-fos, il est probable que l'expression du c-fos ne reflète qu'une activité neuronale accrue, tandis que l'expression d'egr-1/ egr-2 est spécifique de l'effet hallucinogène. Gonzales-Meaeso a expliqué cette sélectivité par la "théorie du trafic agoniste de la signalisation des récepteurs", selon laquelle les hallucinogènes activent l'hétérocomplexe récepteur 5HT2A/mGlu2 et différentes protéines G par rapport aux agonistes 5-HT2A non halucinogènes. Cette hypothèse est étayée par une étude dans laquelle des souris dont le gène du récepteur mGlu2 est désactivé ne présentent aucun comportement de contraction de la tête. Il a été prouvé que la psilociline inhibe le transporteur de sérotonine dépendant du sodium (SERT), ce qui entraîne une augmentation de la concentration de sérotonine. La sérotonine reste dans la fente synaptique après sa libération, ce qui conduit finalement à une activation répétée des neurones postganglionnaires sérotoninergiques. Quant à l'évaluation de l'affinité de liaison aux récepteurs, ils sont classés comme suit : 5HT2B > 5HT1D > D1 > 5HT1E > 5HT1A > 5HT5A > 5HT7 > 5HT6 > D3 > 5HT2C > 5HT1B > 5HT2A. La liaison aux récepteurs imidazolines du premier type a également été prouvée. Il est intéressant de noter que l'affinité de la psilocybine pour les récepteurs 5-НТ2А humains est 15 fois supérieure à celle des rats. L'agonisme des récepteurs 5-НТ2А et l'activation d'un nombre excessif de ces récepteurs et sous-types de récepteurs sont responsables des effets psychédéliques uniques et intenses provoqués par la psilocybine. Auparavant, de nombreuses discussions ont eu lieu pour savoir si les récepteurs 5-НТ2А ou 5-НТ2С étaient responsables d'hallucinations isolées après l'ingestion de champignons contenant de la psilocybine. Les études ont montré que les antagonistes des récepteurs 5-НТ2А suppriment les hallucinations, tandis que les antagonistes des récepteurs 5-НТ2С ne potentialisent pas les hallucinations et n'ont pas d'effet de nivellement sur elles. Ainsi, l'agonisme des récepteurs 5-НТ2А est associé à une excitation générale des neurones, à une amélioration de la mémoire et de l'apprentissage, à des contractions des tissus musculaires lisses vasculaires, du tractus gastro-intestinal et des bronches, à une certaine activité anti-inflammatoire, à une augmentation de la production de prolactine et d'ocytocine, d'hormone adrénocorticotrope et de rénine lors de l'activation du système rénine-angiotensine-aldostérone. L'activation de la 5-НТ2С par la psilocine entraîne l'activation de la proopiomélanocortine (précurseur des α-, β- et γ-melanocyte stimulating hormone et de l'hormone adrénocorticotrope) et la libération de cortisol. Ces hormones augmentent l'appétit, la sensibilité à l'insuline, le métabolisme du glucose et stabilisent les stimuli anxiogènes et stressants. La psilocine agit comme un agoniste partiel des récepteurs 5-НТ1А, qui sont principalement exprimés dans le noyau du raphé (DRN) et le noyau médian du raphé (MRN), situés près de la ligne médiane du tronc cérébral, tout au long de son extension rostro-caudale, en tant qu'autorécepteurs somatodendritiques. Le MRN favorise l'activation des processus de consolidation de la mémoire et se projette vers l'hippocampe, tandis que le VRN est l'un des plus grands noyaux sérotoninergiques du cerveau humain, qui fournit une quantité importante d'innervation sérotoninergique du cerveau antérieur ; en outre, le MRN a des fibres de projection dans l'amygdale et l'hypothalamus, ce qui est associé à la régulation du rythme circadien et de plusieurs types de cellules qui produisent des catécholamines et de la substance P. Le DRN et le MRN sont riches en récepteurs présynaptiques 5-НТ1А, et la psilocine a un effet plusieurs fois (5-6 fois) plus important sur ses sites présynaptiques que sur ses sites postsynaptiques. Cette préférence s'explique par la forte densité de récepteurs 5-НТ1А situés dans ces zones. Ce type de récepteurs, situé sur les corps des cellules sérotoninergiques de la zone du raphé, ne se trouve pas, par exemple, sur les membranes postsynaptiques. Des études par IRMf ont révélé que la psilocybine diminue de manière significative le flux sanguin et l'oxygénation veineuse dans le cerveau. Ce fait est en corrélation avec son effet subjectif et réduit de manière significative la connexion positive entre deux nœuds structurels clés (mPFC и PCC). Il est prouvé que la psilocybine augmente le métabolisme du glucose dans le cerveau. En outre, certaines expériences ont montré que le DMN est également crucial pour maintenir l'intégration cognitive et les limitations dans des conditions normales. Lorsque la psilocine se lie aux récepteurs présynaptiques 5-НТ1А de la zone DRN, elle supprime les effets de cette zone, tandis que les cellules sous-jacentes restent intactes et renforcent l'activité sympathique associée au locus coeruleus. D'autres localisations des récepteurs 5-НТ2А montrent une diminution rapide de l'activité de ces récepteurs et une diminution de leur densité lors de l'activation par la psilocine. La psilocybine ne tolère donc pas l'action inhibitrice du DRN. Il est important de noter que les agonistes sélectifs des récepteurs 5-НТ1а ne sont pas hallucinogènes à la base, mais qu'ils jouent un rôle dans l'influence des effets inhibiteurs identifiés dans le DRN.
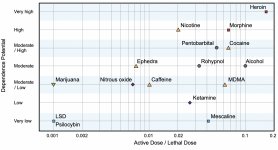
Bien que les récepteurs dopaminergiques du deuxième type jouent un rôle important dans les hallucinations qui se forment dans diverses maladies mentales, on suppose qu'ils n'ont pas de relation active et indirecte avec l'action de la psilocine. Cette hypothèse a été prouvée pour la première fois par Vollenweider et al. lorsqu'ils ont constaté que l'administration de galopéridol (agoniste du D2R) n'affaiblissait pas les effets psychoactifs de la psilocine. Même si les effets dopaminergiques de la psilocine sont considérés comme minimes, elle a une capacité de liaison relativement élevée au récepteur D3, par rapport à d'autres sous-types de récepteurs dopaminergiques. Bien que les effets médiés par le D3R aient été peu étudiés, ils contribuent probablement aux propriétés psychoactives caractéristiques de la psilocybine et à sa capacité à provoquer une dépendance. Le précurseur chimique de la psilocine, la 4-acétoxy-N,N-diméthyltryptamine, a le groupe phosphoryloxy remplacé par un groupe acétoxy. Il est métabolisé de la même manière que le groupe phosphoryloxy, et cette modification permet de contourner certains processus métaboliques de la première phase. Bien que la psilacétine soit une substitution pharmacologique identique à la psilocybine, de nombreux utilisateurs signalent qu'elle présente des différences insignifiantes mais perceptibles. La psilacétine est souvent décrite comme une substance dont l'action est plus rapide, qui n'entraîne pas d'anxiété ni de nausées (qui sont associées à l'utilisation de la psilocybine en raison de l'absence de chitine, généralement contenue dans les champignons) et dont la durée est plus courte. Il est bien connu que la dose létale médiane chez les rats est d'environ 293 mg/kg, ce qui indique une énorme fenêtre thérapeutique pour la psilocine. La tachyphylaxie, c'est-à-dire la désensibilisation rapide à une substance, qui entraîne une diminution de l'effet physiologique, est un phénomène associé à l'utilisation de nombreux hallucinogènes. La tolérance à la psilocybine commence à se développer dès la première utilisation. Le mécanisme implique une réponse physiologique à une stimulation excessive des récepteurs 5-НТ2А par une réduction rapide des sites récepteurs et une diminution de la densité des récepteurs sur la cellule. En général, on estime que ces sites récepteurs reviennent à cinquante pour cent de leur niveau initial dans les 3 à 7 jours suivant l'utilisation initiale. Ils reviennent à leur niveau d'origine en 4 semaines, en fonction de la dose et de la durée de l'utilisation répétée. En outre, il existe une tolérance croisée entre les classes d'hallucinogènes indolealkylamine et phénylalkylamine.
Attachments
-
 aDjgnEic18.jpg572.2 KB · Views: 1,537
aDjgnEic18.jpg572.2 KB · Views: 1,537 -
 sRHGpjI9LU.jpg788.9 KB · Views: 1,506
sRHGpjI9LU.jpg788.9 KB · Views: 1,506 -
 TQv018fRJh.jpg128.6 KB · Views: 908
TQv018fRJh.jpg128.6 KB · Views: 908 -
lF1rOfpW8k.jpg2.6 MB · Views: 928
-
 TSkYz5Gq6P.jpg363.8 KB · Views: 1,659
TSkYz5Gq6P.jpg363.8 KB · Views: 1,659 -
 sPlo2QDBMe.jpg551.6 KB · Views: 1,634
sPlo2QDBMe.jpg551.6 KB · Views: 1,634 -
 AxRV2Hfutv.jpg697.8 KB · Views: 1,656
AxRV2Hfutv.jpg697.8 KB · Views: 1,656 -
 b2Ma0wsVTD.jpg607.2 KB · Views: 1,719
b2Ma0wsVTD.jpg607.2 KB · Views: 1,719 -
 QtXjIHo7PJ.jpg438.5 KB · Views: 1,525
QtXjIHo7PJ.jpg438.5 KB · Views: 1,525 -
 rI0YMKgE6z.jpg1.1 MB · Views: 1,666
rI0YMKgE6z.jpg1.1 MB · Views: 1,666 -
 Q1ueUSGlFN.jpg614.4 KB · Views: 1,665
Q1ueUSGlFN.jpg614.4 KB · Views: 1,665
Last edited by a moderator:
