A mefedron (4-metil-metkatinon) egy β-ketoamfetamin stimuláns visszaélés kábítószere, amely szoros szerkezeti és mechanikai hasonlóságot mutat a metamfetaminnal. A mefedronhoz kapcsolódó egyik legerősebb hatás az a képesség, hogy a dopamin (DA) felszabadulását serkenti, és a dopamin-transzporterrel (DAT) való kölcsönhatása révén blokkolja annak visszavételét. Bár a mefedron nem okoz toxicitást a DA idegvégződéseken, DAT-blokkoló képességével védelmet nyújthat a metamfetamin okozta neurotoxicitással szemben, mint más DAT-gátlók. Ennek a lehetőségnek a tesztelésére egereket kezeltek mefedronnal (10, 20 vagy 40 mg/kg) a metamfetamin neurotoxikus injekciói előtt (4 db 2,5 vagy 5,0 mg/kg injekció 2 órás időközönként). A striatum DA idegvégződéseinek integritását a DA, DAT és tirozin-hidroxiláz szintek mérésével értékelték. A metamfetamin különböző dózisaihoz társuló mérsékelt vagy súlyos DA-toxicitást a mefedron egyik dózisa sem akadályozta meg, sőt, jelentősen fokozta. A mefedronnal és metamfetaminnal történő kombinált kezelés által okozott hipertermia ugyanolyan mértékű volt, mint bármelyik hatóanyag önmagában történő alkalmazása után. A mefedron az amfetamin és az MDMA DA idegvégződésekre gyakorolt neurotoxikus hatását is fokozta. Ezzel szemben a nomifenzin védett a metamfetamin által kiváltott neurotoxicitással szemben. Mivel a mefedron növeli a metamfetamin neurotoxicitását, a jelen eredmények arra utalnak, hogy a DAT-tal más tipikus DAT-gátlókkal ellentétes módon lép kölcsönhatásba. A mefedron önmagában a DA idegvégződésekre gyakorolt viszonylag ártalmatlan hatásai elfedik a vele gyakran együtt használt gyógyszerekkel való potenciálisan veszélyes kölcsönhatást, ami fokozott neurotoxicitáshoz vezet.
A mefedron (4-metilmetilkatinon) egy katinonszármazék és a metamfetamin és a 3,4-metiléndioxi-metamfetamin (MDMA) szerkezeti analógja. A mefedron a "fürdősók" egyik pszichoaktív összetevője olyan más vegyületekkel együtt, mint a metilon, butilon és a 3,4-metiléndioxipyrovaleron (MDPV). A β-ketoamfetaminokkal egyre nagyobb arányban élnek vissza, ami nem kis részben annak köszönhető, hogy a titkos laboratóriumokban a metamfetamin és MDMA szintéziséhez szükséges prekurzorok nagyon korlátozottan állnak rendelkezésre, és ennek megfelelően a tisztaságuk is csökken (Winstock et al. 2011b, Brunt et al. 2011). A β-ketoamfetaminokkal való visszaélés folyamatos növekedésével a káros hatások listája egyre bővül, és a kardiovaszkuláris szövődmények, az izgatottság, az álmatlanság, a pszichózis és a depresszió is felkerült rá (Schifano et al. 2011, Prosser and Nelson 2012).
A metamfetamin és az MDMA kémiai rokonaként nem meglepő, hogy a β-ketoamfetaminok számos olyan hatással rendelkeznek a központi idegrendszerre, mint ezek az előbbi kábítószerek. Ezek a szerek például blokkolják a dopamin (DA) és a szerotonin (5-HT) transzportereket (DAT, illetve SERT) (Cozzi és mtsai. 1999, Rothman és mtsai. 2003, Fleckenstein és mtsai. 2000, Lopez-Arnau és mtsai. 2012), és in vitro (Kalix és Glennon 1986, Gygi és mtsai. 1997, Rothman és mtsai. 2003) és in vivo (Gygi és mtsai. 1997, Kehr és mtsai. 2011) stimulálják a monoamin felszabadulást. A metkatinon tartósan csökkenti a triptofán-hidroxiláz és a tirozin-hidroxiláz (TH) aktivitását, valamint a DA és az 5-HT kiürülését (Gygi és mtsai. 1997, Gygi és mtsai. 1996, Sparago és mtsai. 1996). Az absztinens metkatinon-használókon végzett PET-képalkotó vizsgálatok a DA-terminálisok elvesztésére utaló csökkent striatális DAT-sűrűséget mutattak ki (McCann és mtsai. 1998). A DA felszabadulásának egyidejű stimulálása és a felvételének gátlása tükrözi a metamfetaminhoz társuló neurotoxicitás hátterében álló kritikus elemeket (Kuhn et al. 2008, Yamamoto és Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Mi (Angoa-Perez et al. 2012) és mások (Baumann et al. 2012, Hadlock et al. 2011) nemrégiben megvizsgáltuk annak lehetőségét, hogy a mefedron a metamfetaminhoz és az MDMA-hoz hasonlóan neurotoxicitást okozhat. Meglepő módon a mefedron nem volt toxikus a striatum DA idegvégződéseire (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Az a kérdés, hogy a mefedron károsítja-e az 5-HT idegvégződéseket, továbbra is tisztázatlan, mivel egy tanulmány pozitív hatásokat dokumentált (Hadlock et al. 2011), míg egy másik negatív volt (Baumann et al. 2012). A mefedron DA idegvégződésekre gyakorolt viszonylag jóindulatú hatásának fényében és figyelembe véve DAT-blokkoló tulajdonságait, feltételeztük, hogy valójában megvédheti a DA neuronális rendszert a metamfetamin neurotoxikus hatásaitól, ahogyan az más DAT-blokkolókkal, például az amfonsavval (Pu et al. 1994, Schmidt és Gibb 1985, Marek et al. 1990) és a nomifenzinnel (Poth et al. 2012) is ismert. Jelenleg arról számolunk be, hogy a mefedron jelentősen fokozza a metamfetamin neurotoxicitását. Ez a hatás kiterjed az amfetaminra és az MDMA-ra, a mefedronnal gyakran együtt fogyasztott drogokra is (Feyissa és Kelly 2008, Schifano és mtsai. 2011). Ezek a meglepő eredmények új megvilágításba helyezik a mefedron visszaélését, és sürgősen fel kell ismerni e β-ketoamfetamin e finom és veszélyes tulajdonságát.
Anyagok és módszerek
Kábítószerek és reagensek
A mefedron-hidrokloridot és a 3,4-metiléndioximetamfetamint (MDMA) az NIDA Research Resources Drug Supply Programtól szereztük be. (+) A metamfetamin-hidrokloridot, a nomifenszin-maleátot, a d-amfetamin-szulfátot, a pentobarbitált, a DA-t, valamint az összes puffert és HPLC-reagenseket a Sigma-Aldrichtól (St. Louis, MO, USA) vásároltuk. A bicinkoninsav fehérje meghatározó készleteket a Pierce-től (Rockford, IL, USA) szereztük be. A patkány TH elleni poliklonális antitesteket a korábban leírtak szerint állítottuk elő (Kuhn és Billingsley 1987). A patkány DAT elleni monoklonális antitesteket nagylelkűen Dr. Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA) biztosította. A HRP-konjugált anti-IgG másodlagos antitesteket a Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA) biztosította.
Állatok
Nőstény C57BL/6 egereket (Harlan, Indianapolis, IN, USA), amelyek a kísérlet időpontjában 20-25 g súlyúak voltak, ketrecenként 5 egyedet helyeztek el nagy cipősdobozos ketrecekben, világos (12 óra világos/sötét) és hőmérséklet-szabályozott szobában. Nőstény egereket használtunk, mivel ismert, hogy nagyon érzékenyek a neurotoxikus amfetaminok által okozott neuronális károsodásra, és hogy fenntartsuk az összhangot a metamfetamin neurotoxicitásával kapcsolatos korábbi vizsgálatainkkal (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). Az egerek szabadon hozzáférhettek táplálékhoz és vízhez. A Wayne Állami Egyetem Intézményi Gondozási és Felhasználási Bizottsága jóváhagyta az állatok gondozását és a kísérleti eljárásokat. Minden eljárás megfelelt az NIH Guide for the Care and Use of Laboratory Animals (NIH útmutató a laboratóriumi állatok gondozásáról és felhasználásáról) című dokumentumnak is.
Farmakológiai, fiziológiai és viselkedési eljárások
Az egereket mefedronnal kezeltük, egy olyan binge-szerű kezeléssel, amely 4 db 10, 20 vagy 40 mg/kg-os injekcióból állt, az egyes injekciók között 2 órás szünettel. Ez a binge-kezelési séma, amikor helyettesített amfetaminok és katinon-származékok beadására használják, kiterjedt DA idegvégződés-károsodást eredményez. A jelenleg használt mefedron dózisokról korábban kimutatták, hogy nem toxikusak a DA idegvégződésekre (Angoa-Perez és mtsai. 2012). Az egereket metamfetaminnal (4X 2,5 vagy 5 mg/kg), amfetaminnal (4X 5 mg/kg) vagy MDMA-val (4X 20 mg/kg) kezelték önmagában vagy mefedronnal kombinálva. Két gyógyszerrel történő kezelés esetén az egerek 30 perccel a metamfetamin, amfetamin vagy MDMA mind a 4 injekciója előtt kaptak egy-egy mefedron-injekciót. A kontrollok fiziológiás sóoldat injekciókat kaptak ugyanabban az ütemezésben, mint a mefedron önmagában vagy más amfetaminokkal kombinálva. A DAT-gátló metamfetamin-toxicitásra gyakorolt hatásának kontrolljaként az egereket nomifenszinnel (4X 5 mg/kg) kezelték 30 perccel a metamfetamin (4X 5 mg/kg) minden egyes injekciója előtt. Minden injekciót i.p. úton adtak be. Az egereket 2 nappal az utolsó gyógyszeres kezelés után feláldozták, amikor az amfetaminhoz kapcsolódó neurotoxicitás elérte a maximumot. A testhőmérsékletet a Bio Medic Data Systems, Inc. (Seaford, DE, USA) IPTT-300 beültethető hőmérséklet-transzponderével telemetrikusan követtük nyomon. A hőmérsékletet non-invazív módon, 20 percenként rögzítettük, az első METH-injekciót megelőző 60 perctől kezdődően, majd azt követően 9 órán keresztül a Bio Medic DAS-5001 konzolrendszerével.
A striatális DA-tartalom meghatározása
A sztriatális szövetet a kezelést követően kétoldalt kivágtuk az agyból, és -80°C-on tároltuk. A lefagyasztott szöveteket megmértük és 10 térfogat 0,16 N perklórsavban 4°C-on szonikáztuk. Az oldhatatlan fehérjét centrifugálással távolítottuk el, és a DA-t HPLC-vel határoztuk meg elektrokémiai detektálással, a metamfetamin esetében korábban leírtak szerint (Thomas et al. 2010, Thomas et al, 2009).
A TH és DAT fehérjeszintek meghatározása immunoblottinggal
A gyógyszeres kezelések hatását a striatális TH és DAT szintekre immunoblottinggal határoztuk meg a striatális DA idegvégződésekre gyakorolt toxicitás indexeként. Az egereket a kezelést követően lefejezéssel feláldoztuk, és a striatumot kétoldalt felboncoltuk. A szöveteket -80°C-on tároltuk. A lefagyasztott szövetet 1%-os SDS-ben 95°C-on történő szonikációval bontottuk fel, és az oldhatatlan anyagot centrifugálással ülepítettük. A fehérjéket bicinchoninsav-módszerrel határoztuk meg, és azonos mennyiségű fehérjét (70 μg/sáv) SDS-poliakrilamid gélelektroforézissel oldottunk fel, majd nitrocellulózra elektroblottoltunk. A blotokat Tween 20 (0,1% v/v) és 5% zsírmentes száraz tej tartalmú Tris pufferelt sóoldatban blokkoltuk 1 órán keresztül szobahőmérsékleten. A blotokhoz TH (1:1000) vagy DAT (1:1000) elleni primer antitesteket adtunk, és 16 órán át hagytuk inkubálni 4°C-on. A blotokat 3X mostuk Tris-pufferelt sóoldattal a nem reagált antitestek eltávolítása érdekében, majd HRP-konjugált anti-IgG másodlagos antitesttel (1:4000) inkubáltuk 1 órán keresztül szobahőmérsékleten. Az immunreaktív sávokat megerősített kemilumineszcenciával vizualizáltuk, és a TH- és DAT-reaktív sávok relatív sűrűségét Kodak Image Station (Carestream Molecular Systems, Rochester, NY, USA) segítségével képalkotással határoztuk meg, és az ImageJ szoftver (NIH) segítségével számszerűsítettük.
Az adatok elemzése
A metamfetamin versus mefedron DA-ra, DAT-ra és TH-ra gyakorolt dózishatásainak elemzésére kétutas ANOVA-t végeztünk. A drogkezelések hatását a striatális DA, TH és DAT tartalomra egyirányú ANOVA-val vizsgáltuk szignifikancia szempontjából, amelyet Tukey többszörös összehasonlító teszt követett. A drogkezeléseknek a testmaghőmérsékletre az idő múlásával kapcsolatos eredményeit kétirányú ANOVA-val elemeztük, amelyet Bonferroni-teszt követett, hogy meghatározzuk a hőmérsékletben az egyes kezelések utáni időpontokban mutatkozó különbségek szignifikanciáját. A különbségeket akkor tekintettük szignifikánsnak, ha p < 0,05. Az összes statisztikai elemzést a GraphPad Prism 5.02 verziója segítségével végeztük el Windowsra (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Folytassa a következő címmel: (1) A következő címre kattintva:
Eredmények
A mefedron hatása a metamfetamin által kiváltott neurotoxicitásra
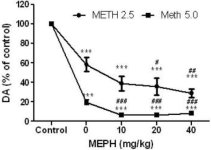
A mefedront, olyan dózisokban (10, 20 vagy 40 mg/kg), amelyekről ismert, hogy nem okoznak DA idegvégződés-toxicitást (Angoa-Perez et al. 2012), 30 perccel a metamfetamin minden egyes injekciója előtt adtuk be. A metamfetamint olyan dózisokban adtuk be, amelyek mérsékelt (4X 2,5 mg/kg) vagy súlyos (4X 5 mg/kg) károsodást okoznak a striatum DA idegvégződéseiben (Thomas és mtsai. 2004, Thomas és mtsai. 2010). Az 1. ábrán bemutatott eredmények azt mutatják, hogy a metamfetamin dózis (F1,40 = 66,60, p < 0,0001) és a mefedron dózis (F4,40 = 131,3, p < 0,0001) fő hatása a striatum DA-szintjére a kétirányú ANOVA segítségével rendkívül szignifikáns volt. A 2,5 mg/kg (F4,22 = 35,96, p < 0,001) vagy 5,0 mg/kg metamfetaminnal (F4,17 = 953,9, p < 0,0001) kombinációban adott mefedron fő hatása egyirányú ANOVA-val szintén nagyon szignifikáns volt. A metamfetamin ± mefedron bármelyik dózisával végzett valamennyi kezelés szignifikánsan nagyobb DA-csökkenést okozott a megfelelő kontrollhoz képest (p < 0,0001 mindegyiknél). Az 1. ábra azt is mutatja, hogy a 20 (p < 0,01) és 40 mg/kg (p < 0,001) mefedron dózisok szignifikánsan fokozták a 2,5 mg/kg metamfetamin DA-ra gyakorolt kimerítő hatását, míg a mefedron minden dózisa szignifikánsan fokozta az 5,0 mg/kg metamfetamin DA-szintre gyakorolt hatását (p < 0,0001 mindegyik esetében).
1. ábra
A mefedron hatása a metamfetamin által kiváltott striatális DA csökkenésre. Az egereket a 2,5 (-) vagy 5,0 mg/kg (■) metamfetamin (METH) minden egyes injekciója előtt 30 perccel a jelzett dózisú mefedronnal (MEPH) kezelték, és 2d később feláldozták a DA striatális szintjének HPLC-vel történő meghatározásához. Az adatok csoportonként 5-7 egérre vonatkozó átlag ± SEM értékek. Néhány hibasáv túl kicsi volt ahhoz, hogy meghaladja a szimbólumok méretét, és nem látható. ***p < 0,001 vs. kontrollok és #p < 0,01, ##p < 0,001 vagy ###p < 0,0001 vs. a metamfetamin megfelelő dózisa (Tukey többszörös összehasonlító teszt).
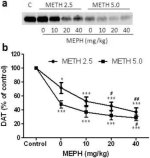
A 2a. ábra azt mutatja, hogy a mefedron jelentősen növelte a DAT szintjének metamfetamin által kiváltott csökkenését, amint azt immunoblottinggal határozták meg. Az immunoblotokat számszerűsítettük, és a DA-ra vonatkozó eredményekkel összhangban a metamfetamin dózis (F1,92 = 9,48, p < 0,001) és a mefedron dózis (F4,92 = 37,56, p < 0,0001) fő hatása a DAT szintekre a striatumban kétirányú ANOVA-val rendkívül szignifikáns volt (2b ábra). A 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) vagy 5,0 mg/kg metamfetaminnal kombinálva adott mefedron fő hatása (F4,39 = 24,84, p < 0,0001) szintén nagyon szignifikáns volt az egyirányú ANOVA-val. A metamfetamin ± mefedron bármelyik dózisával végzett valamennyi kezelés szignifikánsan nagyobb DAT-csökkenést okozott a megfelelő kontrollhoz képest (p < 0,01 a 2,5 mg/kg metamfetamin önmagában; p < 0,0001 az összes többi kezelés esetében). A 2b. ábra azt is mutatja, hogy a 20 mg/kg (p < 0,01) és 40 mg/kg (p < 0,001) mefedron dózisok jelentősen fokozták a DAT 2,5 mg/kg metamfetamin által okozott csökkenését, míg csak a 40 mg/kg mefedron dózis fokozta jelentősen (p < 0,01) az 5,0 mg/kg metamfetamin DAT-csökkenésre gyakorolt hatását.
2. ábra
A mefedron hatása a striatális DAT metamfetamin által kiváltott csökkenésére. Az egereket a jelzett dózisú mefedronnal (MEPH) kezelték 30 perccel a 2,5 (●) vagy 5,0 mg/kg (■) metamfetamin (METH) minden egyes injekciója előtt, és 2d később feláldozták a DAT striatális szintjének meghatározásához immunoblottinggal (a). A blotokat az ImageJ segítségével számszerűsítettük, és az adatok csoportonként 10-12 egér átlaga ± SEM (b). *p < 0,01 vagy ***p < 0,0001 vs. kontroll (C) és #p < 0,01 vagy ##p < 0,001 vs. a megfelelő metamfetamin dózis (Tukey többszörös összehasonlító teszt).
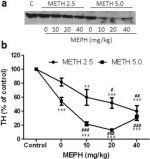
A 3a. ábra azt mutatja, hogy a mefedron szignifikánsan növelte a metamfetamin által kiváltott TH-szintcsökkenést, amint azt immunoblottinggal határozták meg. Az immunoblotokat számszerűsítettük, és a DA és DAT fenti eredményeivel összhangban a metamfetamin dózis (F1,81 = 47,89, p < 0,0001) és a mefedron dózis (F4,81 = 63,57, p < 0,0001) fő hatásai kétirányú ANOVA-val rendkívül szignifikánsak voltak (3b ábra). A 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) vagy 5,0 mg/kg metamfetaminnal (F4,49 = 99,16, p < 0,0001) kombinációban adott mefedron fő hatása szintén nagyon szignifikáns volt egyirányú ANOVA-val. A metamfetamin ± mefedron bármelyik dózisával végzett valamennyi kezelés szignifikánsan nagyobb TH-csökkenést okozott a megfelelő kontrollhoz képest (p < 0,001 a 2,5 mg/kg metamfetamin + 10 mg/kg mefedron esetében; p < 0,0001 az összes többi kombináció esetében), kivéve a 2,5 mg/kg metamfetamin önmagában, amely nem változtatta meg jelentősen a TH-szintet (azaz nem volt toxikus). A 3b. ábra azt is mutatja, hogy a 20 mg/kg (p < 0,01) és 40 mg/kg (p < 0,001) mefedron dózisok szignifikánsan fokozták a 2,5 mg/kg metamfetamin által okozott TH-csökkenést, és mindhárom mefedron dózis szignifikánsan (p < 0,0001) fokozta az 5,0 mg/kg metamfetamin TH-csökkenésre gyakorolt hatását.
3. ábra
A mefedron hatása a metamfetamin által kiváltott striatális TH csökkenésekre. Az egereket a jelzett dózisú mefedronnal (MEPH) kezelték 30 perccel a 2,5 (●) vagy 5,0 mg/kg (■) metamfetamin (METH) minden egyes injekciója előtt, és 2d később feláldozták a TH striatális szintjének meghatározásához immunoblottinggal (a). A blotokat az ImageJ segítségével számszerűsítettük, és az adatok csoportonként 10-12 egér átlaga ± SEM (b). Néhány hibasáv túl kicsi volt ahhoz, hogy meghaladja a szimbólumok méretét, és nem látható. **p < 0,001 vagy ***p < 0,0001 vs. kontroll (C) és #p < 0,01, ##p < 0,001 vagy ###p < 0,0001) vs. a metamfetamin megfelelő dózisa (Tukey többszörös összehasonlító teszt).
A mefedron hatása a metamfetamin által kiváltott hipertermiára
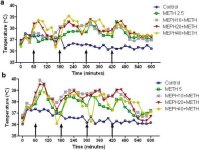
A mefedron a metamfetaminhoz hasonlóan jelentős hipertermiát okoz (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Amikor a mefedront 30 perccel a metamfetamin minden egyes injekciója előtt adták be, a 4. ábrán látható, hogy a metamfetamin és a mefedron dózisok (F1,300 = 11,99, p < 0,0001) fő hatása az időre (F4,300 = 51,73, p < 0,0001) a kétirányú ANOVA segítségével rendkívül szignifikáns volt. A 2,5 mg/kg metamfetaminnal (F4,120 = 41,44, p < 0,0001, a panel) kombinációban adott mefedron fő hatása az idő (F30,120 = 3,84, p < 0,0001) vagy az 5,0 mg/kg metamfetamin (F4,120 = 78,09, p < 0,0001, b panel) az idő (F30,120 = 9,98, p < 0,0001) függvényében szintén nagyon szignifikáns volt a kétirányú ANOVA segítségével. A metamfetamin ± mefedron bármelyik dózisával végzett valamennyi kezelés szignifikánsan különbözött a megfelelő kontrolloktól (p < 0,0001 minden kezelés esetében).
4. ábra
A mefedron hatása a metamfetamin által kiváltott hipertermiára. Az egereket a jelzett dózisú mefedronnal (MEPH) kezelték 30 perccel a 2,5 (a) vagy 5,0 mg/kg (b) metamfetamin (METH) injekció beadása előtt. A maghőmérsékletet 20 perces időközönként mértük telemetriával, az első metamfetamin-injekciót megelőző 60 perccel kezdődően. A 4 metamfetamin-injekciót az x-tengelyen nyugvó nyilak jelzik. Az adatokat csoportonként 6-8 egér átlagos testhőmérsékletében fejeztük ki. A SEM-ek mindig az átlag < 10%-át tették ki, és az áttekinthetőség kedvéért elhagyjuk őket.
A mefedron hatása az amfetamin- és MDMA-indukált neurotoxicitásra
Annak tesztelésére, hogy a mefedron metamfetaminra gyakorolt fokozó hatása kiterjeszthető-e más neurotoxikus amfetaminokra, egereket kezeltünk ezzel a β-ketoamfetaminnal (20 mg/kg) plusz amfetaminnal (4X 5 mg/kg) vagy MDMA-val (4X 20 mg/kg), és az eredményeket az 5. ábra mutatja be. Emlékeztetünk arra, hogy a mefedron önmagában nem csökkenti a striatális DA-t, DAT-ot vagy TH-t (Angoa-Perez és mtsai. 2012). A gyógyszer fő hatása (F5,27 = 27,18, p < 0,0001) egyirányú ANOVA-val rendkívül szignifikáns volt a DA-csökkenés tekintetében (5a. ábra). Az 5a ábrán az is látható, hogy az amfetaminnal (p < 0,001) vagy MDMA-val (p < 0,001) önmagában vagy mefedronnal kombinálva (p < 0,0001 mindkét drog esetében) végzett összes kezelés jelentősen csökkentette a DA-szintet a kontrollhoz képest. A mefedron jelentősen fokozta az amfetamin (p < 0,01) vagy az MDMA (p < 0,01) által okozott DA-csökkenést. Az 5b ábra a kombinált gyógyszeres kezelések hasonló hatásait mutatja a DAT szintekre a striatumban. A gyógyszer fő hatása (F4,49 = 42,63, p < 0,0001) egyirányú ANOVA-val rendkívül szignifikáns volt a DAT számára. Az 5b. ábrán az is látható, hogy az amfetamin vagy MDMA minden kezelésnél szignifikánsan (p < 0,0001 mindegyiknél) alacsonyabb volt a kontrollhoz képest. A mefedron szintén jelentősen fokozta az amfetamin vagy az MDMA által okozott DAT-csökkenést (p < 0,0001 mindkét esetben). Végül az 5c. ábra azt mutatja, hogy a kábítószer fő hatása (F4,50 = 75,06, p < 0,0001) egyirányú ANOVA-val a TH csökkenése esetén rendkívül szignifikáns volt. Az 5c. ábrán az is látható, hogy az amfetaminnal vagy MDMA-val végzett valamennyi kezelés szignifikánsan (p < 0,0001 mindegyik esetében) csökkent a kontrollhoz képest. A mefedron szintén jelentősen fokozta az amfetamin vagy az MDMA által okozott TH-csökkenést (p < 0,0001 mindkét esetben).
5. ábra
A mefedron hatása az amfetamin vagy MDMA által kiváltott DA idegvégződések neurotoxicitására. Az egereket 20 mg/kg mefedronnal (MEPH) kezeltük 30 perccel az 5,0 mg/kg amfetamin (AMPH) vagy 20 mg/kg MDMA injekció beadása előtt, és a kezelés után 2d perccel feláldoztuk őket, hogy HPLC-vel meghatározzuk a striatális DA-szinteket (a). (b) DAT és (c) TH meghatározása immunoblottinggal történt, és a blotokat az ImageJ segítségével számszerűsítettük. A DAT és a TH reprezentatív immunoblotjai a (b) és (c) panelek mellékleteként szerepelnek, és mindkét panel esetében a kezelést az 1,5: kontroll; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; és 8: MDMA + MEPH jelöli. Az adatok az egyes csoportok 5-12 egerének átlaga ± SEM. **p < 0,001 vagy ***p < 0,0001 vs. kontroll és #p < 0,01 vagy ###p < 0,0001 vs. AMPH vagy MDMA (Tukey többszörös összehasonlító teszt).
A nomifenzin hatása a metamfetamin által kiváltott neurotoxicitásra
A nomifenszint, egy erős DAT-blokkolót, amelynek nincs ismert visszaélési vagy neurotoxikus potenciálja, teszteltük a metamfetamin által kiváltott neurotoxicitás elleni védekező képességére, valamint a mefedron hatásával szemben a metamfetamin, az amfetamin és az MDMA által a DA idegvégződések toxicitására kifejtett hatásaira. A 6a. ábrán látható eredmények azt mutatják, hogy a kábítószer fő hatása (F3,16 = 63,39, p < 0,0001) a DA-szintekre az egyirányú ANOVA szerint rendkívül szignifikáns volt. A nomifenzin önmagában nem változtatta meg a DA-szinteket, de a metamfetamin által okozott csökkenést (p < 0,0001) a nomifenzin enyhén, de jelentősen megfordította (p < 0,01). A gyógyszer fő hatása (F3,20 = 16,78, p < 0,0001) a DAT-szintekre az egyirányú ANOVA-val rendkívül szignifikáns volt, amint azt a 6b ábra mutatja. A nomifenzin nem változtatta meg a DAT-szinteket, de szignifikáns védelmet nyújtott (p < 0,001) a metamfetamin által okozott striatális DAT-csökkenéssel szemben (p < 0,0001) a kontrollhoz képest. Végül a 6c. ábra azt mutatja, hogy a gyógyszer fő hatása (F3,15 = 14,10, p < 0,0001) a TH-szintekre az egyirányú ANOVA segítségével rendkívül szignifikáns volt. Ahogy a DA és a DAT esetében is látható volt, a metamfetamin által okozott TH-csökkenést (p < 0,0001) a nomifenzin (p < 0,01) enyhén, de szignifikánsan megakadályozta.
6. ábra
A nomifenzin hatása a metamfetamin által kiváltott DA idegvégződések neurotoxicitására. Az egereket 5,0 mg/kg nomifenszinnel (NOM) kezelték 30 perccel az 5,0 mg/kg metamfetamin (METH) minden egyes injekciója előtt, és 2d-vel később feláldozták őket a striatális DA-szintek HPLC-vel történő meghatározásához (a). (b) DAT és (c) TH meghatározása immunoblottinggal történt, és a blotokat az ImageJ segítségével számszerűsítettük. A DAT és TH reprezentatív immunoblotjai a (b) és (c) panelek mellékleteként szerepelnek. Az adatok csoportonként 5-7 egérre vonatkozó átlagok plusz SEM értékek. ***p < 0,0001 vs. kontroll (C) és #p < 0,01 vagy ##p < 0,001 vs. csak metamfetamin (Tukey többszörös összehasonlító teszt).
Megbeszélés
A jelen vizsgálat célja annak meghatározása volt, hogy a mefedron megakadályozza-e a metamfetamin által okozott DA idegvégződési toxicitást. A metamfetaminhoz és az MDMA-hoz való kémiai hasonlósága alapján kezdetben azt vártuk, hogy a mefedron káros hatást gyakorol a DA neuronrendszerre. Több vizsgálat azonban szinte egyidejűleg megállapította, hogy a mefedron nem toxikus a DA idegvégződésekre (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Az a kérdés, hogy ez a gyógyszer okoz-e károsodást az 5-HT neuronális rendszerben, továbbra is nyitott. Az egyik tanulmány az 5-HT idegvégződések funkciójának tartós csökkenéséről számolt be (Hadlock et al. 2011), míg egy másik tanulmány szerint a mefedron nem okozott károsodást (Baumann et al. 2012). A mefedron olyan módon lép kölcsönhatásba a DA idegvégződéssel, ami arra utal, hogy valóban stimulálja a felszabadulást és blokkolja a DA újrafelvételt a DAT-tal való kölcsönhatásán keresztül. A metamfetamin neurotoxikus hatásmechanizmusának egyik kulcsfontosságú aspektusa, hogy a DAT-on keresztül képes hozzáférni a DA idegvégződésekhez és megzavarni a DA homeosztázist (Sulzer 2011). Ha a DAT gátlásával megakadályozzuk a metamfetamin neurotoxikus kaszkádjának ezt a korai lépését, a toxicitás megelőzhető (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt és Gibb 1985). Arra gondoltunk, hogy a mefedron ugyanezzel a védő tulajdonsággal rendelkezhet, mint más DAT-gátlók, de ehelyett a toxicitás jelentős fokozódását figyeltük meg. Ezt a kölcsönhatást két különböző metamfetamin dózist használva tapasztaltuk, amelyek mérsékelt vagy súlyos károsodást okoznak a DA idegvégződésekben (4X 2,5 vagy 5,0 mg/kg). A mefedron e potenciáló hatása nem korlátozódott a metamfetaminra, és kiterjedt az amfetaminra és az MDMA-ra, két olyan kábítószerre, amelyeket gyakran használnak együtt a mefedronnal és más β-ketoamfetaminokkal (Feyissa and Kelly 2008, Schifano et al. 2011, Kelly 2011). Ezért annak ellenére, hogy a mefedron nem okoz toxicitást legalább a striatum DA idegvégződéseiben, a többi visszaélési drog neurotoxikus hatását potenciálja. Ez az új megállapítás a mefedron visszaélést még élesebb megvilágításba kell, hogy helyezze, mivel a saját neurotoxicitás hiánya miatt ártalmatlannak tűnhet.
A hipertermia a metamfetamin (Greene és mtsai. 2008) és a β-ketoamfetamin emberi fogyasztásának gyakran jelentett akut káros hatása (Borek és Holstege 2012, Prosser és Nelson 2012). A metamfetaminhoz hasonlóan számos β-ketoamfetamin hatóanyag is jelentős maghőmérséklet-emelkedést okoz rágcsálókban (Angoa-Perez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Bár a metamfetamin által okozott hipertermia hozzájárulhat a morfológiai és neuronkárosító hatásaihoz, nem feltétlenül a hipertermia a közvetlen oka ezeknek a hatásoknak (Kiyatkin és Sharma 2009). A mefedronnal és metamfetaminnal kezelt egerek testmaghőmérsékletét rögzítettük, és megfigyeltük, hogy a kombinált kezelés nem emelte meg a hőmérsékletet az önmagában bármelyik hatóanyag után tapasztalt maximális emelkedésen túl. A metamfetamin dózisfüggő testhőmérséklet-emelkedést okozott, és ez a hipertermia változatlan volt a teljes vizsgált mefedron dózistartományban. Valójában a mefedron-kezelés után megfigyelt testhőmérséklet-csökkenés (Angoa-Perez et al. 2012) a mefedron és metamfetamin nagyobb dózisai mellett is megmaradt. Bár a kábítószer okozta hipertermia nem erősödött a kombinált gyógyszeres kezelés hatására, a neurotoxikus hatások additívak voltak. Ezért, legalábbis a jelen esetben úgy tűnik, hogy a metamfetamin neurotoxikus hatásait a mefedron a hipertermiától független módon fokozhatja.
A mefedron egyértelműen gátolja a DAT funkciót és blokkolja a DA újrafelvételt in vitro (Lopez-Arnau és mtsai. 2012, Hadlock és mtsai. 2011, Kehr és mtsai. 2011, Martinez-Clemente és mtsai. 2012, Cozzi és mtsai. 1999). A mefedron kiszorítja a WIN-35,428-at a DAT-on lévő kötőhelyéről, ami arra utal, hogy a DA felvétel kompetitív gátlója (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). A mefedron hatékonysága ebben a tekintetben nagyon hasonló a metamfetaminéhoz (Cozzi és mtsai. 1999) és az MDMA-éhoz (Escubedo és mtsai. 2011). Nem ismert, hogy a mefedron transzportálódik-e a DAT-on keresztül, de a metkatinon igen (Cozzi és Foley 2003). A DAT-hoz kötődő és a DA felvételét gátló nomifenzin és amfonsav jelentős védelmet nyújt a metamfetamin által kiváltott neurotoxicitással szemben (Pu és mtsai. 1994, Marek és mtsai. 1990, Schmidt és Gibb 1985, Poth és mtsai. 2012), és a DAT-ot nélkülöző egerek rezisztensek a metamfetamin neuronális toxicitásával szemben (Fumagalli és mtsai. 1998). Annak ismerete, hogy a mefedron nem neurotoxikus és DAT-blokkoló, ahhoz a jóslathoz vezet, hogy meg kell előznie a toxicitást. Pozitív kontrollként teszteltük a nomifenzint ebben a tekintetben, és megerősítettük, hogy véd a DA, DAT és TH metamfetamin által kiváltott kimerülésével szemben. A nomifenzin gátolja a noradrenalin-transzportert is (Brogden és mtsai. 1979), de ez a tulajdonsága nem magyarázhatja a jelen eredményeket, mivel a legtöbb β-ketoamfetamin, beleértve a mefedront is, gátolja a noradrenalin-transzportert és blokkolja a noradrenalin felvételét (Kelly 2011, Rothman és mtsai. 2003, Cozzi és mtsai. 1999, Sogawa és mtsai. 2011, Lopez-Arnau és mtsai. 2012). Az 5-HT neuronális rendszer szerepe a mefedron egyes farmakológiai hatásaiban lehetséges, tekintettel arra, hogy ez a gyógyszer, az MDMA-hoz hasonlóan (Yamamoto et al. 1995), képes a striatális DA kiáramlását okozni az 5-HT2A receptorokkal való kölcsönhatásán keresztül (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). A mefedron által okozott hiperlokomóció az endogén 5-HT-től függ (Lopez-Arnau et al. 2012), és ez a gyógyszer in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) és in vivo (Baumann et al. 2012, Kehr et al. 2011) is stimulálja az 5-HT felszabadulását és gátolja a felvételét. Azzal azonban kizárhatjuk az endogén 5-HT szerepét legalább a metamfetamin DA neurotoxicitásában, hogy kimutattuk, hogy az 5-HT-ben genetikailag szegényített egerek megőrzik a neurotoxicitással szembeni érzékenységüket (Thomas és mtsai. 2010).
A mefedron több lehetséges mechanizmus révén fokozhatja a metamfetamin neurotoxicitását. Először is, a mefedron kölcsönhatásba léphet a VMAT-tal, hogy DA szivárgását okozza a preszinaptikus idegvégződés citoplazmájába. Azok a kezelések, amelyek növelik a DA citoplazmatikus poolját (azaz a gyógyszerrel szabaddá tehető), növelik a metamfetamin neurotoxicitást (Thomas és mtsai. 2008, Thomas és mtsai. 2009, Schmidt és mtsai. 1985). Ez a mechanizmus nem valószínű, mivel a metkatinon csak gyenge kölcsönhatásba lép a VMAT-tal (Cozzi és mtsai. 1999). Másodszor, a mefedron és a metamfetamin kombinációja szinergista hatást gyakorolhat a DA nem-vesikuláris felszabadulására, de ez a lehetőség szintén valószínűtlennek tűnik azon eredmények fényében, amelyek azt mutatják, hogy a DAT- vagy SERT-expresszáló CHO-sejtek metilonnal és metamfetaminnal történő kezelése nem gyakorol additív hatást a DA vagy 5-HT felszabadulására (Sogawa et al. 2011). Harmadszor, a mefedron újszerű módon léphet kölcsönhatásba a DAT-tal, ami hozzájárul az additív toxicitáshoz. Kimutatták, hogy a metephedron metamfetaminnal kombinálva szinergista citotoxicitást okoz a DAT-ot vagy SERT-et expresszáló CHO sejtekben, de nem a vad típusú CHO sejtekben, amelyekből hiányoznak a transzporterek (Sogawa et al. 2011). A tenyésztett sejtekben ezekben a vizsgálatokban megfigyelt citotoxicitás (azaz LDH felszabadulás) nagyon különbözik a DA idegvégződések metamfetamin által okozott károsodásától, de ez a mechanizmus a DAT érdekes, de meghatározatlan szerepére utal a fokozott citotoxicitásban. Végül a mefedron megváltoztathatja a metamfetamin metabolizmusát. A mefedron elsősorban N-demetilációval metabolizálódik (Meyer és Maurer 2010), akárcsak a metamfetamin és az MDMA (Caldwell 1976). Ezt a mechanizmust alátámasztja annak kimutatása, hogy a metamfetamin és az MDMA kölcsönösen gátolja a saját elsődleges metabolitjaik termelődését, és a kábítószer plazmaszintjét a bármelyik hatóanyag önmagában történő beadása után tapasztalt szintek fölé emeli (Kuwayama et al. 2012). A jelenleg és a korábbi vizsgálatunkban (Angoa-Perez et al. 2012) használt mefedron dózisok, bár magasak, nem neurotoxikusak, és az emberek által használt dózisok tartományába esnek (McErath and O'Neill 2011). Ezért a mefedron az MDMA-hoz hasonlóan hathat a metamfetamin plazmaszintjének növelésére azáltal, hogy gátolja annak metabolizmusát. Ez utóbbi lehetőség megerősítéséhez alapos farmakokinetikai elemzésre lesz szükség.
A β-ketoamfetaminokkal való visszaélés riasztó mértékben növekszik, és a mefedron ma már a kannabisz, az MDMA és a kokain után az egyik leggyakrabban használt kábítószer (Morris 2010, Winstock és mtsai. 2011b). Ráadásul a mefedron az MDMA-hoz képest erősebb vágyérzetet vált ki az emberekben (Brunt et al. 2011), és a mefedront szippantó felhasználók a kokainnál is addiktívabbnak ítélik meg (Winstock et al. 2011b). A mefedront az emberek binge-szerű módon fogyasztják (azaz "stacking"), és gyakran más drogokkal, például kannabisz és az amfetamin pszichostimulánsokkal együtt fogyasztják (Schifano et al. 2011, Fass et al. 2012, Winstock et al. 2011a, Kelly 2011, Torrance and Cooper 2010). A mefedront egyre gyakrabban találjuk meg az MDMA-ként árult tablettákban (Brunt et al. 2011), és a használata valószínűleg meghaladja majd az MDMA-ét, mivel ez utóbbi kábítószer tisztasága tovább csökken (Brunt et al. 2011, Tanner-Smith 2006, Teng et al. 2006). A mefedron és más "fürdősók" összetevőinek gyakori visszaélési mintái alapján fontos megfontolni, hogy az embereknél további egészségügyi kockázatok merülnek-e fel, ha ezeket a drogokat szándékosan vagy akaratlanul kombinálják az amfetaminokkal. Eredményeink, amelyek azt mutatják, hogy legalább a mefedron jelentősen fokozza a metamfetamin, az amfetamin és az MDMA által a striatum DA idegvégződéseiben okozott neurotoxicitást, ennek a β-ketoamfetaminnak egy különösen veszélyes és váratlan tulajdonságát tárják fel.
Használt rövidítések
5-HT szerotonin
DA dopamin
DAT DA transzporter
MDMA 3,4-metiléndioximetamfetamin
TH tirozin-hidroxiláz
VMAT vezikuláris monoamin transzporter
A mefedron (4-metilmetilkatinon) egy katinonszármazék és a metamfetamin és a 3,4-metiléndioxi-metamfetamin (MDMA) szerkezeti analógja. A mefedron a "fürdősók" egyik pszichoaktív összetevője olyan más vegyületekkel együtt, mint a metilon, butilon és a 3,4-metiléndioxipyrovaleron (MDPV). A β-ketoamfetaminokkal egyre nagyobb arányban élnek vissza, ami nem kis részben annak köszönhető, hogy a titkos laboratóriumokban a metamfetamin és MDMA szintéziséhez szükséges prekurzorok nagyon korlátozottan állnak rendelkezésre, és ennek megfelelően a tisztaságuk is csökken (Winstock et al. 2011b, Brunt et al. 2011). A β-ketoamfetaminokkal való visszaélés folyamatos növekedésével a káros hatások listája egyre bővül, és a kardiovaszkuláris szövődmények, az izgatottság, az álmatlanság, a pszichózis és a depresszió is felkerült rá (Schifano et al. 2011, Prosser and Nelson 2012).
A metamfetamin és az MDMA kémiai rokonaként nem meglepő, hogy a β-ketoamfetaminok számos olyan hatással rendelkeznek a központi idegrendszerre, mint ezek az előbbi kábítószerek. Ezek a szerek például blokkolják a dopamin (DA) és a szerotonin (5-HT) transzportereket (DAT, illetve SERT) (Cozzi és mtsai. 1999, Rothman és mtsai. 2003, Fleckenstein és mtsai. 2000, Lopez-Arnau és mtsai. 2012), és in vitro (Kalix és Glennon 1986, Gygi és mtsai. 1997, Rothman és mtsai. 2003) és in vivo (Gygi és mtsai. 1997, Kehr és mtsai. 2011) stimulálják a monoamin felszabadulást. A metkatinon tartósan csökkenti a triptofán-hidroxiláz és a tirozin-hidroxiláz (TH) aktivitását, valamint a DA és az 5-HT kiürülését (Gygi és mtsai. 1997, Gygi és mtsai. 1996, Sparago és mtsai. 1996). Az absztinens metkatinon-használókon végzett PET-képalkotó vizsgálatok a DA-terminálisok elvesztésére utaló csökkent striatális DAT-sűrűséget mutattak ki (McCann és mtsai. 1998). A DA felszabadulásának egyidejű stimulálása és a felvételének gátlása tükrözi a metamfetaminhoz társuló neurotoxicitás hátterében álló kritikus elemeket (Kuhn et al. 2008, Yamamoto és Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Mi (Angoa-Perez et al. 2012) és mások (Baumann et al. 2012, Hadlock et al. 2011) nemrégiben megvizsgáltuk annak lehetőségét, hogy a mefedron a metamfetaminhoz és az MDMA-hoz hasonlóan neurotoxicitást okozhat. Meglepő módon a mefedron nem volt toxikus a striatum DA idegvégződéseire (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Az a kérdés, hogy a mefedron károsítja-e az 5-HT idegvégződéseket, továbbra is tisztázatlan, mivel egy tanulmány pozitív hatásokat dokumentált (Hadlock et al. 2011), míg egy másik negatív volt (Baumann et al. 2012). A mefedron DA idegvégződésekre gyakorolt viszonylag jóindulatú hatásának fényében és figyelembe véve DAT-blokkoló tulajdonságait, feltételeztük, hogy valójában megvédheti a DA neuronális rendszert a metamfetamin neurotoxikus hatásaitól, ahogyan az más DAT-blokkolókkal, például az amfonsavval (Pu et al. 1994, Schmidt és Gibb 1985, Marek et al. 1990) és a nomifenzinnel (Poth et al. 2012) is ismert. Jelenleg arról számolunk be, hogy a mefedron jelentősen fokozza a metamfetamin neurotoxicitását. Ez a hatás kiterjed az amfetaminra és az MDMA-ra, a mefedronnal gyakran együtt fogyasztott drogokra is (Feyissa és Kelly 2008, Schifano és mtsai. 2011). Ezek a meglepő eredmények új megvilágításba helyezik a mefedron visszaélését, és sürgősen fel kell ismerni e β-ketoamfetamin e finom és veszélyes tulajdonságát.
Anyagok és módszerek
Kábítószerek és reagensek
A mefedron-hidrokloridot és a 3,4-metiléndioximetamfetamint (MDMA) az NIDA Research Resources Drug Supply Programtól szereztük be. (+) A metamfetamin-hidrokloridot, a nomifenszin-maleátot, a d-amfetamin-szulfátot, a pentobarbitált, a DA-t, valamint az összes puffert és HPLC-reagenseket a Sigma-Aldrichtól (St. Louis, MO, USA) vásároltuk. A bicinkoninsav fehérje meghatározó készleteket a Pierce-től (Rockford, IL, USA) szereztük be. A patkány TH elleni poliklonális antitesteket a korábban leírtak szerint állítottuk elő (Kuhn és Billingsley 1987). A patkány DAT elleni monoklonális antitesteket nagylelkűen Dr. Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA) biztosította. A HRP-konjugált anti-IgG másodlagos antitesteket a Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA) biztosította.
Állatok
Nőstény C57BL/6 egereket (Harlan, Indianapolis, IN, USA), amelyek a kísérlet időpontjában 20-25 g súlyúak voltak, ketrecenként 5 egyedet helyeztek el nagy cipősdobozos ketrecekben, világos (12 óra világos/sötét) és hőmérséklet-szabályozott szobában. Nőstény egereket használtunk, mivel ismert, hogy nagyon érzékenyek a neurotoxikus amfetaminok által okozott neuronális károsodásra, és hogy fenntartsuk az összhangot a metamfetamin neurotoxicitásával kapcsolatos korábbi vizsgálatainkkal (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). Az egerek szabadon hozzáférhettek táplálékhoz és vízhez. A Wayne Állami Egyetem Intézményi Gondozási és Felhasználási Bizottsága jóváhagyta az állatok gondozását és a kísérleti eljárásokat. Minden eljárás megfelelt az NIH Guide for the Care and Use of Laboratory Animals (NIH útmutató a laboratóriumi állatok gondozásáról és felhasználásáról) című dokumentumnak is.
Farmakológiai, fiziológiai és viselkedési eljárások
Az egereket mefedronnal kezeltük, egy olyan binge-szerű kezeléssel, amely 4 db 10, 20 vagy 40 mg/kg-os injekcióból állt, az egyes injekciók között 2 órás szünettel. Ez a binge-kezelési séma, amikor helyettesített amfetaminok és katinon-származékok beadására használják, kiterjedt DA idegvégződés-károsodást eredményez. A jelenleg használt mefedron dózisokról korábban kimutatták, hogy nem toxikusak a DA idegvégződésekre (Angoa-Perez és mtsai. 2012). Az egereket metamfetaminnal (4X 2,5 vagy 5 mg/kg), amfetaminnal (4X 5 mg/kg) vagy MDMA-val (4X 20 mg/kg) kezelték önmagában vagy mefedronnal kombinálva. Két gyógyszerrel történő kezelés esetén az egerek 30 perccel a metamfetamin, amfetamin vagy MDMA mind a 4 injekciója előtt kaptak egy-egy mefedron-injekciót. A kontrollok fiziológiás sóoldat injekciókat kaptak ugyanabban az ütemezésben, mint a mefedron önmagában vagy más amfetaminokkal kombinálva. A DAT-gátló metamfetamin-toxicitásra gyakorolt hatásának kontrolljaként az egereket nomifenszinnel (4X 5 mg/kg) kezelték 30 perccel a metamfetamin (4X 5 mg/kg) minden egyes injekciója előtt. Minden injekciót i.p. úton adtak be. Az egereket 2 nappal az utolsó gyógyszeres kezelés után feláldozták, amikor az amfetaminhoz kapcsolódó neurotoxicitás elérte a maximumot. A testhőmérsékletet a Bio Medic Data Systems, Inc. (Seaford, DE, USA) IPTT-300 beültethető hőmérséklet-transzponderével telemetrikusan követtük nyomon. A hőmérsékletet non-invazív módon, 20 percenként rögzítettük, az első METH-injekciót megelőző 60 perctől kezdődően, majd azt követően 9 órán keresztül a Bio Medic DAS-5001 konzolrendszerével.
A striatális DA-tartalom meghatározása
A sztriatális szövetet a kezelést követően kétoldalt kivágtuk az agyból, és -80°C-on tároltuk. A lefagyasztott szöveteket megmértük és 10 térfogat 0,16 N perklórsavban 4°C-on szonikáztuk. Az oldhatatlan fehérjét centrifugálással távolítottuk el, és a DA-t HPLC-vel határoztuk meg elektrokémiai detektálással, a metamfetamin esetében korábban leírtak szerint (Thomas et al. 2010, Thomas et al, 2009).
A TH és DAT fehérjeszintek meghatározása immunoblottinggal
A gyógyszeres kezelések hatását a striatális TH és DAT szintekre immunoblottinggal határoztuk meg a striatális DA idegvégződésekre gyakorolt toxicitás indexeként. Az egereket a kezelést követően lefejezéssel feláldoztuk, és a striatumot kétoldalt felboncoltuk. A szöveteket -80°C-on tároltuk. A lefagyasztott szövetet 1%-os SDS-ben 95°C-on történő szonikációval bontottuk fel, és az oldhatatlan anyagot centrifugálással ülepítettük. A fehérjéket bicinchoninsav-módszerrel határoztuk meg, és azonos mennyiségű fehérjét (70 μg/sáv) SDS-poliakrilamid gélelektroforézissel oldottunk fel, majd nitrocellulózra elektroblottoltunk. A blotokat Tween 20 (0,1% v/v) és 5% zsírmentes száraz tej tartalmú Tris pufferelt sóoldatban blokkoltuk 1 órán keresztül szobahőmérsékleten. A blotokhoz TH (1:1000) vagy DAT (1:1000) elleni primer antitesteket adtunk, és 16 órán át hagytuk inkubálni 4°C-on. A blotokat 3X mostuk Tris-pufferelt sóoldattal a nem reagált antitestek eltávolítása érdekében, majd HRP-konjugált anti-IgG másodlagos antitesttel (1:4000) inkubáltuk 1 órán keresztül szobahőmérsékleten. Az immunreaktív sávokat megerősített kemilumineszcenciával vizualizáltuk, és a TH- és DAT-reaktív sávok relatív sűrűségét Kodak Image Station (Carestream Molecular Systems, Rochester, NY, USA) segítségével képalkotással határoztuk meg, és az ImageJ szoftver (NIH) segítségével számszerűsítettük.
Az adatok elemzése
A metamfetamin versus mefedron DA-ra, DAT-ra és TH-ra gyakorolt dózishatásainak elemzésére kétutas ANOVA-t végeztünk. A drogkezelések hatását a striatális DA, TH és DAT tartalomra egyirányú ANOVA-val vizsgáltuk szignifikancia szempontjából, amelyet Tukey többszörös összehasonlító teszt követett. A drogkezeléseknek a testmaghőmérsékletre az idő múlásával kapcsolatos eredményeit kétirányú ANOVA-val elemeztük, amelyet Bonferroni-teszt követett, hogy meghatározzuk a hőmérsékletben az egyes kezelések utáni időpontokban mutatkozó különbségek szignifikanciáját. A különbségeket akkor tekintettük szignifikánsnak, ha p < 0,05. Az összes statisztikai elemzést a GraphPad Prism 5.02 verziója segítségével végeztük el Windowsra (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Folytassa a következő címmel: (1) A következő címre kattintva:
Eredmények
A mefedron hatása a metamfetamin által kiváltott neurotoxicitásra
A mefedront, olyan dózisokban (10, 20 vagy 40 mg/kg), amelyekről ismert, hogy nem okoznak DA idegvégződés-toxicitást (Angoa-Perez et al. 2012), 30 perccel a metamfetamin minden egyes injekciója előtt adtuk be. A metamfetamint olyan dózisokban adtuk be, amelyek mérsékelt (4X 2,5 mg/kg) vagy súlyos (4X 5 mg/kg) károsodást okoznak a striatum DA idegvégződéseiben (Thomas és mtsai. 2004, Thomas és mtsai. 2010). Az 1. ábrán bemutatott eredmények azt mutatják, hogy a metamfetamin dózis (F1,40 = 66,60, p < 0,0001) és a mefedron dózis (F4,40 = 131,3, p < 0,0001) fő hatása a striatum DA-szintjére a kétirányú ANOVA segítségével rendkívül szignifikáns volt. A 2,5 mg/kg (F4,22 = 35,96, p < 0,001) vagy 5,0 mg/kg metamfetaminnal (F4,17 = 953,9, p < 0,0001) kombinációban adott mefedron fő hatása egyirányú ANOVA-val szintén nagyon szignifikáns volt. A metamfetamin ± mefedron bármelyik dózisával végzett valamennyi kezelés szignifikánsan nagyobb DA-csökkenést okozott a megfelelő kontrollhoz képest (p < 0,0001 mindegyiknél). Az 1. ábra azt is mutatja, hogy a 20 (p < 0,01) és 40 mg/kg (p < 0,001) mefedron dózisok szignifikánsan fokozták a 2,5 mg/kg metamfetamin DA-ra gyakorolt kimerítő hatását, míg a mefedron minden dózisa szignifikánsan fokozta az 5,0 mg/kg metamfetamin DA-szintre gyakorolt hatását (p < 0,0001 mindegyik esetében).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/sywobkqrnd-jpg.47/&hash=f31155ada4e59f22a35f9110aaa6a7e5
1. ábra
A mefedron hatása a metamfetamin által kiváltott striatális DA csökkenésre. Az egereket a 2,5 (-) vagy 5,0 mg/kg (■) metamfetamin (METH) minden egyes injekciója előtt 30 perccel a jelzett dózisú mefedronnal (MEPH) kezelték, és 2d később feláldozták a DA striatális szintjének HPLC-vel történő meghatározásához. Az adatok csoportonként 5-7 egérre vonatkozó átlag ± SEM értékek. Néhány hibasáv túl kicsi volt ahhoz, hogy meghaladja a szimbólumok méretét, és nem látható. ***p < 0,001 vs. kontrollok és #p < 0,01, ##p < 0,001 vagy ###p < 0,0001 vs. a metamfetamin megfelelő dózisa (Tukey többszörös összehasonlító teszt).
A 2a. ábra azt mutatja, hogy a mefedron jelentősen növelte a DAT szintjének metamfetamin által kiváltott csökkenését, amint azt immunoblottinggal határozták meg. Az immunoblotokat számszerűsítettük, és a DA-ra vonatkozó eredményekkel összhangban a metamfetamin dózis (F1,92 = 9,48, p < 0,001) és a mefedron dózis (F4,92 = 37,56, p < 0,0001) fő hatása a DAT szintekre a striatumban kétirányú ANOVA-val rendkívül szignifikáns volt (2b ábra). A 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) vagy 5,0 mg/kg metamfetaminnal kombinálva adott mefedron fő hatása (F4,39 = 24,84, p < 0,0001) szintén nagyon szignifikáns volt az egyirányú ANOVA-val. A metamfetamin ± mefedron bármelyik dózisával végzett valamennyi kezelés szignifikánsan nagyobb DAT-csökkenést okozott a megfelelő kontrollhoz képest (p < 0,01 a 2,5 mg/kg metamfetamin önmagában; p < 0,0001 az összes többi kezelés esetében). A 2b. ábra azt is mutatja, hogy a 20 mg/kg (p < 0,01) és 40 mg/kg (p < 0,001) mefedron dózisok jelentősen fokozták a DAT 2,5 mg/kg metamfetamin által okozott csökkenését, míg csak a 40 mg/kg mefedron dózis fokozta jelentősen (p < 0,01) az 5,0 mg/kg metamfetamin DAT-csökkenésre gyakorolt hatását.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/bfu3sx5dnr-jpg.4797/&hash=f31155ada4e59f22a35f9110aaa6a7e5
2. ábra
A mefedron hatása a striatális DAT metamfetamin által kiváltott csökkenésére. Az egereket a jelzett dózisú mefedronnal (MEPH) kezelték 30 perccel a 2,5 (●) vagy 5,0 mg/kg (■) metamfetamin (METH) minden egyes injekciója előtt, és 2d később feláldozták a DAT striatális szintjének meghatározásához immunoblottinggal (a). A blotokat az ImageJ segítségével számszerűsítettük, és az adatok csoportonként 10-12 egér átlaga ± SEM (b). *p < 0,01 vagy ***p < 0,0001 vs. kontroll (C) és #p < 0,01 vagy ##p < 0,001 vs. a megfelelő metamfetamin dózis (Tukey többszörös összehasonlító teszt).
A 3a. ábra azt mutatja, hogy a mefedron szignifikánsan növelte a metamfetamin által kiváltott TH-szintcsökkenést, amint azt immunoblottinggal határozták meg. Az immunoblotokat számszerűsítettük, és a DA és DAT fenti eredményeivel összhangban a metamfetamin dózis (F1,81 = 47,89, p < 0,0001) és a mefedron dózis (F4,81 = 63,57, p < 0,0001) fő hatásai kétirányú ANOVA-val rendkívül szignifikánsak voltak (3b ábra). A 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) vagy 5,0 mg/kg metamfetaminnal (F4,49 = 99,16, p < 0,0001) kombinációban adott mefedron fő hatása szintén nagyon szignifikáns volt egyirányú ANOVA-val. A metamfetamin ± mefedron bármelyik dózisával végzett valamennyi kezelés szignifikánsan nagyobb TH-csökkenést okozott a megfelelő kontrollhoz képest (p < 0,001 a 2,5 mg/kg metamfetamin + 10 mg/kg mefedron esetében; p < 0,0001 az összes többi kombináció esetében), kivéve a 2,5 mg/kg metamfetamin önmagában, amely nem változtatta meg jelentősen a TH-szintet (azaz nem volt toxikus). A 3b. ábra azt is mutatja, hogy a 20 mg/kg (p < 0,01) és 40 mg/kg (p < 0,001) mefedron dózisok szignifikánsan fokozták a 2,5 mg/kg metamfetamin által okozott TH-csökkenést, és mindhárom mefedron dózis szignifikánsan (p < 0,0001) fokozta az 5,0 mg/kg metamfetamin TH-csökkenésre gyakorolt hatását.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/tggfrjpqru-jpg.4798/&hash=f31155ada4e59f22a35f9110aaa6a7e5
3. ábra
A mefedron hatása a metamfetamin által kiváltott striatális TH csökkenésekre. Az egereket a jelzett dózisú mefedronnal (MEPH) kezelték 30 perccel a 2,5 (●) vagy 5,0 mg/kg (■) metamfetamin (METH) minden egyes injekciója előtt, és 2d később feláldozták a TH striatális szintjének meghatározásához immunoblottinggal (a). A blotokat az ImageJ segítségével számszerűsítettük, és az adatok csoportonként 10-12 egér átlaga ± SEM (b). Néhány hibasáv túl kicsi volt ahhoz, hogy meghaladja a szimbólumok méretét, és nem látható. **p < 0,001 vagy ***p < 0,0001 vs. kontroll (C) és #p < 0,01, ##p < 0,001 vagy ###p < 0,0001) vs. a metamfetamin megfelelő dózisa (Tukey többszörös összehasonlító teszt).
A mefedron hatása a metamfetamin által kiváltott hipertermiára
A mefedron a metamfetaminhoz hasonlóan jelentős hipertermiát okoz (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Amikor a mefedront 30 perccel a metamfetamin minden egyes injekciója előtt adták be, a 4. ábrán látható, hogy a metamfetamin és a mefedron dózisok (F1,300 = 11,99, p < 0,0001) fő hatása az időre (F4,300 = 51,73, p < 0,0001) a kétirányú ANOVA segítségével rendkívül szignifikáns volt. A 2,5 mg/kg metamfetaminnal (F4,120 = 41,44, p < 0,0001, a panel) kombinációban adott mefedron fő hatása az idő (F30,120 = 3,84, p < 0,0001) vagy az 5,0 mg/kg metamfetamin (F4,120 = 78,09, p < 0,0001, b panel) az idő (F30,120 = 9,98, p < 0,0001) függvényében szintén nagyon szignifikáns volt a kétirányú ANOVA segítségével. A metamfetamin ± mefedron bármelyik dózisával végzett valamennyi kezelés szignifikánsan különbözött a megfelelő kontrolloktól (p < 0,0001 minden kezelés esetében).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/x0ik9hdwsw-jpg.4799/&hash=f31155ada4e59f22a35f9110aaa6a7e5
4. ábra
A mefedron hatása a metamfetamin által kiváltott hipertermiára. Az egereket a jelzett dózisú mefedronnal (MEPH) kezelték 30 perccel a 2,5 (a) vagy 5,0 mg/kg (b) metamfetamin (METH) injekció beadása előtt. A maghőmérsékletet 20 perces időközönként mértük telemetriával, az első metamfetamin-injekciót megelőző 60 perccel kezdődően. A 4 metamfetamin-injekciót az x-tengelyen nyugvó nyilak jelzik. Az adatokat csoportonként 6-8 egér átlagos testhőmérsékletében fejeztük ki. A SEM-ek mindig az átlag < 10%-át tették ki, és az áttekinthetőség kedvéért elhagyjuk őket.
A mefedron hatása az amfetamin- és MDMA-indukált neurotoxicitásra
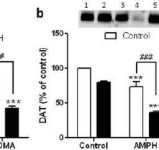
Annak tesztelésére, hogy a mefedron metamfetaminra gyakorolt fokozó hatása kiterjeszthető-e más neurotoxikus amfetaminokra, egereket kezeltünk ezzel a β-ketoamfetaminnal (20 mg/kg) plusz amfetaminnal (4X 5 mg/kg) vagy MDMA-val (4X 20 mg/kg), és az eredményeket az 5. ábra mutatja be. Emlékeztetünk arra, hogy a mefedron önmagában nem csökkenti a striatális DA-t, DAT-ot vagy TH-t (Angoa-Perez és mtsai. 2012). A gyógyszer fő hatása (F5,27 = 27,18, p < 0,0001) egyirányú ANOVA-val rendkívül szignifikáns volt a DA-csökkenés tekintetében (5a. ábra). Az 5a ábrán az is látható, hogy az amfetaminnal (p < 0,001) vagy MDMA-val (p < 0,001) önmagában vagy mefedronnal kombinálva (p < 0,0001 mindkét drog esetében) végzett összes kezelés jelentősen csökkentette a DA-szintet a kontrollhoz képest. A mefedron jelentősen fokozta az amfetamin (p < 0,01) vagy az MDMA (p < 0,01) által okozott DA-csökkenést. Az 5b ábra a kombinált gyógyszeres kezelések hasonló hatásait mutatja a DAT szintekre a striatumban. A gyógyszer fő hatása (F4,49 = 42,63, p < 0,0001) egyirányú ANOVA-val rendkívül szignifikáns volt a DAT számára. Az 5b. ábrán az is látható, hogy az amfetamin vagy MDMA minden kezelésnél szignifikánsan (p < 0,0001 mindegyiknél) alacsonyabb volt a kontrollhoz képest. A mefedron szintén jelentősen fokozta az amfetamin vagy az MDMA által okozott DAT-csökkenést (p < 0,0001 mindkét esetben). Végül az 5c. ábra azt mutatja, hogy a kábítószer fő hatása (F4,50 = 75,06, p < 0,0001) egyirányú ANOVA-val a TH csökkenése esetén rendkívül szignifikáns volt. Az 5c. ábrán az is látható, hogy az amfetaminnal vagy MDMA-val végzett valamennyi kezelés szignifikánsan (p < 0,0001 mindegyik esetében) csökkent a kontrollhoz képest. A mefedron szintén jelentősen fokozta az amfetamin vagy az MDMA által okozott TH-csökkenést (p < 0,0001 mindkét esetben).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/onvypkgxvn-jpg.4800/&hash=f31155ada4e59f22a35f9110aaa6a7e5
5. ábra
A mefedron hatása az amfetamin vagy MDMA által kiváltott DA idegvégződések neurotoxicitására. Az egereket 20 mg/kg mefedronnal (MEPH) kezeltük 30 perccel az 5,0 mg/kg amfetamin (AMPH) vagy 20 mg/kg MDMA injekció beadása előtt, és a kezelés után 2d perccel feláldoztuk őket, hogy HPLC-vel meghatározzuk a striatális DA-szinteket (a). (b) DAT és (c) TH meghatározása immunoblottinggal történt, és a blotokat az ImageJ segítségével számszerűsítettük. A DAT és a TH reprezentatív immunoblotjai a (b) és (c) panelek mellékleteként szerepelnek, és mindkét panel esetében a kezelést az 1,5: kontroll; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; és 8: MDMA + MEPH jelöli. Az adatok az egyes csoportok 5-12 egerének átlaga ± SEM. **p < 0,001 vagy ***p < 0,0001 vs. kontroll és #p < 0,01 vagy ###p < 0,0001 vs. AMPH vagy MDMA (Tukey többszörös összehasonlító teszt).
A nomifenzin hatása a metamfetamin által kiváltott neurotoxicitásra
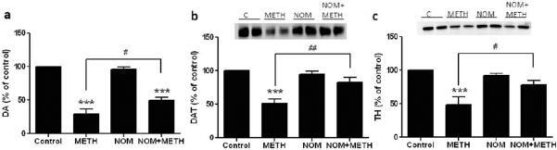
A nomifenszint, egy erős DAT-blokkolót, amelynek nincs ismert visszaélési vagy neurotoxikus potenciálja, teszteltük a metamfetamin által kiváltott neurotoxicitás elleni védekező képességére, valamint a mefedron hatásával szemben a metamfetamin, az amfetamin és az MDMA által a DA idegvégződések toxicitására kifejtett hatásaira. A 6a. ábrán látható eredmények azt mutatják, hogy a kábítószer fő hatása (F3,16 = 63,39, p < 0,0001) a DA-szintekre az egyirányú ANOVA szerint rendkívül szignifikáns volt. A nomifenzin önmagában nem változtatta meg a DA-szinteket, de a metamfetamin által okozott csökkenést (p < 0,0001) a nomifenzin enyhén, de jelentősen megfordította (p < 0,01). A gyógyszer fő hatása (F3,20 = 16,78, p < 0,0001) a DAT-szintekre az egyirányú ANOVA-val rendkívül szignifikáns volt, amint azt a 6b ábra mutatja. A nomifenzin nem változtatta meg a DAT-szinteket, de szignifikáns védelmet nyújtott (p < 0,001) a metamfetamin által okozott striatális DAT-csökkenéssel szemben (p < 0,0001) a kontrollhoz képest. Végül a 6c. ábra azt mutatja, hogy a gyógyszer fő hatása (F3,15 = 14,10, p < 0,0001) a TH-szintekre az egyirányú ANOVA segítségével rendkívül szignifikáns volt. Ahogy a DA és a DAT esetében is látható volt, a metamfetamin által okozott TH-csökkenést (p < 0,0001) a nomifenzin (p < 0,01) enyhén, de szignifikánsan megakadályozta.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/daczg9cwfv-jpg.4801/&hash=f31155ada4e59f22a35f9110aaa6a7e5
6. ábra
A nomifenzin hatása a metamfetamin által kiváltott DA idegvégződések neurotoxicitására. Az egereket 5,0 mg/kg nomifenszinnel (NOM) kezelték 30 perccel az 5,0 mg/kg metamfetamin (METH) minden egyes injekciója előtt, és 2d-vel később feláldozták őket a striatális DA-szintek HPLC-vel történő meghatározásához (a). (b) DAT és (c) TH meghatározása immunoblottinggal történt, és a blotokat az ImageJ segítségével számszerűsítettük. A DAT és TH reprezentatív immunoblotjai a (b) és (c) panelek mellékleteként szerepelnek. Az adatok csoportonként 5-7 egérre vonatkozó átlagok plusz SEM értékek. ***p < 0,0001 vs. kontroll (C) és #p < 0,01 vagy ##p < 0,001 vs. csak metamfetamin (Tukey többszörös összehasonlító teszt).
Megbeszélés
A jelen vizsgálat célja annak meghatározása volt, hogy a mefedron megakadályozza-e a metamfetamin által okozott DA idegvégződési toxicitást. A metamfetaminhoz és az MDMA-hoz való kémiai hasonlósága alapján kezdetben azt vártuk, hogy a mefedron káros hatást gyakorol a DA neuronrendszerre. Több vizsgálat azonban szinte egyidejűleg megállapította, hogy a mefedron nem toxikus a DA idegvégződésekre (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Az a kérdés, hogy ez a gyógyszer okoz-e károsodást az 5-HT neuronális rendszerben, továbbra is nyitott. Az egyik tanulmány az 5-HT idegvégződések funkciójának tartós csökkenéséről számolt be (Hadlock et al. 2011), míg egy másik tanulmány szerint a mefedron nem okozott károsodást (Baumann et al. 2012). A mefedron olyan módon lép kölcsönhatásba a DA idegvégződéssel, ami arra utal, hogy valóban stimulálja a felszabadulást és blokkolja a DA újrafelvételt a DAT-tal való kölcsönhatásán keresztül. A metamfetamin neurotoxikus hatásmechanizmusának egyik kulcsfontosságú aspektusa, hogy a DAT-on keresztül képes hozzáférni a DA idegvégződésekhez és megzavarni a DA homeosztázist (Sulzer 2011). Ha a DAT gátlásával megakadályozzuk a metamfetamin neurotoxikus kaszkádjának ezt a korai lépését, a toxicitás megelőzhető (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt és Gibb 1985). Arra gondoltunk, hogy a mefedron ugyanezzel a védő tulajdonsággal rendelkezhet, mint más DAT-gátlók, de ehelyett a toxicitás jelentős fokozódását figyeltük meg. Ezt a kölcsönhatást két különböző metamfetamin dózist használva tapasztaltuk, amelyek mérsékelt vagy súlyos károsodást okoznak a DA idegvégződésekben (4X 2,5 vagy 5,0 mg/kg). A mefedron e potenciáló hatása nem korlátozódott a metamfetaminra, és kiterjedt az amfetaminra és az MDMA-ra, két olyan kábítószerre, amelyeket gyakran használnak együtt a mefedronnal és más β-ketoamfetaminokkal (Feyissa and Kelly 2008, Schifano et al. 2011, Kelly 2011). Ezért annak ellenére, hogy a mefedron nem okoz toxicitást legalább a striatum DA idegvégződéseiben, a többi visszaélési drog neurotoxikus hatását potenciálja. Ez az új megállapítás a mefedron visszaélést még élesebb megvilágításba kell, hogy helyezze, mivel a saját neurotoxicitás hiánya miatt ártalmatlannak tűnhet.
A hipertermia a metamfetamin (Greene és mtsai. 2008) és a β-ketoamfetamin emberi fogyasztásának gyakran jelentett akut káros hatása (Borek és Holstege 2012, Prosser és Nelson 2012). A metamfetaminhoz hasonlóan számos β-ketoamfetamin hatóanyag is jelentős maghőmérséklet-emelkedést okoz rágcsálókban (Angoa-Perez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Bár a metamfetamin által okozott hipertermia hozzájárulhat a morfológiai és neuronkárosító hatásaihoz, nem feltétlenül a hipertermia a közvetlen oka ezeknek a hatásoknak (Kiyatkin és Sharma 2009). A mefedronnal és metamfetaminnal kezelt egerek testmaghőmérsékletét rögzítettük, és megfigyeltük, hogy a kombinált kezelés nem emelte meg a hőmérsékletet az önmagában bármelyik hatóanyag után tapasztalt maximális emelkedésen túl. A metamfetamin dózisfüggő testhőmérséklet-emelkedést okozott, és ez a hipertermia változatlan volt a teljes vizsgált mefedron dózistartományban. Valójában a mefedron-kezelés után megfigyelt testhőmérséklet-csökkenés (Angoa-Perez et al. 2012) a mefedron és metamfetamin nagyobb dózisai mellett is megmaradt. Bár a kábítószer okozta hipertermia nem erősödött a kombinált gyógyszeres kezelés hatására, a neurotoxikus hatások additívak voltak. Ezért, legalábbis a jelen esetben úgy tűnik, hogy a metamfetamin neurotoxikus hatásait a mefedron a hipertermiától független módon fokozhatja.
A mefedron egyértelműen gátolja a DAT funkciót és blokkolja a DA újrafelvételt in vitro (Lopez-Arnau és mtsai. 2012, Hadlock és mtsai. 2011, Kehr és mtsai. 2011, Martinez-Clemente és mtsai. 2012, Cozzi és mtsai. 1999). A mefedron kiszorítja a WIN-35,428-at a DAT-on lévő kötőhelyéről, ami arra utal, hogy a DA felvétel kompetitív gátlója (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). A mefedron hatékonysága ebben a tekintetben nagyon hasonló a metamfetaminéhoz (Cozzi és mtsai. 1999) és az MDMA-éhoz (Escubedo és mtsai. 2011). Nem ismert, hogy a mefedron transzportálódik-e a DAT-on keresztül, de a metkatinon igen (Cozzi és Foley 2003). A DAT-hoz kötődő és a DA felvételét gátló nomifenzin és amfonsav jelentős védelmet nyújt a metamfetamin által kiváltott neurotoxicitással szemben (Pu és mtsai. 1994, Marek és mtsai. 1990, Schmidt és Gibb 1985, Poth és mtsai. 2012), és a DAT-ot nélkülöző egerek rezisztensek a metamfetamin neuronális toxicitásával szemben (Fumagalli és mtsai. 1998). Annak ismerete, hogy a mefedron nem neurotoxikus és DAT-blokkoló, ahhoz a jóslathoz vezet, hogy meg kell előznie a toxicitást. Pozitív kontrollként teszteltük a nomifenzint ebben a tekintetben, és megerősítettük, hogy véd a DA, DAT és TH metamfetamin által kiváltott kimerülésével szemben. A nomifenzin gátolja a noradrenalin-transzportert is (Brogden és mtsai. 1979), de ez a tulajdonsága nem magyarázhatja a jelen eredményeket, mivel a legtöbb β-ketoamfetamin, beleértve a mefedront is, gátolja a noradrenalin-transzportert és blokkolja a noradrenalin felvételét (Kelly 2011, Rothman és mtsai. 2003, Cozzi és mtsai. 1999, Sogawa és mtsai. 2011, Lopez-Arnau és mtsai. 2012). Az 5-HT neuronális rendszer szerepe a mefedron egyes farmakológiai hatásaiban lehetséges, tekintettel arra, hogy ez a gyógyszer, az MDMA-hoz hasonlóan (Yamamoto et al. 1995), képes a striatális DA kiáramlását okozni az 5-HT2A receptorokkal való kölcsönhatásán keresztül (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). A mefedron által okozott hiperlokomóció az endogén 5-HT-től függ (Lopez-Arnau et al. 2012), és ez a gyógyszer in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) és in vivo (Baumann et al. 2012, Kehr et al. 2011) is stimulálja az 5-HT felszabadulását és gátolja a felvételét. Azzal azonban kizárhatjuk az endogén 5-HT szerepét legalább a metamfetamin DA neurotoxicitásában, hogy kimutattuk, hogy az 5-HT-ben genetikailag szegényített egerek megőrzik a neurotoxicitással szembeni érzékenységüket (Thomas és mtsai. 2010).
A mefedron több lehetséges mechanizmus révén fokozhatja a metamfetamin neurotoxicitását. Először is, a mefedron kölcsönhatásba léphet a VMAT-tal, hogy DA szivárgását okozza a preszinaptikus idegvégződés citoplazmájába. Azok a kezelések, amelyek növelik a DA citoplazmatikus poolját (azaz a gyógyszerrel szabaddá tehető), növelik a metamfetamin neurotoxicitást (Thomas és mtsai. 2008, Thomas és mtsai. 2009, Schmidt és mtsai. 1985). Ez a mechanizmus nem valószínű, mivel a metkatinon csak gyenge kölcsönhatásba lép a VMAT-tal (Cozzi és mtsai. 1999). Másodszor, a mefedron és a metamfetamin kombinációja szinergista hatást gyakorolhat a DA nem-vesikuláris felszabadulására, de ez a lehetőség szintén valószínűtlennek tűnik azon eredmények fényében, amelyek azt mutatják, hogy a DAT- vagy SERT-expresszáló CHO-sejtek metilonnal és metamfetaminnal történő kezelése nem gyakorol additív hatást a DA vagy 5-HT felszabadulására (Sogawa et al. 2011). Harmadszor, a mefedron újszerű módon léphet kölcsönhatásba a DAT-tal, ami hozzájárul az additív toxicitáshoz. Kimutatták, hogy a metephedron metamfetaminnal kombinálva szinergista citotoxicitást okoz a DAT-ot vagy SERT-et expresszáló CHO sejtekben, de nem a vad típusú CHO sejtekben, amelyekből hiányoznak a transzporterek (Sogawa et al. 2011). A tenyésztett sejtekben ezekben a vizsgálatokban megfigyelt citotoxicitás (azaz LDH felszabadulás) nagyon különbözik a DA idegvégződések metamfetamin által okozott károsodásától, de ez a mechanizmus a DAT érdekes, de meghatározatlan szerepére utal a fokozott citotoxicitásban. Végül a mefedron megváltoztathatja a metamfetamin metabolizmusát. A mefedron elsősorban N-demetilációval metabolizálódik (Meyer és Maurer 2010), akárcsak a metamfetamin és az MDMA (Caldwell 1976). Ezt a mechanizmust alátámasztja annak kimutatása, hogy a metamfetamin és az MDMA kölcsönösen gátolja a saját elsődleges metabolitjaik termelődését, és a kábítószer plazmaszintjét a bármelyik hatóanyag önmagában történő beadása után tapasztalt szintek fölé emeli (Kuwayama et al. 2012). A jelenleg és a korábbi vizsgálatunkban (Angoa-Perez et al. 2012) használt mefedron dózisok, bár magasak, nem neurotoxikusak, és az emberek által használt dózisok tartományába esnek (McErath and O'Neill 2011). Ezért a mefedron az MDMA-hoz hasonlóan hathat a metamfetamin plazmaszintjének növelésére azáltal, hogy gátolja annak metabolizmusát. Ez utóbbi lehetőség megerősítéséhez alapos farmakokinetikai elemzésre lesz szükség.
A β-ketoamfetaminokkal való visszaélés riasztó mértékben növekszik, és a mefedron ma már a kannabisz, az MDMA és a kokain után az egyik leggyakrabban használt kábítószer (Morris 2010, Winstock és mtsai. 2011b). Ráadásul a mefedron az MDMA-hoz képest erősebb vágyérzetet vált ki az emberekben (Brunt et al. 2011), és a mefedront szippantó felhasználók a kokainnál is addiktívabbnak ítélik meg (Winstock et al. 2011b). A mefedront az emberek binge-szerű módon fogyasztják (azaz "stacking"), és gyakran más drogokkal, például kannabisz és az amfetamin pszichostimulánsokkal együtt fogyasztják (Schifano et al. 2011, Fass et al. 2012, Winstock et al. 2011a, Kelly 2011, Torrance and Cooper 2010). A mefedront egyre gyakrabban találjuk meg az MDMA-ként árult tablettákban (Brunt et al. 2011), és a használata valószínűleg meghaladja majd az MDMA-ét, mivel ez utóbbi kábítószer tisztasága tovább csökken (Brunt et al. 2011, Tanner-Smith 2006, Teng et al. 2006). A mefedron és más "fürdősók" összetevőinek gyakori visszaélési mintái alapján fontos megfontolni, hogy az embereknél további egészségügyi kockázatok merülnek-e fel, ha ezeket a drogokat szándékosan vagy akaratlanul kombinálják az amfetaminokkal. Eredményeink, amelyek azt mutatják, hogy legalább a mefedron jelentősen fokozza a metamfetamin, az amfetamin és az MDMA által a striatum DA idegvégződéseiben okozott neurotoxicitást, ennek a β-ketoamfetaminnak egy különösen veszélyes és váratlan tulajdonságát tárják fel.
Használt rövidítések
5-HT szerotonin
DA dopamin
DAT DA transzporter
MDMA 3,4-metiléndioximetamfetamin
TH tirozin-hidroxiláz
VMAT vezikuláris monoamin transzporter