G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,660
- Solutions
- 3
- Reaction score
- 2,736
- Points
- 113
- Deals
- 1
Introduzione
L'acido lisergico, il frammento di base derivato dagli alcaloidi della segale cornuta, è stato sintetizzato in quattordici sequenze a partire dal 3-beta-carbossietilindolo. Il materiale di partenza è stato convertito nell'intermedio 1-benzoil-5-cheto-1,2,2a-3,4,5-esaidrobenz-[cd]-indolo (3), contenente tre dei quattro anelli presenti nell'acido lisergico. Questo chetone è stato a sua volta trasformato nel composto tetraciclico 9-cheto-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fe]-chinolina (8) e quindi in acido lisergico (14). Questa sintesi non è semplice e richiede molta esperienza di laboratorio e conoscenze chimiche. Inoltre, ci sono diverse manipolazioni con sostanze pericolose, che devono essere eseguite con rigorose misure di sicurezza.
Punto di ebollizione: 536,2±50,0 °C a 760 mm Hg;
Punto di fusione: 240 °C;
Peso molecolare: 268,31 g/mole;
Densità: 1,4 ± 0,1 g/mL;
Numero CAS: 82-58-6.
Apparecchiature e vetreria:
- Reattore di idrogenazione in acciaio da 2-3 L;
- Autoclave in acciaio da 500 mL;
- Bilancia da laboratorio (adatta da 0,01 a 500 g);
- Palloni a fondo tondo da 100, 200, 500 mL, 5 e 10 L;
- Compressore e origine dell'idrogeno (H2);
- Pallone Buchner e imbuto (grande) da 5 L [per piccole quantità si può usare il filtro Schott];
- Macchina Rotovap (grande);
- Fonte di vuoto;
- Imbuti separatori da 500 mL e 2 L;
- Pallone di azoto ~50-70 L (1 bar);
- Tappi a setto per le beute;
- Bagno di acqua ghiacciata salata;
- 5 L x2, 2 L x2; 1 L x2; 500 mL x2; 100 mL x3; 50 mL x2 Becher;
- Siringa di vetro o pipetta Pasteur;
- Agitatore magnetico o agitatore superiore;
- Set di distillazione sottovuoto;
- Condensatore a ricaduta;
- Supporto per storta e morsetto per fissare l'apparecchiatura;
- Termometro da laboratorio (da -20 °C a 200 °C) con adattatore per matraccio;
- Carta indicatrice di pH;
- Asta di vetro e spatola;
- lampadina da 250 watt.
Reagenti.
- Acido 3-Indolepropionico (1), 94,6 g (0,5 mol);
- 9,5 L Acqua distillata (H2O);
- ~400 g di idrossido di sodio (NaOH);
- 116 g di nichel Raney (Ni);
- 1050 mL di acido cloridrico (HCl) concentrato;
- 2 mL di acido solforico (H2SO4 conc.);
- 210 mL di soluzione acquosa di idrossido di sodio (NaOH) 12N;
- 180 mL cloruro di benzoile;
- ~1,5 L Metanolo (MeOH);
- ~1,6 L Etanolo (EtOH);
- 201,2 mL cloruro di tionile (SOCl2);
- 1950 mL Disolfuro di carbonio (CS2);
- 240 g Cloruro di alluminio (AlCl3);
- 2,5 L Benzene;
- 500 mL Idrossido di sodio 2N (NaOH);
- ~3,2 L Etere dietilico (Et2O);
- 3,3 L Acido acetico glaciale (AcOH);
- 352 g (1,1 mol) di perbromuro di piridina;
- 5 L Cloroformio (CHCl3);
- ~1000 g Solfato di magnesio (MgSO4);
- 307 g (2,35 mol) Metilaminoacetone etilenico (5);
- 4,5 L Benzene;
- ~500 g Carbone attivo (C);
- ~1 L Acetone;
- ~500 g Bicarbonato di sodio (NaHCO3);
- 80 mL Anidride acetica fredda (Ac2O);
- 1,5 g Boroidruro di sodio (NaBH4);
- 75 mL Anidride solforosa (SO2 liquida);
- 40 g Cianuro di sodio (NaCN in polvere);
- 300 mL di cianuro di idrogeno (HCN liquido);
- 78 mL Soluzione acquosa di idrossido di potassio (KOH) all'1,5%;
- 8,5 g Arseniato di sodio idrato;
- ~ 50 mL di Xilene;
- 100 mL Soluzione diluita di idrossido di ammonio (NH4OH);
- 16,9 g di metossido di sodio (MeONa).
Procedura
1-Benzoil-3-(beta-carbossietil)-2,3-diidroindolo (2)L'acido 3-Indolepropionico (1), 94,6 g (0,5 mol), è stato sciolto in 600 mL di acqua contenente 20 g di idrossido di sodio. La soluzione è stata miscelata con circa 100 g di catalizzatore al nichel Raney e idrogenata a RT in una bomba di idrogenazione in acciaio da 2-3 L alla pressione di 3000-4000 psi (207-276 bar) H2. La riduzione è stata generalmente completata in 20-30 ore, dopodiché il catalizzatore è stato filtrato e lavato con un po' d'acqua. Al filtrato è stato aggiunto acido HCl concentrato, 85 mL, e la soluzione è stata raffreddata. Se la riduzione era incompleta, l'acido indolepropionico non reagito si è separato a questo punto ed è stato rimosso per filtrazione. Il filtrato è stato quindi benzoilato con la consueta procedura Schotten-Baumann, utilizzando 210 mL di idrossido di sodio 12N e 180 mL di cloruro di benzoile. La soluzione è stata mantenuta alcalina per tutta la durata della benzoilazione e la temperatura è stata mantenuta sotto i 40 °C mediante raffreddamento. Quando il cloruro di benzoile ha reagito completamente, la miscela è stata raffreddata e acidificata con 300 mL di acido HCl concentrato. Il prodotto grezzo è stato filtrato e lavato con acqua, dopodiché è stato estratto con 4 porzioni da 1 L di acqua calda per rimuovere l'acido benzoico. Il prodotto sciropposo caldo (2), dopo decantazione dell'estratto acquoso, è stato cristallizzato da alcuni volumi di metanolo; resa 103 g (70 %), MP: 151-153 °C.
1-Benzoil-5-cheto-1,2,2a,3,4,5-esaidrobenz-[cd]-indolo (3)
1-Benzoil-3-(beta-carbossietil)-2,3-diidroindolo (2), 118 g (0,4 mol), è stato miscelato con 200 mL di cloruro di tionile puro. La soluzione è stata lasciata riposare per 30 minuti, dopodiché è stata riscaldata dolcemente per 15-20 minuti su un bagno di vapore. L'eccesso di cloruro di tionile è stato evaporato completamente sotto 30 °C in vacuo e il cloruro acido grezzo è stato sciolto in 200 mL di disolfuro di carbonio. La soluzione di cloruro acido è stata quindi aggiunta in un flusso sottile a una sospensione agitata vigorosamente di 240 g di cloruro di alluminio in 1750 mL di solfuro di carbonio contenuta in un matraccio da 5 L (in HOOD!!!). Si è separato un complesso e l'agitazione è diventata difficile. La miscela è stata riscaldata a riflusso e agitata per un'ora per completare la reazione, dopodiché è stata decomposta con molta attenzione aggiungendo 500 g di ghiaccio, 250 mL di acido HCl conc. e 500 mL di acqua. Durante la decomposizione è stata mantenuta l'agitazione e il raffreddamento è stato influenzato dalla distillazione periodica del solfuro di carbonio in vacuo e il prodotto è stato estratto con 2 L di benzene. L'estratto è stato lavato accuratamente con 500 mL di idrossido di sodio 2N in tre porzioni e poi con acqua. È stato essiccato su solfato di magnesio e poi evaporato a piccolo volume in vacuo. L'aggiunta lenta di diversi volumi di etere ha provocato la cristallizzazione del chetone giallo (3) . È stato filtrato e lavato con etere; resa 85,3 g (77%), MP: 146-147 °C. Un campione è stato ricristallizzato per l'analisi da benzene-etere.
1-Benzoil-3-(beta-carbossietil)-2,3-diidroindolo (2), 118 g (0,4 mol), è stato miscelato con 200 mL di cloruro di tionile puro. La soluzione è stata lasciata riposare per 30 minuti, dopodiché è stata riscaldata dolcemente per 15-20 minuti su un bagno di vapore. L'eccesso di cloruro di tionile è stato evaporato completamente sotto 30 °C in vacuo e il cloruro acido grezzo è stato sciolto in 200 mL di disolfuro di carbonio. La soluzione di cloruro acido è stata quindi aggiunta in un flusso sottile a una sospensione agitata vigorosamente di 240 g di cloruro di alluminio in 1750 mL di solfuro di carbonio contenuta in un matraccio da 5 L (in HOOD!!!). Si è separato un complesso e l'agitazione è diventata difficile. La miscela è stata riscaldata a riflusso e agitata per un'ora per completare la reazione, dopodiché è stata decomposta con molta attenzione aggiungendo 500 g di ghiaccio, 250 mL di acido HCl conc. e 500 mL di acqua. Durante la decomposizione è stata mantenuta l'agitazione e il raffreddamento è stato influenzato dalla distillazione periodica del solfuro di carbonio in vacuo e il prodotto è stato estratto con 2 L di benzene. L'estratto è stato lavato accuratamente con 500 mL di idrossido di sodio 2N in tre porzioni e poi con acqua. È stato essiccato su solfato di magnesio e poi evaporato a piccolo volume in vacuo. L'aggiunta lenta di diversi volumi di etere ha provocato la cristallizzazione del chetone giallo (3) . È stato filtrato e lavato con etere; resa 85,3 g (77%), MP: 146-147 °C. Un campione è stato ricristallizzato per l'analisi da benzene-etere.
1-Benzoyl-4-bromo-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indole (4)
1-Benzoil-2,2a,3,4-tetraidro-4-[metil-(2-metil-1,2-diossolan-2-il-metil)-amino]-benz-[cd]-indolo-5-(1H)-one (6)
Una soluzione di 270 g (0,76 mol) di 1-benzoil-4-bromo-5-cheto-1,2,2a,3,4,5-esaidrobenz-[cd]-indolo(4) e di 307 g (2.35 mol) di metilaminoacetone etilenico (5) in 4500 mL di benzene secco sono stati fatti rifluire sotto azoto per 21 h in RBF da 10 L con condensatore a riflusso. La miscela è stata raffreddata e sono stati filtrati 151 g (93,5%) di metilaminoacetone etilenchetobromuro, MP: 158-159 °C.
Il filtrato è stato lavato più volte con acqua ghiacciata, dopodiché è stato estratto con 2,5 L di acido HCl diluito freddo contenente 150 mL di acido concentrato. Gli estratti acidi sono stati immediatamente aggiunti a un eccesso di idrossido di sodio diluito freddo. Il prodotto è stato estratto con 1 L di cloroformio e la soluzione di cloroformio è stata essiccata su solfato di magnesio, trattata con carbone e concentrata in vacuo. Il cheto-chetone residuo (6) è stato cristallizzato da acetone; MP: e miscela MP: 135-136 °C, resa 220 g (71 %).
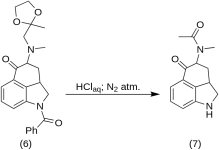
5-Keto-4-[N-metil-N-acetonilammino]-1,2,2a,3,4,5-esaidrobenz-[cd]-indolo (7)
20 g di 1-benzoil-2,2a,3,4-tetraidro-4-[metil-(2-metil-1,3-dioxolan-2-il-metil)-amino]-benz-[cd]-indolo-5-(1H)-one (6) è stato sciolto in una miscela di 250 mL di acido HCl concentrato e 250 mL di acqua; la soluzione è stata mantenuta sotto azoto a 37 °C in 3-5 L RBF per cinque giorni. La miscela è stata raffreddata, trattata con carbone, filtrata e il filtrato è stato concentrato in vacuo a piccolo volume. Il residuo è stato trattato con un eccesso di bicarbonato di sodio; il prodotto è stato estratto con cloroformio freddo e il solvente è stato rimosso in vacuo a RT. Il dichetone grezzo (7) è stato polverizzato, sbattuto con circa 75 mL di benzene-etere 1:1 e filtrato; resa 9,8 g (77%), MP: 105-107 °C. Un campione da analizzare è stato ricristallizzato da benzene-etere o etanolo; MP: 109-110 °C; un monocloruro è stato ottenuto da etanolo diluito; MP: 200 °C dec.
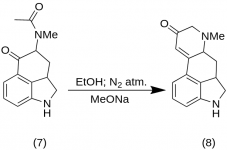
9-Keto-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (8)
25 g di 5-Keto-4-[N-metil-N-acetonil]-amino-1,2,2a,3,4,5-esaidrobenz-[cd]-indolo (7) sono stati miscelati con 550 mL di etanolo assoluto. La miscela è stata agitata sotto azoto e raffreddata a -15 °C in 2-5 L di RBF. È stato quindi aggiunto metossido di sodio, 16,9 g, e la miscela è stata agitata a -10 °C - -12 °C per dieci minuti. La miscela di reazione è stata raffreddata a -25 °C e il prodotto è stato filtrato su un imbuto di Buchner da 6,5 pollici e lavato con un po' di etanolo freddo e di etere. Con la minima esposizione all'aria (contiene metossido di sodio!), il chetone grezzo (8) è stato immediatamente filtrato con un po' di acqua ghiacciata. È stato lavato con acqua ghiacciata, etanolo ed etere; resa 16,2 g (69 %), MP: 145-147 °C. Un campione analitico è stato ricristallizzato da etanolo diluito; MP: 155-157 °C; il diidrocloruro è stato preparato e ricristallizzato da acetone acquoso; MP: 270 °C dec.
4-Acetil-9-cheto-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (9)
9-Keto-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (8), 24 g, è stato aggiunto a 80 mL di anidride acetica fredda. La miscela è stata mantenuta a 25 °C in 200 mL di RBF per circa 5 minuti, dopodiché è stata accuratamente raffreddata e il prodotto (9) è stato filtrato e lavato con etere; resa 20,5 g (76 %), mp: 167-170 °C. Una seconda coltura è stata ottenuta per evaporazione del filtrato; questo ha portato la resa totale all'82%. Un campione è stato ricristallizzato da acetone-etanolo; MP: 169-170 °C; Il cloridrato è stato preparato in etanolo ed è stato ricristallizzato da etanolo acquoso; MP: 250 °C dec.
9-Keto-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (8), 24 g, è stato aggiunto a 80 mL di anidride acetica fredda. La miscela è stata mantenuta a 25 °C in 200 mL di RBF per circa 5 minuti, dopodiché è stata accuratamente raffreddata e il prodotto (9) è stato filtrato e lavato con etere; resa 20,5 g (76 %), mp: 167-170 °C. Una seconda coltura è stata ottenuta per evaporazione del filtrato; questo ha portato la resa totale all'82%. Un campione è stato ricristallizzato da acetone-etanolo; MP: 169-170 °C; Il cloridrato è stato preparato in etanolo ed è stato ricristallizzato da etanolo acquoso; MP: 250 °C dec.
4-Acetil-9-idrossi-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (10)
10 g di 4-acetil-9-keto-7-metil-4,5,5a,6,6a,7,8,9-ottaidrossindolo-[4,3-fg]-chinolina (9) sono stati aggiunti a una miscela di 150 mL di metanolo e 10 mL di acqua in 500 mL di RBF. È stata aggiunta boroidride di sodio, 1,5 g, e la reazione è stata lasciata procedere a RT fino a volume ridotto, quindi è stata aggiunta una miscela di 15 mL di acido HCl conc. e 60 mL di acqua. Il cloridrato (10) che si è separato al raffreddamento è stato filtrato e lavato con metanolo, 9,0 g (79 %). Un campione è stato ricristallizzato da etanolo diluito; MP: 245-246 °C dec.
4-Acetil-9-cloro-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina cloridrato (11)
4-Acetil-9-idrossi-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina cloridrato (10), 3.1 g, sono stati disciolti in 75.000 g (79%).1 g, è stato sciolto in 75 mL di anidride solforosa liquida contenuta in una camicia di vetro in un'autoclave di acciaio da 500 mL. È stato aggiunto cloruro di tionile, 1,2 mL, e il recipiente è stato sigillato e mantenuto a 25 °C per 6 h. L'autoclave è stata sfiatata e la miscela di reazione è stata rimossa. L'anidride solforosa è stata lasciata evaporare mentre il volume della soluzione è stato mantenuto costante con l'aggiunta lenta di etere secco. Il cloridrato amorfo (11) è stato filtrato, lavato con etere ed essiccato in vacuo, MP: 130-135 °C dec. Resa 3,5 g. L'uso dell'alcol 9-beta-epimerico in questa reazione ha dato lo stesso cloruro in resa comparabile.
4-acetil-9-ciano-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (12)
Il cianuro di sodio secco in polvere, 40 g, è stato aggiunto a 300 mL di acido cianidrico liquido ghiacciato. La miscela è stata agitata e raffreddata in ghiaccio, quindi sono stati aggiunti 7,5 g del cloridrato amorfo grezzo di 4-acetil-9-cloro-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo [4,3f/g]-chinolina (11) . L'agitazione è stata proseguita in 500 mL di RBF per 30 minuti, dopodiché l'acido cianidrico è stato rapidamente distillato a pressione ridotta a circa 10 °C. Il residuo è stato miscelato con cloruro di potassio. Il residuo è stato mescolato con cloroformio e acqua ghiacciata e la miscela risultante è stata filtrata. Lo strato organico è stato separato e la fase acquosa è stata estratta due volte con cloroformio. Gli estratti combinati sono stati essiccati su solfato di magnesio, decolorati e il solvente è stato distillato in vacuo. Il prodotto (12) è stato cristallizzato da acetato di etile; resa 3,3 g. (54% in totale sulla base del cloridrato di alcool), m.p. 172-174 °C. Laricristallizzazione dallo stesso solvente ha portato il m.p. a 181-182 °C.
Il cianuro di sodio secco in polvere, 40 g, è stato aggiunto a 300 mL di acido cianidrico liquido ghiacciato. La miscela è stata agitata e raffreddata in ghiaccio, quindi sono stati aggiunti 7,5 g del cloridrato amorfo grezzo di 4-acetil-9-cloro-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo [4,3f/g]-chinolina (11) . L'agitazione è stata proseguita in 500 mL di RBF per 30 minuti, dopodiché l'acido cianidrico è stato rapidamente distillato a pressione ridotta a circa 10 °C. Il residuo è stato miscelato con cloruro di potassio. Il residuo è stato mescolato con cloroformio e acqua ghiacciata e la miscela risultante è stata filtrata. Lo strato organico è stato separato e la fase acquosa è stata estratta due volte con cloroformio. Gli estratti combinati sono stati essiccati su solfato di magnesio, decolorati e il solvente è stato distillato in vacuo. Il prodotto (12) è stato cristallizzato da acetato di etile; resa 3,3 g. (54% in totale sulla base del cloridrato di alcool), m.p. 172-174 °C. Laricristallizzazione dallo stesso solvente ha portato il m.p. a 181-182 °C.
9-Carbometossi-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (13)
Il prodotto (12) appena descritto, 1,0 g, è stato miscelato con 15 mL di metanolo e 0,25 mL di acqua. La miscela è stata raffreddata e sono stati aggiunti lentamente 2 mL di acido solforico concentrato. La soluzione è stata sigillata in una provetta di vetro sotto azoto e riscaldata a 100 °C per 23-24 h in 100 mL di RBF con condensatore a riflusso. La miscela è stata trattata con carbone decolorato e poi concentrata in vacuo a circa 10 mL. È stata versata su una miscela di cloroformio (30 mL), ghiaccio e 10 g di bicarbonato di sodio. Lo strato di cloroformio è stato separato e la fase acquosa è stata estratta con 3 porzioni da 10 mL di cloroformio. Gli estratti combinati sono stati essiccati su solfato di magnesio, evaporati a secco e il prodotto (13) è stato cristallizzato da benzene; resa 0,51 g (53 %), MP: 159-160 °C. È stato ricristallizzato da acetato di etile; MP: 160-161 °C.
Il prodotto (12) appena descritto, 1,0 g, è stato miscelato con 15 mL di metanolo e 0,25 mL di acqua. La miscela è stata raffreddata e sono stati aggiunti lentamente 2 mL di acido solforico concentrato. La soluzione è stata sigillata in una provetta di vetro sotto azoto e riscaldata a 100 °C per 23-24 h in 100 mL di RBF con condensatore a riflusso. La miscela è stata trattata con carbone decolorato e poi concentrata in vacuo a circa 10 mL. È stata versata su una miscela di cloroformio (30 mL), ghiaccio e 10 g di bicarbonato di sodio. Lo strato di cloroformio è stato separato e la fase acquosa è stata estratta con 3 porzioni da 10 mL di cloroformio. Gli estratti combinati sono stati essiccati su solfato di magnesio, evaporati a secco e il prodotto (13) è stato cristallizzato da benzene; resa 0,51 g (53 %), MP: 159-160 °C. È stato ricristallizzato da acetato di etile; MP: 160-161 °C.
Acido dl-lisergico sintetico (14)
Una miscela di 9-carbometossi-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (13), 3,9 g, e 78 mL di soluzione di idrossido di potassio all'1,5% è stata fatta rifluire per 30 min sotto azoto. È stato aggiunto arseniato di sodio idrato, 8,5 g, e nichel Raney (16 g, umido), precedentemente disattivato mediante bollitura in sospensione di xilene; la miscela è stata riscaldata a riflusso e agitata in atmosfera di azoto per 20 ore in 200 mL di RBF con condensatore a riflusso. La soluzione è stata trattata con carbone e l'acido lisergico grezzo (14) è stato precipitato mediante neutralizzazione a pH 5,6. È stato filtrato e lavato con acqua; resa 1,04 g, MP: 240-242 °C dec. È stato ottenuto anche un secondo raccolto, 0,16 g, MP: 233-235 °C dec.; resa totale 30%. L'acido ha potuto essere purificato sciogliendolo in idrossido di ammonio diluito, trattandolo con carbone decolorante e riprecipitandolo con anidride carbonica; MP: 242-243 °C dec; una miscela con acido dl-lisergico ottenuta da acido d-lisergico naturale era ugualmente 242-243 °C dec. L'acido anidro è stato ottenuto per essiccamento in vacuo per diverse ore a 150 °C.
Una miscela di 9-carbometossi-7-metil-4,5,5a,6,6a,7,8,9-ottaidroindolo-[4,3-fg]-chinolina (13), 3,9 g, e 78 mL di soluzione di idrossido di potassio all'1,5% è stata fatta rifluire per 30 min sotto azoto. È stato aggiunto arseniato di sodio idrato, 8,5 g, e nichel Raney (16 g, umido), precedentemente disattivato mediante bollitura in sospensione di xilene; la miscela è stata riscaldata a riflusso e agitata in atmosfera di azoto per 20 ore in 200 mL di RBF con condensatore a riflusso. La soluzione è stata trattata con carbone e l'acido lisergico grezzo (14) è stato precipitato mediante neutralizzazione a pH 5,6. È stato filtrato e lavato con acqua; resa 1,04 g, MP: 240-242 °C dec. È stato ottenuto anche un secondo raccolto, 0,16 g, MP: 233-235 °C dec.; resa totale 30%. L'acido ha potuto essere purificato sciogliendolo in idrossido di ammonio diluito, trattandolo con carbone decolorante e riprecipitandolo con anidride carbonica; MP: 242-243 °C dec; una miscela con acido dl-lisergico ottenuta da acido d-lisergico naturale era ugualmente 242-243 °C dec. L'acido anidro è stato ottenuto per essiccamento in vacuo per diverse ore a 150 °C.
Attachments
Last edited: