Il mefedrone (4-metilcatinone) è una droga stimolante β-chetoanfetaminica d'abuso con strette somiglianze strutturali e meccanicistiche con la metanfetamina. Una delle azioni più potenti associate al mefedrone è la capacità di stimolare il rilascio di dopamina (DA) e di bloccarne la ricaptazione attraverso l'interazione con il trasportatore di dopamina (DAT). Sebbene il mefedrone non causi tossicità alle terminazioni nervose della DA, la sua capacità di fungere da bloccante del DAT potrebbe fornire una protezione contro la neurotossicità indotta dalla metanfetamina, come altri inibitori del DAT. Per verificare questa possibilità, i topi sono stati trattati con mefedrone (10, 20 o 40 mg/kg) prima di ogni iniezione di un regime neurotossico di metamfetamina (4 iniezioni di 2,5 o 5,0 mg/kg a intervalli di 2 ore). L'integrità delle terminazioni nervose DA dello striato è stata valutata attraverso misure dei livelli di DA, DAT e tirosina idrossilasi. La tossicità DA da moderata a grave associata alle diverse dosi di metamfetamina non è stata prevenuta da nessuna dose di mefedrone, ma anzi è stata significativamente aumentata. L'ipertermia causata dal trattamento combinato con mefedrone e metamfetamina è stata la stessa osservata con uno dei due farmaci da soli. Il mefedrone ha anche potenziato gli effetti neurotossici dell'anfetamina e dell'MDMA sulle terminazioni nervose DA. Al contrario, la nomifensina ha protetto dalla neurotossicità indotta dalla metamfetamina. Poiché il mefedrone aumenta la neurotossicità della metamfetamina, i risultati attuali suggeriscono che interagisce con il DAT in un modo diverso da quello di altri inibitori tipici del DAT. Gli effetti relativamente innocui del mefedrone da solo sulle terminazioni nervose DA mascherano un'interazione potenzialmente pericolosa con le droghe con cui spesso viene coabitato, che porta a una maggiore neurotossicità.
Il mefedrone (4-metil-metacatinone) è un derivato del catinone e un analogo strutturale della metanfetamina e della 3,4-metilendiossimetanfetamina (MDMA). Il mefedrone è uno degli ingredienti psicoattivi dei "sali da bagno" insieme ad altri composti come il metilone, il butilone e il 3,4-metilendiossipirovalerone (MDPV). L'abuso di β-chetoanfetamine è in aumento a causa della disponibilità molto limitata dei precursori necessari per la sintesi di metanfetamina e MDMA nei laboratori clandestini e della corrispondente riduzione della loro purezza (Winstock et al. 2011b, Brunt et al. 2011). Poiché l'abuso di β-chetoanfetamine continua ad aumentare, l'elenco degli effetti avversi è cresciuto fino a includere complicazioni cardiovascolari, agitazione, insonnia, psicosi e depressione (Schifano et al. 2011, Prosser e Nelson 2012).
In quanto congeneri chimici della metanfetamina e dell'MDMA, non sorprende che le β-chetoanfetamine abbiano molti degli stessi effetti di queste prime droghe sul sistema nervoso centrale. Ad esempio, queste droghe bloccano i trasportatori di dopamina (DA) e serotonina (5-HT) (DAT e SERT, rispettivamente) (Cozzi et al. 1999, Rothman et al. 2003, Fleckenstein et al. 2000, Lopez-Arnau et al. 2012) e stimolano il rilascio di monoamine in vitro (Kalix e Glennon 1986, Gygi et al. 1997, Rothman et al. 2003) e in vivo (Gygi et al. 1997, Kehr et al. 2011). Il metacatinone causa riduzioni persistenti dell'attività della triptofano idrossilasi e della tirosina idrossilasi (TH) e una deplezione di DA e 5-HT (Gygi et al. 1997, Gygi et al. 1996, Sparago et al. 1996). Studi di imaging PET in consumatori astinenti di metacatena hanno rivelato una ridotta densità del DAT striatale che suggerisce una perdita di terminali DA (McCann et al. 1998). La stimolazione simultanea del rilascio di DA e l'inibizione della sua captazione rispecchiano gli elementi critici alla base della neurotossicità associata alla metanfetamina (Kuhn et al. 2008, Yamamoto e Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Noi (Angoa-Perez et al. 2012) e altri (Baumann et al. 2012, Hadlock et al. 2011) abbiamo recentemente studiato la possibilità che il mefedrone possa causare neurotossicità come la metamfetamina e l'MDMA. Sorprendentemente, il mefedrone non è risultato tossico per le terminazioni nervose DA dello striato (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). La questione se il mefedrone danneggi le terminazioni nervose 5-HT rimane aperta, poiché uno studio ha documentato effetti positivi (Hadlock et al. 2011) mentre un altro è stato negativo (Baumann et al. 2012). Alla luce dell'effetto relativamente benigno del mefedrone sulle terminazioni nervose DA e considerando le sue proprietà di bloccante della DAT, abbiamo ipotizzato che possa effettivamente proteggere il sistema neuronale DA dagli effetti neurotossici della metamfetamina, come è noto che accade con altri bloccanti della DAT come l'acido anfonelico (Pu et al. 1994, Schmidt e Gibb 1985, Marek et al. 1990) e la nomifensina (Poth et al. 2012). Attualmente riportiamo che il mefedrone aumenta significativamente la neurotossicità della metamfetamina. Questo effetto si estende all'anfetamina e all'MDMA, droghe che sono spesso usate insieme al mefedrone (Feyissa e Kelly 2008, Schifano et al. 2011). Questi risultati sorprendenti gettano l'abuso di mefedrone sotto una nuova luce e aggiungono urgenza al riconoscimento di questa sottile e pericolosa proprietà di questa β-chetoanfetamina.
Materiali e metodi
Farmaci e reagenti
Il mefedrone cloridrato e la 3,4-metilendiossimetanfetamina (MDMA) sono stati ottenuti dal NIDA Research Resources Drug Supply Program. (+) Metamfetamina cloridrato, nomifensina maleato, d-anfetamina solfato, pentobarbital, DA e tutti i tamponi e i reagenti HPLC sono stati acquistati da Sigma-Aldrich (St. Louis, MO, USA). I kit per il dosaggio delle proteine dell'acido bicinchoninico sono stati acquistati da Pierce (Rockford, IL, USA). Gli anticorpi policlonali contro il TH di ratto sono stati prodotti come precedentemente descritto (Kuhn e Billingsley 1987). Gli anticorpi monoclonali contro la DAT di ratto sono stati generosamente forniti dalla dottoressa Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA). Gli anticorpi secondari anti-IgG coniugati con HRP sono stati forniti da Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA).
Animali
Le femmine di topo C57BL/6 (Harlan, Indianapolis, IN, USA), del peso di 20-25 g al momento della sperimentazione, sono state alloggiate 5 per gabbia in grandi gabbie a scatola da scarpe in una stanza con luce (12 ore di luce/buio) e temperatura controllata. Sono stati utilizzati topi di sesso femminile perché sono noti per essere molto sensibili ai danni neuronali causati dalle anfetamine neurotossiche e per mantenere la coerenza con i nostri precedenti studi sulla neurotossicità della metanfetamina (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). I topi avevano libero accesso a cibo e acqua. Il Comitato Istituzionale per la Cura e l'Uso della Wayne State University ha approvato la cura degli animali e le procedure sperimentali. Tutte le procedure erano inoltre conformi alla NIH Guide for the Care and Use of Laboratory Animals.
Procedure farmacologiche, fisiologiche e comportamentali
I topi sono stati trattati con mefedrone utilizzando un regime di binge-like composto da 4 iniezioni di 10, 20 o 40 mg/kg con un intervallo di 2 ore tra ogni iniezione. Questo regime di trattamento binge, quando viene utilizzato per iniettare anfetamine sostitutive e derivati del catinone, provoca un danno esteso alle terminazioni nervose DA. Le dosi di mefedrone utilizzate attualmente hanno dimostrato in precedenza di non essere tossiche per le terminazioni nervose DA (Angoa-Perez et al. 2012). I topi sono stati trattati con metanfetamina (4X 2,5 o 5 mg/kg), anfetamina (4X 5 mg/kg) o MDMA (4X 20 mg/kg) da soli o in combinazione con il mefedrone. Quando sono stati trattati con due farmaci, i topi hanno ricevuto un'iniezione di mefedrone 30 minuti prima di ciascuna delle 4 iniezioni di metanfetamina, anfetamina o MDMA. I controlli hanno ricevuto iniezioni di soluzione fisiologica secondo lo stesso schema utilizzato per il mefedrone da solo o in combinazione con altre anfetamine. Come controllo degli effetti di un inibitore del DAT sulla tossicità della metamfetamina, i topi sono stati trattati con nomifensina (4X 5 mg/kg) 30 minuti prima di ogni iniezione di metamfetamina (4X 5 mg/kg). Tutte le iniezioni sono state effettuate per via i.p.. I topi sono stati sacrificati 2 giorni dopo l'ultimo trattamento farmacologico, quando la neurotossicità associata all'anfetamina ha raggiunto il massimo. La temperatura corporea è stata monitorata mediante telemetria utilizzando i transponder di temperatura impiantabili IPTT-300 di Bio Medic Data Systems, Inc. (Seaford, DE, USA). Le temperature sono state registrate in modo non invasivo ogni 20 minuti, a partire da 60 minuti prima della prima iniezione di METH e continuando per le 9 ore successive, utilizzando il sistema di console DAS-5001 di Bio Medic.
Determinazione del contenuto di DA striatale
Il tessuto striatale è stato sezionato bilateralmente dal cervello dopo il trattamento e conservato a -80 °C. I tessuti congelati sono stati pesati e sonicati in 10 volumi di acido perclorico 0,16 N a 4 °C. Le proteine insolubili sono state rimosse mediante centrifugazione e la DA è stata determinata mediante HPLC con rivelazione elettrochimica come precedentemente descritto per la metamfetamina (Thomas et al. 2010, Thomas et al, 2009).
Determinazione dei livelli proteici di TH e DAT mediante immunoblotting
Gli effetti dei trattamenti farmacologici sui livelli striatali di TH e DAT sono stati determinati mediante immunoblotting come indice di tossicità per le terminazioni nervose DA striatali. I topi sono stati sacrificati per decapitazione dopo il trattamento e lo striato è stato sezionato bilateralmente. I tessuti sono stati conservati a -80°C. Il tessuto congelato è stato disgregato mediante sonicazione in 1% SDS a 95°C e il materiale insolubile è stato sedimentato mediante centrifugazione. Le proteine sono state determinate con il metodo dell'acido bicinchoninico e quantità uguali di proteine (70 μg/lane) sono state risolte mediante elettroforesi su gel di SDS-poliacrilammide e poi elettroblottate su nitrocellulosa. I blot sono stati bloccati in soluzione salina tamponata Tris contenente Tween 20 (0,1% v/v) e 5% di latte non grasso secco per 1 ora a temperatura ambiente. Gli anticorpi primari contro TH (1:1000) o DAT (1:1000) sono stati aggiunti ai blot e lasciati incubare per 16 ore a 4°C. I blot sono stati lavati 3 volte in soluzione fisiologica tamponata con Tris per rimuovere gli anticorpi non reagiti e quindi incubati con l'anticorpo secondario anti-IgG coniugato con HRP (1:4000) per 1 h a temperatura ambiente. Le bande immunoreattive sono state visualizzate mediante chemiluminescenza potenziata e le densità relative delle bande TH- e DAT-reattive sono state determinate mediante imaging con una Kodak Image Station (Carestream Molecular Systems, Rochester, NY, USA) e quantificate con il software ImageJ (NIH).
Analisi dei dati
Sono state eseguite ANOVA a due vie per analizzare gli effetti della dose di metamfetamina rispetto al mefedrone su DA, DAT e TH. Gli effetti dei trattamenti farmacologici sul contenuto striatale di DA, TH e DAT sono stati analizzati per verificarne la significatività mediante ANOVA a una via seguita dal test di confronto multiplo di Tukey. I risultati dei trattamenti farmacologici sulla temperatura corporea nel tempo sono stati analizzati utilizzando un'ANOVA a due vie seguita dal test di Bonferroni per determinare la significatività delle differenze di temperatura nei singoli momenti successivi al trattamento. Le differenze sono state considerate significative se p < 0,05. Tutte le analisi statistiche sono state effettuate utilizzando GraphPad Prism versione 5.02 per Windows (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Vai a:
Risultati
Effetti del mefedrone sulla neurotossicità indotta dalla metanfetamina
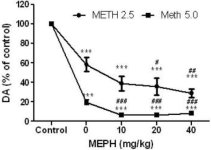
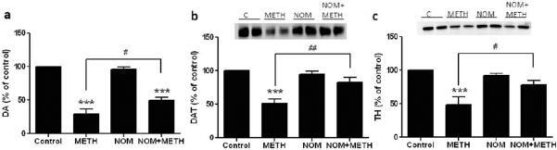
Il mefedrone, in dosi (10, 20 o 40 mg/kg) note per non causare tossicità delle terminazioni nervose DA (Angoa-Perez et al. 2012), è stato somministrato 30 minuti prima di ogni iniezione di metamfetamina. La metamfetamina è stata somministrata a dosi che causano danni moderati (4X 2,5 mg/kg) o gravi (4X 5 mg/kg) alle terminazioni nervose DA dello striato (Thomas et al. 2004, Thomas et al. 2010). I risultati presentati nella Fig. 1 mostrano che gli effetti principali della dose di metamfetamina (F1,40 = 66,60, p < 0,0001) e della dose di mefedrone (F4,40 = 131,3, p < 0,0001) sui livelli di DA nello striato sono risultati altamente significativi mediante ANOVA a due vie. Anche l'effetto principale del mefedrone somministrato in combinazione con 2,5 mg/kg (F4,22 = 35,96, p < 0,001) o 5,0 mg/kg di metamfetamina (F4,17 = 953,9, p < 0,0001) è risultato altamente significativo mediante ANOVA a una via. Tutti i trattamenti con una delle due dosi di metamfetamina ± mefedrone hanno causato riduzioni significativamente maggiori della DA rispetto al rispettivo controllo (p < 0,0001 per tutti). La Fig. 1 mostra anche che le dosi di mefedrone di 20 (p < 0,01) e 40 mg/kg (p < 0,001) hanno potenziato in modo significativo gli effetti depauperanti di 2,5 mg/kg di metamfetamina sulla DA, mentre tutte le dosi di mefedrone hanno potenziato in modo significativo gli effetti di 5,0 mg/kg di metamfetamina sui livelli di DA (p < 0,0001 per tutti).
Fig. 1
Effetti del mefedrone sulla riduzione della DA striatale indotta dalla metamfetamina. I topi sono stati trattati con le dosi indicate di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 2,5 (-) o 5,0 mg/kg (■) di metamfetamina (METH) e sacrificati 2d dopo per la determinazione dei livelli striatali di DA mediante HPLC. I dati sono medi ± SEM per 5-7 topi per gruppo. Alcune barre di errore erano troppo piccole per superare le dimensioni dei simboli e non appaiono visibili. ***p < 0,001 rispetto ai controlli e #p < 0,01, ##p < 0,001 o ###p < 0,0001 rispetto alla rispettiva dose di metamfetamina (test di confronto multiplo di Tukey).
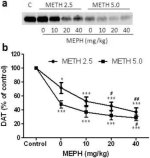
La Fig. 2a mostra che il mefedrone ha aumentato significativamente le riduzioni dei livelli di DAT indotte dalla metamfetamina, come determinato dall'immunoblotting. Gli immunoblotti sono stati quantificati e, in accordo con i risultati per la DA, gli effetti principali della dose di metamfetamina (F1,92 = 9,48, p < 0,001) e della dose di mefedrone (F4,92 = 37,56, p < 0,0001) sui livelli di DAT nello striato sono risultati altamente significativi mediante ANOVA a due vie (Fig. 2b). Anche l'effetto principale del mefedrone somministrato in combinazione con 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) o 5,0 mg/kg di metamfetamina (F4,39 = 24,84, p < 0,0001) è risultato altamente significativo mediante ANOVA a una via. Tutti i trattamenti con una delle due dosi di metamfetamina ± mefedrone hanno causato riduzioni significativamente maggiori del DAT rispetto al rispettivo controllo (p < 0,01 per 2,5 mg/kg di sola metamfetamina; p < 0,0001 per tutti gli altri trattamenti). La Fig. 2b mostra anche che le dosi di mefedrone di 20 mg/kg (p < 0,01) e 40 mg/kg (p < 0,001) hanno migliorato significativamente le riduzioni di DAT causate da 2,5 mg/kg di metamfetamina, mentre solo la dose di mefedrone di 40 mg/kg ha migliorato significativamente (p < 0,01) gli effetti di 5,0 mg/kg di metamfetamina sulle riduzioni di DAT.
Fig. 2
Effetti del mefedrone sulle riduzioni del DAT striatale indotte dalla metamfetamina. I topi sono stati trattati con le dosi indicate di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 2,5 (●) o 5,0 mg/kg (■) di metamfetamina (METH) e sacrificati 2d dopo per la determinazione dei livelli striatali di DAT mediante immunoblotting (a). I blot sono stati quantificati con ImageJ e i dati sono medi ± SEM per 10-12 topi per gruppo (b). *p < 0,01 o ***p < 0,0001 rispetto al controllo (C) e #p < 0,01 o ##p < 0,001 rispetto alla rispettiva dose di metamfetamina (test di confronto multiplo di Tukey).
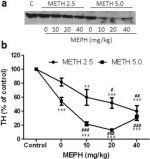
La Fig. 3a mostra che il mefedrone ha aumentato significativamente le riduzioni dei livelli di TH indotte dalla metamfetamina, come determinato dall'immunoblotting. Gli immunoblots sono stati quantificati e, in accordo con i risultati precedenti per DA e DAT, gli effetti principali della dose di metamfetamina (F1,81 = 47,89, p < 0,0001) e della dose di mefedrone (F4,81 = 63,57, p < 0,0001) sono risultati altamente significativi mediante ANOVA a due vie (Fig. 3b). L'effetto principale del mefedrone somministrato in combinazione con 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) o 5,0 mg/kg di metamfetamina (F4,49 = 99,16, p < 0,0001) è risultato altamente significativo anche con l'ANOVA a una via. Tutti i trattamenti con una delle due dosi di metamfetamina ± mefedrone hanno causato riduzioni significativamente maggiori di TH rispetto al rispettivo controllo (p < 0,001 per 2,5 mg/kg di metamfetamina + 10 mg/kg di mefedrone; p < 0,0001 per tutte le altre combinazioni), con l'eccezione di 2,5 mg/kg di metamfetamina da sola, che non ha modificato significativamente i livelli di TH (cioè, nessuna tossicità). La Fig. 3b mostra anche che le dosi di mefedrone di 20 mg/kg (p < 0,01) e 40 mg/kg (p < 0,001) hanno migliorato significativamente le riduzioni di TH causate da 2,5 mg/kg di metanfetamina e tutte e tre le dosi di mefedrone hanno migliorato significativamente (p < 0,0001) gli effetti di 5,0 mg/kg di metanfetamina sulle riduzioni di TH.
Fig. 3
Effetti del mefedrone sulle riduzioni di TH striatale indotte dalla metamfetamina. I topi sono stati trattati con le dosi indicate di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 2,5 (●) o 5,0 mg/kg (■) di metamfetamina (METH) e sacrificati 2d dopo per la determinazione dei livelli striatali di TH mediante immunoblotting (a). I blot sono stati quantificati con ImageJ e i dati sono medi ± SEM per 10-12 topi per gruppo (b). Alcune barre di errore erano troppo piccole per superare le dimensioni dei simboli e non appaiono visibili. **p < 0,001 o ***p < 0,0001 rispetto al controllo (C) e #p < 0,01, ##p < 0,001 o ###p < 0,0001) rispetto alla rispettiva dose di metamfetamina (test di confronto multiplo di Tukey).
Effetti del mefedrone sull'ipertermia indotta dalla metamfetamina
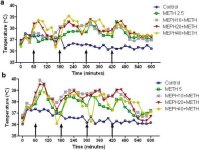
Il mefedrone, come la metamfetamina, causa una significativa ipertermia (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Quando il mefedrone è stato somministrato 30 minuti prima di ogni iniezione di metamfetamina, si può notare nella Fig. 4 che gli effetti principali delle dosi di metamfetamina e mefedrone (F1,300 = 11,99, p < 0,0001) sul tempo (F4,300 = 51,73, p < 0,0001) erano altamente significativi con l'ANOVA a due vie. Gli effetti principali del mefedrone somministrato in combinazione con 2,5 mg/kg di metamfetamina (F4.120 = 41,44, p < 0,0001, pannello a) nel tempo (F30.120 = 3,84, p < 0,0001) o 5,0 mg/kg di metamfetamina (F4.120 = 78,09, p < 0,0001, pannello b) nel tempo (F30.120 = 9,98, p < 0,0001) erano anch'essi altamente significativi mediante ANOVA a due vie. Tutti i trattamenti con entrambe le dosi di metamfetamina ± mefedrone erano significativamente diversi dai rispettivi controlli (p < 0,0001 per tutti i trattamenti).
Fig. 4
Effetti del mefedrone sull'ipertermia indotta dalla metamfetamina. I topi sono stati trattati con le dosi indicate di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 2,5 (a) o 5,0 mg/kg (b) di metamfetamina (METH). Le temperature del nucleo sono state misurate a intervalli di 20 minuti mediante telemetria a partire da 60 minuti prima della prima iniezione di metanfetamina. Le 4 iniezioni di metamfetamina sono indicate dalle frecce appoggiate sull'asse delle ascisse. I dati sono espressi come temperatura corporea media di 6-8 topi per gruppo. I SEM erano sempre < 10% della media e sono omessi per chiarezza.
Effetti del mefedrone sulla neurotossicità indotta da anfetamina e MDMA
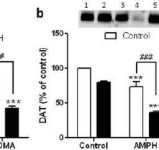
Per verificare se gli effetti potenzianti del mefedrone sulla metamfetamina potessero essere estesi ad altre anfetamine neurotossiche, i topi sono stati trattati con questa β-chetoanfetamina (20 mg/kg) più anfetamina (4X 5 mg/kg) o MDMA (4X 20 mg/kg) e i risultati sono presentati nella Fig. 5. Ricordiamo che il mefedrone di per sé non riduce la DA striatale, il DAT o il TH (Angoa-Perez et al. 2012). L'effetto principale del farmaco (F5,27 = 27,18, p < 0,0001) è risultato altamente significativo con l'ANOVA a una via per la riduzione della DA (Fig. 5a). La Fig. 5a mostra anche che tutti i trattamenti con anfetamina (p < 0,001) o MDMA (p < 0,001) da soli o in combinazione con mefedrone (p < 0,0001 per entrambi i farmaci) hanno ridotto significativamente i livelli di DA rispetto al controllo. Il mefedrone ha aumentato significativamente le riduzioni di DA causate dall'anfetamina (p < 0,01) o dall'MDMA (p < 0,01). La Fig. 5b mostra effetti simili dei trattamenti farmacologici combinati sui livelli di DAT nello striato. L'effetto principale della droga (F4,49 = 42,63, p < 0,0001) è stato altamente significativo con l'ANOVA a una via per il DAT. Nella Fig. 5b si può anche notare che tutti i trattamenti con anfetamina o MDMA erano significativamente (p < 0,0001 per tutti) inferiori rispetto al controllo. Anche il mefedrone ha aumentato significativamente le riduzioni del DAT causate dall'anfetamina o dall'MDMA (p < 0,0001 in entrambi i casi). Infine, la Fig. 5c mostra che l'effetto principale della droga (F4,50 = 75,06, p < 0,0001) era altamente significativo con l'ANOVA a una via per le riduzioni di TH. La Fig. 5c mostra anche che tutti i trattamenti con anfetamina o MDMA erano significativamente (p < 0,0001 per tutti) inferiori rispetto al controllo. Anche il mefedrone ha aumentato significativamente le riduzioni di TH causate dall'anfetamina o dall'MDMA (p < 0,0001 in entrambi i casi).
Fig. 5
Effetti del mefedrone sulla neurotossicità delle terminazioni nervose DA indotta da anfetamina o MDMA. I topi sono stati trattati con 20 mg/kg di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 5,0 mg/kg di anfetamina (AMPH) o 20 mg/kg di MDMA e sacrificati 2d dopo il trattamento per la determinazione dei livelli striatali di (a) DA mediante HPLC. (b) DAT e (c) TH sono stati determinati mediante immunoblotting e i blot sono stati quantificati utilizzando ImageJ. Gli immunoblots rappresentativi per DAT e TH sono inclusi come inserti nei pannelli (b) e (c) rispettivamente e i trattamenti per entrambi i pannelli sono indicati con 1,5: controllo; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; e 8: MDMA + MEPH. I dati sono medi ± SEM per 5-12 topi in ciascun gruppo. **p < 0,001 o ***p < 0,0001 vs controllo e #p < 0,01 o ###p < 0,0001 vs AMPH o MDMA (test di confronto multiplo di Tukey).
Effetti della nomifensina sulla neurotossicità indotta dalla metamfetamina
La nomifensina, un potente bloccante del DAT di cui non si conosce il potenziale di abuso o neurotossico, è stata testata per la sua capacità di proteggere dalla neurotossicità indotta dalla metamfetamina e per contrastare l'azione del mefedrone sulla tossicità delle terminazioni nervose DA causata da metamfetamina, anfetamina e MDMA. I risultati della Fig. 6a mostrano che l'effetto principale del farmaco (F3,16 = 63,39, p < 0,0001) sui livelli di DA è stato altamente significativo con l'ANOVA a una via. La nomifensina da sola non ha alterato i livelli di DA, ma la riduzione causata dalla metamfetamina (p < 0,0001) è stata leggermente ma significativamente invertita dalla nomifensina (p < 0,01). L'effetto principale del farmaco (F3,20 = 16,78, p < 0,0001) sui livelli di DAT è risultato altamente significativo con l'ANOVA a una via, come mostrato nella Fig. 6b. La nomifensina non ha modificato i livelli di DAT, ma ha fornito una protezione significativa (p < 0,001) contro la riduzione del DAT striatale causata dalla metamfetamina (p < 0,0001) rispetto al controllo. Infine, la Fig. 6c mostra che l'effetto principale del farmaco (F3,15 = 14,10, p < 0,0001) sui livelli di TH è stato altamente significativo mediante ANOVA a una via. Come visto per DA e DAT, la riduzione di TH causata dalla metamfetamina (p < 0,0001) è stata leggermente ma significativamente prevenuta dalla nomifensina (p < 0,01).
Fig. 6
Effetti della nomifensina sulla neurotossicità delle terminazioni nervose DA indotta dalla metamfetamina. I topi sono stati trattati con 5,0 mg/kg di nomifensina (NOM) 30 minuti prima di ogni iniezione di 5,0 mg/kg di metamfetamina (METH) e sacrificati 2d dopo per la determinazione dei livelli striatali di (a) DA mediante HPLC. (b) DAT e (c) TH sono stati determinati mediante immunoblotting e i blot sono stati quantificati utilizzando ImageJ. Gli immunoblots rappresentativi per DAT e TH sono inclusi come inserti nei pannelli (b) e (c). I dati sono medi più SEM per 5-7 topi per gruppo. ***p < 0,0001 rispetto al controllo (C) e #p < 0,01 o ##p < 0,001 rispetto alla sola metamfetamina (test di confronto multiplo di Tukey).
Discussione
Lo scopo del presente studio era quello di determinare se il mefedrone potesse prevenire la tossicità delle terminazioni nervose DA causata dalla metanfetamina. Sulla base della sua somiglianza chimica con la metamfetamina e l'MDMA, inizialmente ci si aspettava che il mefedrone esercitasse effetti dannosi sul sistema neuronale DA. Tuttavia, diversi studi hanno stabilito quasi contemporaneamente che il mefedrone non è tossico per le terminazioni nervose DA (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Resta aperta la questione se questa droga provochi danni al sistema neuronale 5-HT. Uno studio ha riportato riduzioni persistenti della funzione delle terminazioni nervose 5-HT (Hadlock et al. 2011), mentre un altro ha rilevato che il mefedrone non causa danni (Baumann et al. 2012). Il mefedrone interagisce con la terminazione nervosa DA in un modo che suggerisce che effettivamente stimola il rilascio e blocca la ricaptazione della DA attraverso le sue interazioni con il DAT. Un aspetto fondamentale del meccanismo d'azione neurotossico della metanfetamina è la sua capacità di accedere alle terminazioni nervose DA attraverso il DAT e di alterare l'omeostasi della DA (Sulzer 2011). Se questa fase iniziale della cascata neurotossica della metamfetamina viene impedita dall'inibizione del DAT, la tossicità viene prevenuta (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt e Gibb 1985). Abbiamo pensato che il mefedrone potesse avere questa stessa proprietà protettiva di altri inibitori della DAT, ma abbiamo osservato invece un significativo aumento della tossicità. Questa interazione è stata osservata utilizzando due diverse dosi di metamfetamina che causano danni moderati o gravi alle terminazioni nervose DA (4X 2,5 o 5,0 mg/kg, rispettivamente). Questo effetto potenziante del mefedrone non si limitava alla metamfetamina e si estendeva all'anfetamina e all'MDMA, due droghe che sono spesso usate insieme al mefedrone e ad altre β-chetoanfetamine (Feyissa e Kelly 2008, Schifano et al. 2011, Kelly 2011). Pertanto, nonostante il mefedrone non provochi tossicità almeno per le terminazioni nervose DA dello striato, potenzia gli effetti neurotossici di altre droghe d'abuso. Questa nuova scoperta dovrebbe porre l'abuso di mefedrone in termini ancora più crudi, perché la sua mancanza di neurotossicità intrinseca può farlo apparire innocuo.
L'ipertermia è un effetto negativo acuto comunemente riportato dall'ingestione di metanfetamina (Greene et al. 2008) e di β-chetoanfetamina nell'uomo (Borek e Holstege 2012, Prosser e Nelson 2012). Come la metanfetamina, anche molte droghe a base di β-chetoanfetamina causano aumenti significativi della temperatura interna nei roditori (Angoa-Perez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Sebbene l'ipertermia causata dalla metanfetamina possa contribuire ai suoi effetti morfologici e dannosi per i neuroni, non è detto che l'ipertermia sia la causa diretta di questi effetti (Kiyatkin e Sharma 2009). Abbiamo registrato la temperatura corporea centrale in topi trattati con mefedrone e metamfetamina e abbiamo osservato che il trattamento combinato non ha aumentato la temperatura oltre l'aumento massimo osservato dopo uno dei due farmaci da solo. La metamfetamina ha causato un aumento della temperatura corporea correlato alla dose e questa ipertermia è rimasta invariata per l'intero intervallo di dosi di mefedrone testato. Infatti, il calo della temperatura corporea post-iniezione osservato dopo il trattamento con mefedrone (Angoa-Perez et al. 2012) è stato mantenuto a dosi più elevate di mefedrone più metamfetamina. Anche se l'ipertermia indotta dalla droga non è stata potenziata dal trattamento combinato, gli effetti neurotossici sono stati additivi. Pertanto, almeno nel caso in esame, sembra che gli effetti neurotossici della metamfetamina possano essere potenziati dal mefedrone in modo indipendente dall'ipertermia.
Il mefedrone inibisce chiaramente la funzione del DAT e blocca la ricaptazione della DA in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). Il mefedrone spiazza il WIN-35,428 dal suo sito di legame sul DAT, suggerendo che si tratta di un inibitore competitivo dell'assorbimento di DA (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). La potenza del mefedrone in questo senso è molto simile a quella della metamfetamina (Cozzi et al. 1999) e dell'MDMA (Escubedo et al. 2011). Non è noto se il mefedrone sia trasportato dal DAT, mentre lo è il metacatinone (Cozzi e Foley 2003). La nomifensina e l'acido anfonelico, che si legano al DAT e inibiscono l'assorbimento della DA, forniscono una protezione sostanziale contro la neurotossicità indotta dalla metamfetamina (Pu et al. 1994, Marek et al. 1990, Schmidt e Gibb 1985, Poth et al. 2012) e i topi privi del DAT sono resistenti alla tossicità neuronale della metamfetamina (Fumagalli et al. 1998). Sapendo che il mefedrone non è neurotossico e che è un bloccante del DAT, si può prevedere che dovrebbe prevenire la tossicità. A questo proposito abbiamo testato la nomifensina come controllo positivo e abbiamo confermato che protegge dalla deplezione di DA, DAT e TH indotta dalla metamfetamina. La nomifensina inibisce anche il trasportatore della noradrenalina (Brogden et al. 1979), ma questa proprietà non può spiegare i risultati attuali perché la maggior parte delle β-chetoanfetamine, compreso il mefedrone, inibisce il trasportatore della noradrenalina e ne blocca l'assorbimento (Kelly 2011, Rothman et al. 2003, Cozzi et al. 1999, Sogawa et al. 2011, Lopez-Arnau et al. 2012). Un ruolo del sistema neuronale 5-HT in alcune delle azioni farmacologiche del mefedrone è possibile alla luce della capacità di questa droga, come l'MDMA (Yamamoto et al. 1995), di provocare un efflusso di DA striatale attraverso le sue interazioni con i recettori 5-HT2A (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). L'iperlocomozione causata dal mefedrone dipende dalla 5-HT endogena (Lopez-Arnau et al. 2012) e questo farmaco stimola anche il rilascio di 5-HT e ne inibisce l'assorbimento in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) e in vivo (Baumann et al. 2012, Kehr et al. 2011). Tuttavia, possiamo escludere un ruolo della 5-HT endogena nella neurotossicità DA almeno della metamfetamina dimostrando che i topi geneticamente privati della 5-HT mantengono la loro sensibilità alla neurotossicità (Thomas et al. 2010).
Il mefedrone potrebbe aumentare la neurotossicità della metamfetamina attraverso diversi possibili meccanismi. In primo luogo, il mefedrone potrebbe interagire con la VMAT per causare la fuoriuscita di DA nel citoplasma della terminazione nervosa presinaptica. I trattamenti che aumentano il pool citoplasmatico (cioè rilasciabile dal farmaco) di DA aumentano la neurotossicità della metamfetamina (Thomas et al. 2008, Thomas et al. 2009, Schmidt et al. 1985). Questo meccanismo non è probabile perché il metacatinone interagisce solo debolmente con il VMAT (Cozzi et al. 1999). In secondo luogo, la combinazione di mefedrone e metamfetamina potrebbe avere un effetto sinergico sul rilascio non-vescicolare di DA, ma anche questa possibilità sembra improbabile alla luce dei risultati che dimostrano che il trattamento di cellule CHO esprimenti DAT o SERT con metilone e metamfetamina non ha un effetto additivo sul rilascio di DA o 5-HT (Sogawa et al. 2011). In terzo luogo, il mefedrone potrebbe interagire con il DAT in un modo nuovo che contribuisce alla tossicità additiva. È stato dimostrato che il metilone, in combinazione con la metanfetamina, provoca una citotossicità sinergica in cellule CHO che esprimono il DAT o il SERT, ma non in cellule CHO wild type prive dei trasportatori (Sogawa et al. 2011). La citotossicità osservata nelle cellule in coltura in questi studi (cioè il rilascio di LDH) è molto diversa dal danno alle terminazioni nervose DA causato dalla metamfetamina, ma questo meccanismo suggerisce un ruolo interessante ma non definito per il DAT nell'aumento della citotossicità. Infine, il mefedrone potrebbe modificare il metabolismo della metamfetamina. Il mefedrone è metabolizzato principalmente per N-demetilazione (Meyer e Maurer 2010), come la metamfetamina e l'MDMA (Caldwell 1976). Questo meccanismo è supportato dalla dimostrazione che la metamfetamina e l'MDMA inibiscono reciprocamente la produzione dei rispettivi metaboliti primari ed elevano i livelli plasmatici della droga al di sopra di quelli osservati dopo la somministrazione di una delle due sostanze da sola (Kuwayama et al. 2012). Le dosi di mefedrone utilizzate attualmente e nel nostro precedente studio (Angoa-Perez et al. 2012), pur essendo elevate, non sono neurotossiche e rientrano nell'intervallo di abuso umano (McErath e O'Neill 2011). Pertanto, il mefedrone potrebbe agire come l'MDMA per aumentare i livelli plasmatici di metamfetamina inibendone il metabolismo. Per confermare quest'ultima possibilità sarà necessaria un'analisi farmacocinetica approfondita.
L'abuso di β-chetoanfetamine sta aumentando a un ritmo allarmante e il mefedrone è ora una delle droghe più comunemente usate dopo la cannabis, l'MDMA e la cocaina (Morris 2010, Winstock et al. 2011b). Inoltre, il mefedrone induce negli esseri umani una sensazione di desiderio più forte rispetto all'MDMA (Brunt et al. 2011) e i consumatori che sniffano il mefedrone lo considerano più coinvolgente della cocaina (Winstock et al. 2011b). Il mefedrone viene consumato dagli esseri umani in modo simile all'abbuffata (cioè "stacking") e viene spesso assunto insieme ad altre droghe come la cannabis e gli psicostimolanti anfetaminici (Schifano et al. 2011, Fass et al. 2012, Winstock et al. 2011a, Kelly 2011, Torrance e Cooper 2010). Il mefedrone si trova sempre più spesso in compresse vendute come MDMA (Brunt et al. 2011) e il suo uso probabilmente supererà quello dell'MDMA, dato che la purezza di quest'ultima droga continua a diminuire (Brunt et al. 2011, Tanner-Smith 2006, Teng et al. 2006). Sulla base dei modelli comuni di abuso di mefedrone e di altri ingredienti dei "sali da bagno", è importante considerare se si generano rischi aggiuntivi per la salute negli esseri umani quando queste droghe vengono combinate con le anfetamine, intenzionalmente o meno. I nostri risultati, che dimostrano che almeno il mefedrone potenzia in modo significativo la neurotossicità delle terminazioni nervose DA dello striato causata da metanfetamina, anfetamina e MDMA, rivelano una proprietà particolarmente pericolosa e inaspettata di questa β-chetoanfetamina.
Abbreviazioni utilizzate
5-HT serotonina
DA dopamina
DAT Trasportatore di DA
MDMA 3,4-metilendiossimetanfetamina
TH tirosina idrossilasi
VMAT Trasportatore vescicolare di monoammina
Il mefedrone (4-metil-metacatinone) è un derivato del catinone e un analogo strutturale della metanfetamina e della 3,4-metilendiossimetanfetamina (MDMA). Il mefedrone è uno degli ingredienti psicoattivi dei "sali da bagno" insieme ad altri composti come il metilone, il butilone e il 3,4-metilendiossipirovalerone (MDPV). L'abuso di β-chetoanfetamine è in aumento a causa della disponibilità molto limitata dei precursori necessari per la sintesi di metanfetamina e MDMA nei laboratori clandestini e della corrispondente riduzione della loro purezza (Winstock et al. 2011b, Brunt et al. 2011). Poiché l'abuso di β-chetoanfetamine continua ad aumentare, l'elenco degli effetti avversi è cresciuto fino a includere complicazioni cardiovascolari, agitazione, insonnia, psicosi e depressione (Schifano et al. 2011, Prosser e Nelson 2012).
In quanto congeneri chimici della metanfetamina e dell'MDMA, non sorprende che le β-chetoanfetamine abbiano molti degli stessi effetti di queste prime droghe sul sistema nervoso centrale. Ad esempio, queste droghe bloccano i trasportatori di dopamina (DA) e serotonina (5-HT) (DAT e SERT, rispettivamente) (Cozzi et al. 1999, Rothman et al. 2003, Fleckenstein et al. 2000, Lopez-Arnau et al. 2012) e stimolano il rilascio di monoamine in vitro (Kalix e Glennon 1986, Gygi et al. 1997, Rothman et al. 2003) e in vivo (Gygi et al. 1997, Kehr et al. 2011). Il metacatinone causa riduzioni persistenti dell'attività della triptofano idrossilasi e della tirosina idrossilasi (TH) e una deplezione di DA e 5-HT (Gygi et al. 1997, Gygi et al. 1996, Sparago et al. 1996). Studi di imaging PET in consumatori astinenti di metacatena hanno rivelato una ridotta densità del DAT striatale che suggerisce una perdita di terminali DA (McCann et al. 1998). La stimolazione simultanea del rilascio di DA e l'inibizione della sua captazione rispecchiano gli elementi critici alla base della neurotossicità associata alla metanfetamina (Kuhn et al. 2008, Yamamoto e Bankson 2005, Cadet et al. 2007, Fleckenstein et al. 2007).
Noi (Angoa-Perez et al. 2012) e altri (Baumann et al. 2012, Hadlock et al. 2011) abbiamo recentemente studiato la possibilità che il mefedrone possa causare neurotossicità come la metamfetamina e l'MDMA. Sorprendentemente, il mefedrone non è risultato tossico per le terminazioni nervose DA dello striato (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). La questione se il mefedrone danneggi le terminazioni nervose 5-HT rimane aperta, poiché uno studio ha documentato effetti positivi (Hadlock et al. 2011) mentre un altro è stato negativo (Baumann et al. 2012). Alla luce dell'effetto relativamente benigno del mefedrone sulle terminazioni nervose DA e considerando le sue proprietà di bloccante della DAT, abbiamo ipotizzato che possa effettivamente proteggere il sistema neuronale DA dagli effetti neurotossici della metamfetamina, come è noto che accade con altri bloccanti della DAT come l'acido anfonelico (Pu et al. 1994, Schmidt e Gibb 1985, Marek et al. 1990) e la nomifensina (Poth et al. 2012). Attualmente riportiamo che il mefedrone aumenta significativamente la neurotossicità della metamfetamina. Questo effetto si estende all'anfetamina e all'MDMA, droghe che sono spesso usate insieme al mefedrone (Feyissa e Kelly 2008, Schifano et al. 2011). Questi risultati sorprendenti gettano l'abuso di mefedrone sotto una nuova luce e aggiungono urgenza al riconoscimento di questa sottile e pericolosa proprietà di questa β-chetoanfetamina.
Materiali e metodi
Farmaci e reagenti
Il mefedrone cloridrato e la 3,4-metilendiossimetanfetamina (MDMA) sono stati ottenuti dal NIDA Research Resources Drug Supply Program. (+) Metamfetamina cloridrato, nomifensina maleato, d-anfetamina solfato, pentobarbital, DA e tutti i tamponi e i reagenti HPLC sono stati acquistati da Sigma-Aldrich (St. Louis, MO, USA). I kit per il dosaggio delle proteine dell'acido bicinchoninico sono stati acquistati da Pierce (Rockford, IL, USA). Gli anticorpi policlonali contro il TH di ratto sono stati prodotti come precedentemente descritto (Kuhn e Billingsley 1987). Gli anticorpi monoclonali contro la DAT di ratto sono stati generosamente forniti dalla dottoressa Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA). Gli anticorpi secondari anti-IgG coniugati con HRP sono stati forniti da Jackson ImmunoResearch Laboratories, Inc. (West Grove, PA, USA).
Animali
Le femmine di topo C57BL/6 (Harlan, Indianapolis, IN, USA), del peso di 20-25 g al momento della sperimentazione, sono state alloggiate 5 per gabbia in grandi gabbie a scatola da scarpe in una stanza con luce (12 ore di luce/buio) e temperatura controllata. Sono stati utilizzati topi di sesso femminile perché sono noti per essere molto sensibili ai danni neuronali causati dalle anfetamine neurotossiche e per mantenere la coerenza con i nostri precedenti studi sulla neurotossicità della metanfetamina (Thomas et al. 2010, Thomas et al. 2008, Thomas et al. 2009). I topi avevano libero accesso a cibo e acqua. Il Comitato Istituzionale per la Cura e l'Uso della Wayne State University ha approvato la cura degli animali e le procedure sperimentali. Tutte le procedure erano inoltre conformi alla NIH Guide for the Care and Use of Laboratory Animals.
Procedure farmacologiche, fisiologiche e comportamentali
I topi sono stati trattati con mefedrone utilizzando un regime di binge-like composto da 4 iniezioni di 10, 20 o 40 mg/kg con un intervallo di 2 ore tra ogni iniezione. Questo regime di trattamento binge, quando viene utilizzato per iniettare anfetamine sostitutive e derivati del catinone, provoca un danno esteso alle terminazioni nervose DA. Le dosi di mefedrone utilizzate attualmente hanno dimostrato in precedenza di non essere tossiche per le terminazioni nervose DA (Angoa-Perez et al. 2012). I topi sono stati trattati con metanfetamina (4X 2,5 o 5 mg/kg), anfetamina (4X 5 mg/kg) o MDMA (4X 20 mg/kg) da soli o in combinazione con il mefedrone. Quando sono stati trattati con due farmaci, i topi hanno ricevuto un'iniezione di mefedrone 30 minuti prima di ciascuna delle 4 iniezioni di metanfetamina, anfetamina o MDMA. I controlli hanno ricevuto iniezioni di soluzione fisiologica secondo lo stesso schema utilizzato per il mefedrone da solo o in combinazione con altre anfetamine. Come controllo degli effetti di un inibitore del DAT sulla tossicità della metamfetamina, i topi sono stati trattati con nomifensina (4X 5 mg/kg) 30 minuti prima di ogni iniezione di metamfetamina (4X 5 mg/kg). Tutte le iniezioni sono state effettuate per via i.p.. I topi sono stati sacrificati 2 giorni dopo l'ultimo trattamento farmacologico, quando la neurotossicità associata all'anfetamina ha raggiunto il massimo. La temperatura corporea è stata monitorata mediante telemetria utilizzando i transponder di temperatura impiantabili IPTT-300 di Bio Medic Data Systems, Inc. (Seaford, DE, USA). Le temperature sono state registrate in modo non invasivo ogni 20 minuti, a partire da 60 minuti prima della prima iniezione di METH e continuando per le 9 ore successive, utilizzando il sistema di console DAS-5001 di Bio Medic.
Determinazione del contenuto di DA striatale
Il tessuto striatale è stato sezionato bilateralmente dal cervello dopo il trattamento e conservato a -80 °C. I tessuti congelati sono stati pesati e sonicati in 10 volumi di acido perclorico 0,16 N a 4 °C. Le proteine insolubili sono state rimosse mediante centrifugazione e la DA è stata determinata mediante HPLC con rivelazione elettrochimica come precedentemente descritto per la metamfetamina (Thomas et al. 2010, Thomas et al, 2009).
Determinazione dei livelli proteici di TH e DAT mediante immunoblotting
Gli effetti dei trattamenti farmacologici sui livelli striatali di TH e DAT sono stati determinati mediante immunoblotting come indice di tossicità per le terminazioni nervose DA striatali. I topi sono stati sacrificati per decapitazione dopo il trattamento e lo striato è stato sezionato bilateralmente. I tessuti sono stati conservati a -80°C. Il tessuto congelato è stato disgregato mediante sonicazione in 1% SDS a 95°C e il materiale insolubile è stato sedimentato mediante centrifugazione. Le proteine sono state determinate con il metodo dell'acido bicinchoninico e quantità uguali di proteine (70 μg/lane) sono state risolte mediante elettroforesi su gel di SDS-poliacrilammide e poi elettroblottate su nitrocellulosa. I blot sono stati bloccati in soluzione salina tamponata Tris contenente Tween 20 (0,1% v/v) e 5% di latte non grasso secco per 1 ora a temperatura ambiente. Gli anticorpi primari contro TH (1:1000) o DAT (1:1000) sono stati aggiunti ai blot e lasciati incubare per 16 ore a 4°C. I blot sono stati lavati 3 volte in soluzione fisiologica tamponata con Tris per rimuovere gli anticorpi non reagiti e quindi incubati con l'anticorpo secondario anti-IgG coniugato con HRP (1:4000) per 1 h a temperatura ambiente. Le bande immunoreattive sono state visualizzate mediante chemiluminescenza potenziata e le densità relative delle bande TH- e DAT-reattive sono state determinate mediante imaging con una Kodak Image Station (Carestream Molecular Systems, Rochester, NY, USA) e quantificate con il software ImageJ (NIH).
Analisi dei dati
Sono state eseguite ANOVA a due vie per analizzare gli effetti della dose di metamfetamina rispetto al mefedrone su DA, DAT e TH. Gli effetti dei trattamenti farmacologici sul contenuto striatale di DA, TH e DAT sono stati analizzati per verificarne la significatività mediante ANOVA a una via seguita dal test di confronto multiplo di Tukey. I risultati dei trattamenti farmacologici sulla temperatura corporea nel tempo sono stati analizzati utilizzando un'ANOVA a due vie seguita dal test di Bonferroni per determinare la significatività delle differenze di temperatura nei singoli momenti successivi al trattamento. Le differenze sono state considerate significative se p < 0,05. Tutte le analisi statistiche sono state effettuate utilizzando GraphPad Prism versione 5.02 per Windows (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Vai a:
Risultati
Effetti del mefedrone sulla neurotossicità indotta dalla metanfetamina
Il mefedrone, in dosi (10, 20 o 40 mg/kg) note per non causare tossicità delle terminazioni nervose DA (Angoa-Perez et al. 2012), è stato somministrato 30 minuti prima di ogni iniezione di metamfetamina. La metamfetamina è stata somministrata a dosi che causano danni moderati (4X 2,5 mg/kg) o gravi (4X 5 mg/kg) alle terminazioni nervose DA dello striato (Thomas et al. 2004, Thomas et al. 2010). I risultati presentati nella Fig. 1 mostrano che gli effetti principali della dose di metamfetamina (F1,40 = 66,60, p < 0,0001) e della dose di mefedrone (F4,40 = 131,3, p < 0,0001) sui livelli di DA nello striato sono risultati altamente significativi mediante ANOVA a due vie. Anche l'effetto principale del mefedrone somministrato in combinazione con 2,5 mg/kg (F4,22 = 35,96, p < 0,001) o 5,0 mg/kg di metamfetamina (F4,17 = 953,9, p < 0,0001) è risultato altamente significativo mediante ANOVA a una via. Tutti i trattamenti con una delle due dosi di metamfetamina ± mefedrone hanno causato riduzioni significativamente maggiori della DA rispetto al rispettivo controllo (p < 0,0001 per tutti). La Fig. 1 mostra anche che le dosi di mefedrone di 20 (p < 0,01) e 40 mg/kg (p < 0,001) hanno potenziato in modo significativo gli effetti depauperanti di 2,5 mg/kg di metamfetamina sulla DA, mentre tutte le dosi di mefedrone hanno potenziato in modo significativo gli effetti di 5,0 mg/kg di metamfetamina sui livelli di DA (p < 0,0001 per tutti).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/sywobkqrnd-jpg.47/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 1
Effetti del mefedrone sulla riduzione della DA striatale indotta dalla metamfetamina. I topi sono stati trattati con le dosi indicate di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 2,5 (-) o 5,0 mg/kg (■) di metamfetamina (METH) e sacrificati 2d dopo per la determinazione dei livelli striatali di DA mediante HPLC. I dati sono medi ± SEM per 5-7 topi per gruppo. Alcune barre di errore erano troppo piccole per superare le dimensioni dei simboli e non appaiono visibili. ***p < 0,001 rispetto ai controlli e #p < 0,01, ##p < 0,001 o ###p < 0,0001 rispetto alla rispettiva dose di metamfetamina (test di confronto multiplo di Tukey).
La Fig. 2a mostra che il mefedrone ha aumentato significativamente le riduzioni dei livelli di DAT indotte dalla metamfetamina, come determinato dall'immunoblotting. Gli immunoblotti sono stati quantificati e, in accordo con i risultati per la DA, gli effetti principali della dose di metamfetamina (F1,92 = 9,48, p < 0,001) e della dose di mefedrone (F4,92 = 37,56, p < 0,0001) sui livelli di DAT nello striato sono risultati altamente significativi mediante ANOVA a due vie (Fig. 2b). Anche l'effetto principale del mefedrone somministrato in combinazione con 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) o 5,0 mg/kg di metamfetamina (F4,39 = 24,84, p < 0,0001) è risultato altamente significativo mediante ANOVA a una via. Tutti i trattamenti con una delle due dosi di metamfetamina ± mefedrone hanno causato riduzioni significativamente maggiori del DAT rispetto al rispettivo controllo (p < 0,01 per 2,5 mg/kg di sola metamfetamina; p < 0,0001 per tutti gli altri trattamenti). La Fig. 2b mostra anche che le dosi di mefedrone di 20 mg/kg (p < 0,01) e 40 mg/kg (p < 0,001) hanno migliorato significativamente le riduzioni di DAT causate da 2,5 mg/kg di metamfetamina, mentre solo la dose di mefedrone di 40 mg/kg ha migliorato significativamente (p < 0,01) gli effetti di 5,0 mg/kg di metamfetamina sulle riduzioni di DAT.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/bfu3sx5dnr-jpg.4797/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 2
Effetti del mefedrone sulle riduzioni del DAT striatale indotte dalla metamfetamina. I topi sono stati trattati con le dosi indicate di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 2,5 (●) o 5,0 mg/kg (■) di metamfetamina (METH) e sacrificati 2d dopo per la determinazione dei livelli striatali di DAT mediante immunoblotting (a). I blot sono stati quantificati con ImageJ e i dati sono medi ± SEM per 10-12 topi per gruppo (b). *p < 0,01 o ***p < 0,0001 rispetto al controllo (C) e #p < 0,01 o ##p < 0,001 rispetto alla rispettiva dose di metamfetamina (test di confronto multiplo di Tukey).
La Fig. 3a mostra che il mefedrone ha aumentato significativamente le riduzioni dei livelli di TH indotte dalla metamfetamina, come determinato dall'immunoblotting. Gli immunoblots sono stati quantificati e, in accordo con i risultati precedenti per DA e DAT, gli effetti principali della dose di metamfetamina (F1,81 = 47,89, p < 0,0001) e della dose di mefedrone (F4,81 = 63,57, p < 0,0001) sono risultati altamente significativi mediante ANOVA a due vie (Fig. 3b). L'effetto principale del mefedrone somministrato in combinazione con 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) o 5,0 mg/kg di metamfetamina (F4,49 = 99,16, p < 0,0001) è risultato altamente significativo anche con l'ANOVA a una via. Tutti i trattamenti con una delle due dosi di metamfetamina ± mefedrone hanno causato riduzioni significativamente maggiori di TH rispetto al rispettivo controllo (p < 0,001 per 2,5 mg/kg di metamfetamina + 10 mg/kg di mefedrone; p < 0,0001 per tutte le altre combinazioni), con l'eccezione di 2,5 mg/kg di metamfetamina da sola, che non ha modificato significativamente i livelli di TH (cioè, nessuna tossicità). La Fig. 3b mostra anche che le dosi di mefedrone di 20 mg/kg (p < 0,01) e 40 mg/kg (p < 0,001) hanno migliorato significativamente le riduzioni di TH causate da 2,5 mg/kg di metanfetamina e tutte e tre le dosi di mefedrone hanno migliorato significativamente (p < 0,0001) gli effetti di 5,0 mg/kg di metanfetamina sulle riduzioni di TH.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/tggfrjpqru-jpg.4798/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 3
Effetti del mefedrone sulle riduzioni di TH striatale indotte dalla metamfetamina. I topi sono stati trattati con le dosi indicate di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 2,5 (●) o 5,0 mg/kg (■) di metamfetamina (METH) e sacrificati 2d dopo per la determinazione dei livelli striatali di TH mediante immunoblotting (a). I blot sono stati quantificati con ImageJ e i dati sono medi ± SEM per 10-12 topi per gruppo (b). Alcune barre di errore erano troppo piccole per superare le dimensioni dei simboli e non appaiono visibili. **p < 0,001 o ***p < 0,0001 rispetto al controllo (C) e #p < 0,01, ##p < 0,001 o ###p < 0,0001) rispetto alla rispettiva dose di metamfetamina (test di confronto multiplo di Tukey).
Effetti del mefedrone sull'ipertermia indotta dalla metamfetamina
Il mefedrone, come la metamfetamina, causa una significativa ipertermia (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Quando il mefedrone è stato somministrato 30 minuti prima di ogni iniezione di metamfetamina, si può notare nella Fig. 4 che gli effetti principali delle dosi di metamfetamina e mefedrone (F1,300 = 11,99, p < 0,0001) sul tempo (F4,300 = 51,73, p < 0,0001) erano altamente significativi con l'ANOVA a due vie. Gli effetti principali del mefedrone somministrato in combinazione con 2,5 mg/kg di metamfetamina (F4.120 = 41,44, p < 0,0001, pannello a) nel tempo (F30.120 = 3,84, p < 0,0001) o 5,0 mg/kg di metamfetamina (F4.120 = 78,09, p < 0,0001, pannello b) nel tempo (F30.120 = 9,98, p < 0,0001) erano anch'essi altamente significativi mediante ANOVA a due vie. Tutti i trattamenti con entrambe le dosi di metamfetamina ± mefedrone erano significativamente diversi dai rispettivi controlli (p < 0,0001 per tutti i trattamenti).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/x0ik9hdwsw-jpg.4799/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 4
Effetti del mefedrone sull'ipertermia indotta dalla metamfetamina. I topi sono stati trattati con le dosi indicate di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 2,5 (a) o 5,0 mg/kg (b) di metamfetamina (METH). Le temperature del nucleo sono state misurate a intervalli di 20 minuti mediante telemetria a partire da 60 minuti prima della prima iniezione di metanfetamina. Le 4 iniezioni di metamfetamina sono indicate dalle frecce appoggiate sull'asse delle ascisse. I dati sono espressi come temperatura corporea media di 6-8 topi per gruppo. I SEM erano sempre < 10% della media e sono omessi per chiarezza.
Effetti del mefedrone sulla neurotossicità indotta da anfetamina e MDMA
Per verificare se gli effetti potenzianti del mefedrone sulla metamfetamina potessero essere estesi ad altre anfetamine neurotossiche, i topi sono stati trattati con questa β-chetoanfetamina (20 mg/kg) più anfetamina (4X 5 mg/kg) o MDMA (4X 20 mg/kg) e i risultati sono presentati nella Fig. 5. Ricordiamo che il mefedrone di per sé non riduce la DA striatale, il DAT o il TH (Angoa-Perez et al. 2012). L'effetto principale del farmaco (F5,27 = 27,18, p < 0,0001) è risultato altamente significativo con l'ANOVA a una via per la riduzione della DA (Fig. 5a). La Fig. 5a mostra anche che tutti i trattamenti con anfetamina (p < 0,001) o MDMA (p < 0,001) da soli o in combinazione con mefedrone (p < 0,0001 per entrambi i farmaci) hanno ridotto significativamente i livelli di DA rispetto al controllo. Il mefedrone ha aumentato significativamente le riduzioni di DA causate dall'anfetamina (p < 0,01) o dall'MDMA (p < 0,01). La Fig. 5b mostra effetti simili dei trattamenti farmacologici combinati sui livelli di DAT nello striato. L'effetto principale della droga (F4,49 = 42,63, p < 0,0001) è stato altamente significativo con l'ANOVA a una via per il DAT. Nella Fig. 5b si può anche notare che tutti i trattamenti con anfetamina o MDMA erano significativamente (p < 0,0001 per tutti) inferiori rispetto al controllo. Anche il mefedrone ha aumentato significativamente le riduzioni del DAT causate dall'anfetamina o dall'MDMA (p < 0,0001 in entrambi i casi). Infine, la Fig. 5c mostra che l'effetto principale della droga (F4,50 = 75,06, p < 0,0001) era altamente significativo con l'ANOVA a una via per le riduzioni di TH. La Fig. 5c mostra anche che tutti i trattamenti con anfetamina o MDMA erano significativamente (p < 0,0001 per tutti) inferiori rispetto al controllo. Anche il mefedrone ha aumentato significativamente le riduzioni di TH causate dall'anfetamina o dall'MDMA (p < 0,0001 in entrambi i casi).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/onvypkgxvn-jpg.4800/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 5
Effetti del mefedrone sulla neurotossicità delle terminazioni nervose DA indotta da anfetamina o MDMA. I topi sono stati trattati con 20 mg/kg di mefedrone (MEPH) 30 minuti prima di ogni iniezione di 5,0 mg/kg di anfetamina (AMPH) o 20 mg/kg di MDMA e sacrificati 2d dopo il trattamento per la determinazione dei livelli striatali di (a) DA mediante HPLC. (b) DAT e (c) TH sono stati determinati mediante immunoblotting e i blot sono stati quantificati utilizzando ImageJ. Gli immunoblots rappresentativi per DAT e TH sono inclusi come inserti nei pannelli (b) e (c) rispettivamente e i trattamenti per entrambi i pannelli sono indicati con 1,5: controllo; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; e 8: MDMA + MEPH. I dati sono medi ± SEM per 5-12 topi in ciascun gruppo. **p < 0,001 o ***p < 0,0001 vs controllo e #p < 0,01 o ###p < 0,0001 vs AMPH o MDMA (test di confronto multiplo di Tukey).
Effetti della nomifensina sulla neurotossicità indotta dalla metamfetamina
La nomifensina, un potente bloccante del DAT di cui non si conosce il potenziale di abuso o neurotossico, è stata testata per la sua capacità di proteggere dalla neurotossicità indotta dalla metamfetamina e per contrastare l'azione del mefedrone sulla tossicità delle terminazioni nervose DA causata da metamfetamina, anfetamina e MDMA. I risultati della Fig. 6a mostrano che l'effetto principale del farmaco (F3,16 = 63,39, p < 0,0001) sui livelli di DA è stato altamente significativo con l'ANOVA a una via. La nomifensina da sola non ha alterato i livelli di DA, ma la riduzione causata dalla metamfetamina (p < 0,0001) è stata leggermente ma significativamente invertita dalla nomifensina (p < 0,01). L'effetto principale del farmaco (F3,20 = 16,78, p < 0,0001) sui livelli di DAT è risultato altamente significativo con l'ANOVA a una via, come mostrato nella Fig. 6b. La nomifensina non ha modificato i livelli di DAT, ma ha fornito una protezione significativa (p < 0,001) contro la riduzione del DAT striatale causata dalla metamfetamina (p < 0,0001) rispetto al controllo. Infine, la Fig. 6c mostra che l'effetto principale del farmaco (F3,15 = 14,10, p < 0,0001) sui livelli di TH è stato altamente significativo mediante ANOVA a una via. Come visto per DA e DAT, la riduzione di TH causata dalla metamfetamina (p < 0,0001) è stata leggermente ma significativamente prevenuta dalla nomifensina (p < 0,01).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/daczg9cwfv-jpg.4801/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Fig. 6
Effetti della nomifensina sulla neurotossicità delle terminazioni nervose DA indotta dalla metamfetamina. I topi sono stati trattati con 5,0 mg/kg di nomifensina (NOM) 30 minuti prima di ogni iniezione di 5,0 mg/kg di metamfetamina (METH) e sacrificati 2d dopo per la determinazione dei livelli striatali di (a) DA mediante HPLC. (b) DAT e (c) TH sono stati determinati mediante immunoblotting e i blot sono stati quantificati utilizzando ImageJ. Gli immunoblots rappresentativi per DAT e TH sono inclusi come inserti nei pannelli (b) e (c). I dati sono medi più SEM per 5-7 topi per gruppo. ***p < 0,0001 rispetto al controllo (C) e #p < 0,01 o ##p < 0,001 rispetto alla sola metamfetamina (test di confronto multiplo di Tukey).
Discussione
Lo scopo del presente studio era quello di determinare se il mefedrone potesse prevenire la tossicità delle terminazioni nervose DA causata dalla metanfetamina. Sulla base della sua somiglianza chimica con la metamfetamina e l'MDMA, inizialmente ci si aspettava che il mefedrone esercitasse effetti dannosi sul sistema neuronale DA. Tuttavia, diversi studi hanno stabilito quasi contemporaneamente che il mefedrone non è tossico per le terminazioni nervose DA (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Resta aperta la questione se questa droga provochi danni al sistema neuronale 5-HT. Uno studio ha riportato riduzioni persistenti della funzione delle terminazioni nervose 5-HT (Hadlock et al. 2011), mentre un altro ha rilevato che il mefedrone non causa danni (Baumann et al. 2012). Il mefedrone interagisce con la terminazione nervosa DA in un modo che suggerisce che effettivamente stimola il rilascio e blocca la ricaptazione della DA attraverso le sue interazioni con il DAT. Un aspetto fondamentale del meccanismo d'azione neurotossico della metanfetamina è la sua capacità di accedere alle terminazioni nervose DA attraverso il DAT e di alterare l'omeostasi della DA (Sulzer 2011). Se questa fase iniziale della cascata neurotossica della metamfetamina viene impedita dall'inibizione del DAT, la tossicità viene prevenuta (Pu et al. 1994, Poth et al. 2012, Marek et al. 1990, Schmidt e Gibb 1985). Abbiamo pensato che il mefedrone potesse avere questa stessa proprietà protettiva di altri inibitori della DAT, ma abbiamo osservato invece un significativo aumento della tossicità. Questa interazione è stata osservata utilizzando due diverse dosi di metamfetamina che causano danni moderati o gravi alle terminazioni nervose DA (4X 2,5 o 5,0 mg/kg, rispettivamente). Questo effetto potenziante del mefedrone non si limitava alla metamfetamina e si estendeva all'anfetamina e all'MDMA, due droghe che sono spesso usate insieme al mefedrone e ad altre β-chetoanfetamine (Feyissa e Kelly 2008, Schifano et al. 2011, Kelly 2011). Pertanto, nonostante il mefedrone non provochi tossicità almeno per le terminazioni nervose DA dello striato, potenzia gli effetti neurotossici di altre droghe d'abuso. Questa nuova scoperta dovrebbe porre l'abuso di mefedrone in termini ancora più crudi, perché la sua mancanza di neurotossicità intrinseca può farlo apparire innocuo.
L'ipertermia è un effetto negativo acuto comunemente riportato dall'ingestione di metanfetamina (Greene et al. 2008) e di β-chetoanfetamina nell'uomo (Borek e Holstege 2012, Prosser e Nelson 2012). Come la metanfetamina, anche molte droghe a base di β-chetoanfetamina causano aumenti significativi della temperatura interna nei roditori (Angoa-Perez et al. 2012, Hadlock et al. 2011, Baumann et al. 2012, Rockhold et al. 1997). Sebbene l'ipertermia causata dalla metanfetamina possa contribuire ai suoi effetti morfologici e dannosi per i neuroni, non è detto che l'ipertermia sia la causa diretta di questi effetti (Kiyatkin e Sharma 2009). Abbiamo registrato la temperatura corporea centrale in topi trattati con mefedrone e metamfetamina e abbiamo osservato che il trattamento combinato non ha aumentato la temperatura oltre l'aumento massimo osservato dopo uno dei due farmaci da solo. La metamfetamina ha causato un aumento della temperatura corporea correlato alla dose e questa ipertermia è rimasta invariata per l'intero intervallo di dosi di mefedrone testato. Infatti, il calo della temperatura corporea post-iniezione osservato dopo il trattamento con mefedrone (Angoa-Perez et al. 2012) è stato mantenuto a dosi più elevate di mefedrone più metamfetamina. Anche se l'ipertermia indotta dalla droga non è stata potenziata dal trattamento combinato, gli effetti neurotossici sono stati additivi. Pertanto, almeno nel caso in esame, sembra che gli effetti neurotossici della metamfetamina possano essere potenziati dal mefedrone in modo indipendente dall'ipertermia.
Il mefedrone inibisce chiaramente la funzione del DAT e blocca la ricaptazione della DA in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). Il mefedrone spiazza il WIN-35,428 dal suo sito di legame sul DAT, suggerendo che si tratta di un inibitore competitivo dell'assorbimento di DA (Martinez-Clemente et al. 2012, Lopez-Arnau et al. 2012). La potenza del mefedrone in questo senso è molto simile a quella della metamfetamina (Cozzi et al. 1999) e dell'MDMA (Escubedo et al. 2011). Non è noto se il mefedrone sia trasportato dal DAT, mentre lo è il metacatinone (Cozzi e Foley 2003). La nomifensina e l'acido anfonelico, che si legano al DAT e inibiscono l'assorbimento della DA, forniscono una protezione sostanziale contro la neurotossicità indotta dalla metamfetamina (Pu et al. 1994, Marek et al. 1990, Schmidt e Gibb 1985, Poth et al. 2012) e i topi privi del DAT sono resistenti alla tossicità neuronale della metamfetamina (Fumagalli et al. 1998). Sapendo che il mefedrone non è neurotossico e che è un bloccante del DAT, si può prevedere che dovrebbe prevenire la tossicità. A questo proposito abbiamo testato la nomifensina come controllo positivo e abbiamo confermato che protegge dalla deplezione di DA, DAT e TH indotta dalla metamfetamina. La nomifensina inibisce anche il trasportatore della noradrenalina (Brogden et al. 1979), ma questa proprietà non può spiegare i risultati attuali perché la maggior parte delle β-chetoanfetamine, compreso il mefedrone, inibisce il trasportatore della noradrenalina e ne blocca l'assorbimento (Kelly 2011, Rothman et al. 2003, Cozzi et al. 1999, Sogawa et al. 2011, Lopez-Arnau et al. 2012). Un ruolo del sistema neuronale 5-HT in alcune delle azioni farmacologiche del mefedrone è possibile alla luce della capacità di questa droga, come l'MDMA (Yamamoto et al. 1995), di provocare un efflusso di DA striatale attraverso le sue interazioni con i recettori 5-HT2A (Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012). L'iperlocomozione causata dal mefedrone dipende dalla 5-HT endogena (Lopez-Arnau et al. 2012) e questo farmaco stimola anche il rilascio di 5-HT e ne inibisce l'assorbimento in vitro (Sogawa et al. 2011, Cozzi et al. 1999, Nagai et al. 2007, Hadlock et al. 2011, Lopez-Arnau et al. 2012, Martinez-Clemente et al. 2012) e in vivo (Baumann et al. 2012, Kehr et al. 2011). Tuttavia, possiamo escludere un ruolo della 5-HT endogena nella neurotossicità DA almeno della metamfetamina dimostrando che i topi geneticamente privati della 5-HT mantengono la loro sensibilità alla neurotossicità (Thomas et al. 2010).
Il mefedrone potrebbe aumentare la neurotossicità della metamfetamina attraverso diversi possibili meccanismi. In primo luogo, il mefedrone potrebbe interagire con la VMAT per causare la fuoriuscita di DA nel citoplasma della terminazione nervosa presinaptica. I trattamenti che aumentano il pool citoplasmatico (cioè rilasciabile dal farmaco) di DA aumentano la neurotossicità della metamfetamina (Thomas et al. 2008, Thomas et al. 2009, Schmidt et al. 1985). Questo meccanismo non è probabile perché il metacatinone interagisce solo debolmente con il VMAT (Cozzi et al. 1999). In secondo luogo, la combinazione di mefedrone e metamfetamina potrebbe avere un effetto sinergico sul rilascio non-vescicolare di DA, ma anche questa possibilità sembra improbabile alla luce dei risultati che dimostrano che il trattamento di cellule CHO esprimenti DAT o SERT con metilone e metamfetamina non ha un effetto additivo sul rilascio di DA o 5-HT (Sogawa et al. 2011). In terzo luogo, il mefedrone potrebbe interagire con il DAT in un modo nuovo che contribuisce alla tossicità additiva. È stato dimostrato che il metilone, in combinazione con la metanfetamina, provoca una citotossicità sinergica in cellule CHO che esprimono il DAT o il SERT, ma non in cellule CHO wild type prive dei trasportatori (Sogawa et al. 2011). La citotossicità osservata nelle cellule in coltura in questi studi (cioè il rilascio di LDH) è molto diversa dal danno alle terminazioni nervose DA causato dalla metamfetamina, ma questo meccanismo suggerisce un ruolo interessante ma non definito per il DAT nell'aumento della citotossicità. Infine, il mefedrone potrebbe modificare il metabolismo della metamfetamina. Il mefedrone è metabolizzato principalmente per N-demetilazione (Meyer e Maurer 2010), come la metamfetamina e l'MDMA (Caldwell 1976). Questo meccanismo è supportato dalla dimostrazione che la metamfetamina e l'MDMA inibiscono reciprocamente la produzione dei rispettivi metaboliti primari ed elevano i livelli plasmatici della droga al di sopra di quelli osservati dopo la somministrazione di una delle due sostanze da sola (Kuwayama et al. 2012). Le dosi di mefedrone utilizzate attualmente e nel nostro precedente studio (Angoa-Perez et al. 2012), pur essendo elevate, non sono neurotossiche e rientrano nell'intervallo di abuso umano (McErath e O'Neill 2011). Pertanto, il mefedrone potrebbe agire come l'MDMA per aumentare i livelli plasmatici di metamfetamina inibendone il metabolismo. Per confermare quest'ultima possibilità sarà necessaria un'analisi farmacocinetica approfondita.
L'abuso di β-chetoanfetamine sta aumentando a un ritmo allarmante e il mefedrone è ora una delle droghe più comunemente usate dopo la cannabis, l'MDMA e la cocaina (Morris 2010, Winstock et al. 2011b). Inoltre, il mefedrone induce negli esseri umani una sensazione di desiderio più forte rispetto all'MDMA (Brunt et al. 2011) e i consumatori che sniffano il mefedrone lo considerano più coinvolgente della cocaina (Winstock et al. 2011b). Il mefedrone viene consumato dagli esseri umani in modo simile all'abbuffata (cioè "stacking") e viene spesso assunto insieme ad altre droghe come la cannabis e gli psicostimolanti anfetaminici (Schifano et al. 2011, Fass et al. 2012, Winstock et al. 2011a, Kelly 2011, Torrance e Cooper 2010). Il mefedrone si trova sempre più spesso in compresse vendute come MDMA (Brunt et al. 2011) e il suo uso probabilmente supererà quello dell'MDMA, dato che la purezza di quest'ultima droga continua a diminuire (Brunt et al. 2011, Tanner-Smith 2006, Teng et al. 2006). Sulla base dei modelli comuni di abuso di mefedrone e di altri ingredienti dei "sali da bagno", è importante considerare se si generano rischi aggiuntivi per la salute negli esseri umani quando queste droghe vengono combinate con le anfetamine, intenzionalmente o meno. I nostri risultati, che dimostrano che almeno il mefedrone potenzia in modo significativo la neurotossicità delle terminazioni nervose DA dello striato causata da metanfetamina, anfetamina e MDMA, rivelano una proprietà particolarmente pericolosa e inaspettata di questa β-chetoanfetamina.
Abbreviazioni utilizzate
5-HT serotonina
DA dopamina
DAT Trasportatore di DA
MDMA 3,4-metilendiossimetanfetamina
TH tirosina idrossilasi
VMAT Trasportatore vescicolare di monoammina