Brain
Expert Pharmacologist
- Joined
- Jul 6, 2021
- Messages
- 290
- Reaction score
- 329
- Points
- 63
Lapsilocibina (3-[2-(Dimetilammino)etil]-1H-indol-4-il diidrogeno fosfato) è un alcaloide della famiglia delle triptamine, derivato fosforilato della psilocina, che ha proprietà psichedeliche. Tra tutte le fonti biologiche di psilocibina, le specie di funghi dei generi Psilocybe, Panaeolus, Stropharia, Gymnopilus, Inocybe ne contengono la quantità maggiore; tuttavia, circa 200 altre specie di funghi contengono psilocibina. La famiglia di funghi contenenti psilocibina, nota con il nome di "funghi magici", è stata utilizzata per i suoi effetti allucinogeni nel corso della storia. Alla fine degli anni '50 Albert Hoffman, della società Sandoz Laboratories, isolò e sintetizzò i composti psicoattivi psilocibina e psilocina da funghi contenenti psilocibina. La psilocibina è stata venduta da Sandoz con il nome di indocibina per fondamentali studi clinici psicofarmacologici e terapeutici. Attualmente sono note specie di Psilocybe in Asia, Australia, Stati Uniti, Canada, Messico, America centrale e meridionale, Africa ed Europa. Esistono numerose prove che le specie contenenti psilocibina siano nate in Africa e in Europa, nonché indicazioni che la Psilocybe fosse presente nel Vecchio Mondo prima della comparsa dell'uomo moderno. I funghi contenenti psilocibina possono essere trovati in natura o coltivati in ambiente controllato a partire da impronte di spore. La popolarità della psilocibina è cresciuta rapidamente nel 1960. Nel 1970 è stata inserita nell'elenco I, il che ha portato a una significativa riduzione della ricerca sulla psilocibina. Tuttavia, recenti studi preliminari sulla psilocibina hanno mostrato le prospettive della sua applicazione nel trattamento del disturbo ossessivo-compulsivo, della dipendenza da alcol, del disturbo depressivo maggiore e della depressione nei pazienti con cancro terminale. Negli Stati Uniti, la psilocibina è classificata come sostanza di cui all'elenco I, ai sensi del Controlled Substances Act del 1971; di conseguenza, è possibile produrne solo quantità limitate ogni anno. Nonostante lo status di Schedule-I, la psilocibina è stata una droga ricreativa popolare fin dagli anni '60 e, sebbene il suo uso sia diminuito da quando è diventata una sostanza controllata, l'uso ricreativo continua. Anche la maggior parte degli altri Paesi sviluppati ha classificato la psilocibina e i funghi contenenti psilocibina come illegali. La principale eccezione a questa generalità è rappresentata dai Paesi Bassi, che hanno una scappatoia legale che consente la coltivazione, la vendita e l'ingestione di "tartufi" psilocibinici. Le prime prove dell'uso da parte degli sciamani dell'America centrale e meridionale sono state identificate in numerose località. Gli studi moderni sono iniziati alla fine degli anni '50 con l'etnomicologo R. Gordon Wasson e sono proseguiti con i famosi ricercatori psichedelici Timothy Leary, Ralph Metzner e Ram Dass dell'Università di Harvard, Albert Hofmann dei laboratori Sandoz, Terrence McKenna e Jonathan Ott negli anni '60 e nei primi anni '70. Negli anni Cinquanta l'interesse di psichiatri e psicologi si è sviluppato a causa del suo potenziale percepito come strumento per abbreviare la psicoterapia. La ricerca interessata al trattamento psichedelico delle dipendenze è iniziata già negli anni Cinquanta. Spesso sono stati osservati effetti molto interessanti che hanno favorito la sobrietà, tanto da indurre Humphry Osmond a coniare il termine "psichedelico" per descrivere le capacità di "manipolazione della mente" di questa classe di droghe". La maggior parte della ricerca clinica è stata condotta negli anni '60, spesso utilizzando la versione sintetica dell'indocibina.
Sintesi della Pcilocibina
Sintesi della Pcilocina
La psilocibina è stata trovata in oltre 100 specie di funghi, molti dei quali appartenenti al genere Psilocybe. L'alcaloide psilocibina nella famiglia Inocybeacede compare tra 10 e 20 mya, ed è probabile che anche la psilocibina nella famiglia Psilocybe sia comparsa intorno a quel periodo. Attualmente sono note specie di Psilocybe in Asia, Australia, Stati Uniti, Canada, Messico, America centrale e meridionale, Africa ed Europa. Esistono numerose prove del fatto che le specie contenenti psilocibina siano nate in Africa e in Europa, nonché indicazioni del fatto che la Psilocybe fosse presente nel Vecchio Mondo prima della comparsa dell'uomo moderno. I funghi contenenti psilocibina possono essere trovati in natura o coltivati in un ambiente controllato grazie alle impronte di spore, che vengono create ponendo il cappello di un fungo noto su un foglio di carta oleata e lasciando che le spore cadano sulla carta, creando un'impronta digitale unica del fungo. Sebbene quest'ultima sia molto più comune e molto più sicura, alcuni utenti cercano ancora i "funghi magici" in natura. Il pericolo di un'identificazione errata è sempre presente ed è un errore a cui sono soggetti anche i micologi più esperti. L'identificazione errata può portare a un errore a cui anche i micologi più esperti sono suscettibili. L'errore di identificazione può portare a qualsiasi cosa, da un lieve disagio alla morte. La morte improvvisa è più frequente nei micologi dilettanti alla ricerca di funghi contenenti psilocibina e di un altro tipo di fungo psicoattivo comunemente noto come "Agarico delle mosche" (Amanita muscaria), che è l'iconico fungo dal cappello a puntini bianchi e rossi che si vede spesso nelle favole (invece della psilocibina, l'A. muscaria contiene le droghe psicoattive muscimolo e acido ibotenio). Purtroppo, diverse specie di Amanita sono mortali, tra cui l'Amanita phalloides e l'Amanita virosa, che possono apparire molto simili all'Amanita muscaria e alle specie affini. L'eredità e l'uso dei "funghi magici" sono presenti in tutta la storia antica e continuano nell'era moderna. Le prime prove dell'uso da parte degli sciamani dell'America centrale e meridionale sono state identificate in numerose località. Gli studi moderni sono iniziati alla fine degli anni '50 con l'etnomicologo R. Gordon Wasson e sono proseguiti con i famosi ricercatori psichedelici Timothy Leary, Ralph Metzner e Ram Dass dell'Università di Harvard, Albert Hofmann dei laboratori Sandoz, Terrence McKenna e Jonathan Ott negli anni '60 e nei primi anni '70. Negli anni Cinquanta l'interesse di psichiatri e psicologi si è sviluppato a causa del suo potenziale percepito come strumento per abbreviare la psicoterapia. La ricerca interessata al trattamento psichedelico delle dipendenze iniziò già negli anni Cinquanta. Spesso sono stati osservati effetti molto interessanti che hanno favorito la sobrietà, tanto da indurre Humphry Osmond a coniare il termine "psichedelico" per descrivere le capacità di "manipolazione della mente" di questa classe di droghe.
La struttura della psilocibina e degli altri allucinogeni indoloalchilamminici è simile a quella del neurotrasmettitore endogeno serotonina, dell'ormone melatonina e del presunto psichedelico endogeno N, N-dimetiltriptamina. Tutti derivano dallo stesso composto - la triptamina. La psilocibina (O-fosforil-4-idrossi-N, N-dimetiltriptamina) e il suo metabolita attivo difosforilato psilocina (N, N-dimetiltriptamina) appartengono strutturalmente al gruppo degli allucinogeni triptamina/indolamina e sono strutturalmente correlati alla serotonina. Una dose equimolare a 1 mole di psilocina è pari a 1,4 moli di psilocibina. La sostituzione del nucleo indolico in posizione 4 gioca probabilmente un ruolo sostanziale nei suoi effetti allucinogeni. La psilocibina e la psilocina, nelle loro forme pure, sono polveri cristalline bianche. Mentre la psilocibina è solubile in acqua, la psilocina è più solubile nei lipidi. Tuttavia, la psilocina può essere diluita anche in una soluzione acquosa acidificata e in dimetilsulfossido (DMSO; fino a 100 mM). Inoltre, entrambe le sostanze sono solubili in metanolo ed etanolo, ma quasi insolubili in etere di petrolio e cloroformio. Entrambe le droghe sono instabili alla luce (in particolare sotto forma di soluzioni), mentre la loro stabilità a basse temperature al buio in atmosfera inerte è molto buona. La psilocibina è un composto termolabile, solubile in acqua, metanolo, etanolo, ma insolubile in solventi organici. Da sola ha un'attività estremamente bassa; agisce principalmente come prodrug della psilocina. I valori di pKa variano da 1,3 a 6,5. Se esposta alla luce ultravioletta, la sua stabilità in soluzione viene compromessa, causando l'ossidazione. Solubile in 120 parti di metanolo bollente; difficilmente solubile in etanolo; praticamente insolubile in cloroformio, benzene, pressione di vapore - 1,9X10-12 mm Hg a 25 °C. Il peso molecolare è 285,25; ha sapore ammoniacale, punto di fusione di 224 gradi Celsius, pH 5,2 in etanolo al 50% di acqua, TDLo 75 mkg/kg se somministrata per via intramuscolare nell'uomo, TDLo 60 mkg/kg se somministrata per via orale nell'uomo, DL50 280 mg/kg se somministrata per via endovenosa nei ratti. Si ritiene che la psilocibina penetri poco la barriera emato-encefalica, rispetto alla psilocina. Ciò è dovuto alla differenza nei legami idrogeno, che rendono quest'ultima più liofila facilitando il passaggio attraverso la barriera emato-encefalica. All'esame visivo, la psilocibina purificata e la psilocina sono distinguibili. Una ha l'aspetto di un cristallo aghiforme bianco o quasi bianco, l'altra forma un colore oleoso che va dal marrone scuro al nero.
Stato legale.
Il governo ha emanato un divieto di possesso di psilocibina e psilocina nel 1968. Nel 1970, la psilocibina e la psilocina sono state inserite nell'elenco delle droghe di prima categoria. Negli Stati Uniti, Denver, Oakland, Chicago, Ann Arbor e Santa Cruz hanno depenalizzato il possesso di funghi magici, ma la vendita di funghi è ancora vietata. Nel 2020, l'Oregon ha legalizzato la psilocibina e il Distretto di Columbia ha depenalizzato l'uso dei funghi magici. È illegale vendere e trasportare psilocibina dall'Austria. Il possesso è stato depenalizzato e la coltivazione è legale purché i funghi non siano destinati al consumo. Chi viene sorpreso in possesso di funghi per uso personale può essere obbligato a sottoporsi a una terapia gratuita. In Portogallo, i funghi psilocibinici sono illegali ma depenalizzati. Le persone colte in possesso di quantità destinate all'uso personale possono essere obbligate a sottoporsi a riabilitazione o terapia. Nei Paesi Bassi, i funghi psilocibinici sono legali sotto forma di tartufi. In linea con la politica delle Nazioni Unite, la psilocibina è illegale in Italia; tuttavia, i funghi psilocibici sono depenalizzati. I kit di coltivazione e le spore sono legali da vendere e ottenere, ma le punizioni amministrative, come la perdita della patente di guida, possono essere la conseguenza di essere sorpresi con i funghi. La Spagna ha depenalizzato il possesso e il consumo personale di funghi psilocibinici, mentre la psilocibina in sé rimane illegale. La coltivazione e la vendita sono illegali e la legalità delle spore e dei kit di coltivazione è vaga. Le Isole Vergini Britanniche consentono il possesso e la coltivazione di funghi psilocibinici. Tuttavia, la vendita o il trasporto sono illegali (ma non vengono applicati). Il possesso, la vendita, il trasporto e la coltivazione di funghi psilocibinici sono legali in Giamaica. La Giamaica vende apertamente funghi psilocibinici. In Brasile è legale possedere, vendere, trasportare e coltivare funghi magici. La psilocibina e la psilocina sono elencate come illegali, tuttavia i funghi stessi non sono considerati illegali. Il possesso di funghi magici è illegale in Messico, anche se non viene applicato se i funghi magici appartengono a culture indigene. La coltivazione di funghi è illegale, a meno che non si tratti di funghi coltivati in natura. La vendita e il trasporto sono illegali. I funghi magici sono legali a Samoa. Dal 2018 sono illegali in Vietnam.
Attualmente, sono classificati come sostanza di cui alla Tabella I, ma i ricercatori della Johns Hopkins University sostengono che i funghi psilocibinici dovrebbero essere declassati da una sostanza di cui alla Tabella I alla Tabella IV. Nel 2019, la città di Oakland (CA) ha votato per la depenalizzazione dei funghi magici, appena un mese dopo la decisione di Denver (CO). In California c'è una spinta a depenalizzare i funghi psilocibinici a livello statale, con molti gruppi di sensibilizzazione e di difesa degli psichedelici che sostengono questo cambiamento. Inoltre, la legislatura statale dell'Oregon sta valutando di approvare una legge per la depenalizzazione dei funghi psilocibinici e l'offerta di licenze per la coltivazione. Gran parte di questa promettente ricerca si sta svolgendo grazie all'Associazione Multidisciplinare di Studi Psichedelici (MAPS), che attualmente conduce ricerche mediche su MDMA, psilocibina, LSD, marijuana, ibogaina e ayahuasca. Un'altra organizzazione, l'Heffter Research Institute, è specializzata nella ricerca sulla psilocibina. Tra i membri del consiglio di amministrazione dell'Heffter Research Institute c'è il cofondatore, il Dr. David Nichols, famoso ricercatore, professore ed esperto di chimica degli allucinogeni. Tra gli altri ricercatori figurano il Dr. Dennis McKenna, stimato scrittore, etnofarmacologo, psiconauta e fratello del defunto Terrence McKenna, e il Dr. Roland Griffiths, che sta conducendo una ricerca fenomenale alla Johns Hopkins sulla psilocibina e la dipendenza. Anche a livello internazionale sono in corso diversi studi sulla psilocibina. La Fondazione Beckley, con sede nel Regno Unito, sponsorizza alcune delle ricerche più avanzate sulla psilocibina. Fondata nel 1996 da Amanda Fielding, stimata psiconauta e scienziata, la Beckley Foundation sta attualmente sponsorizzando la ricerca sulle neuroscienze della psilocibina, insieme a MAPS e Heffter. Questa ricerca si svolge presso l'Imperial College di Londra con i dottori David Nutt e Robin Carhart-Harris, che hanno entrambi pubblicato ricerche sulla psilocibina in passato, in particolare il "Modello del cervello entropico". Heffter sta inoltre sponsorizzando uno studio in Svizzera dal titolo "Psilocybin Effects on Attention, Perception, and Cognition". Analogamente, il MAPS sta sponsorizzando in Germania uno studio intitolato "Studi sperimentali sugli effetti della psilocibina sull'inversione di profondità binoculare e sulla rivalità binoculare".
Farmacocinetica e farmacodinamica.
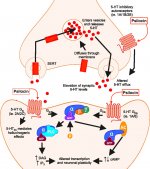
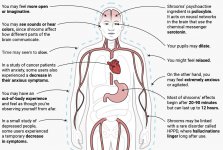
Quando viene ingerita, la psilocibina subisce una biotrasformazione nel fegato, dove viene de-fosforilata in psilocina da un enzima sconosciuto. Dopo essere entrata nel flusso sanguigno sistemico, la psilocina entra nel cervello, dove ha un effetto psicoattivo. Secondo altri dati, dopo la somministrazione orale, la psilocibina viene rapidamente de-fosforilata nell'ambiente acido dello stomaco o sotto l'azione della fosfatasi alcalina (e di altre esterasi non specifiche) nell'intestino, nei reni ed eventualmente nel sangue, con la formazione di un composto fenolico, la psilocina, che può facilmente attraversare la barriera emato-encefalica. È da notare che la potenza relativa della psilocina rispetto alla psilocibina è quasi identica al rapporto del peso molecolare di questi composti. Il blocco della fosfotasi alcalina da parte di substrati competitivi di β-glicerofosfato livella i sintomi dell'intossicazione. La psilocina subisce entrambe le fasi del metabolismo. La prima fase del metabolismo comprende la deaminazione ossidativa della psilocina a 4-idrossiindolo-3-acetaldeide catalizzata dalla monoamino ossidasi epatica o dall'aldeide deidrogenasi con conseguente ossidazione ad acido 4-idrossi-indolo-3-acetico, 4-idrossi-indolo-3-acetaldeide e 4-idrossitriptofolo. Gli enzimi che partecipano a questo processo non sono stati identificati. Per questo motivo gli inibitori delle MAO possono potenziare gli effetti allucinogeni della psilocibina, così come l'etanolo può potenziare il trip, perché il suo metabolita primario, l'acetaldeide, reagisce in vivo con le ammine endogene, con conseguente formazione di tetraidroisochinoline e β-carboline, inibitori delle MAO. Poiché la psilocibina induce un'inibizione competitiva delle MAO (che metabolizzano la serotonina), il livello di serotonina nel cervello aumenta e contemporaneamente diminuisce la concentrazione di 5-HIAA. Inoltre, esiste una via metabolica insignificante in termini di effetti clinici, che comporta l'ossidazione con la formazione di un prodotto blu scuro, che ha la struttura dell'o-chinone o dell'iminochinone. Questa via è catalizzata dalle ossidasi dell'idrossindolo (ceruloplasmina, ossidasi contenente rame del plasma dei mammiferi, e citocromo ossidasi). I suddetti metaboliti dimostrano un'attività fisiologica insignificante. Quando la psilocibina viene somministrata per via parenterale, le fosfatasi tissutali hanno lo stesso ruolo e quelle dei reni sono tra le più attive. Considerando che il blocco competitivo della de-fosforilazione blocca l'azione psicotropa della psilocibina, è chiaro che la psilocina è il principale metabolita attivo della psilocibina. Entro 5 ore dalla somministrazione orale di psilocibina, fino all'80% della psilocina è presente nel sangue come O-glucuronide coniugato e viene escreto nelle urine senza variazioni. La glucuronidazione del gruppo ossidrilico a psilocinaO-glucuronide è una fase importante della detossificazione, per questo l'idrolisi enzimatica aumenta il tempo di rilevamento nei campioni di urina. Mentre la psilocina subisce un'ampia glucoronidazione da parte delle UDP-glucuronosiltransferasi (UGT)1A10 nell'intestino tenue, l'UGT1A9 contribuisce principalmente alla glucoronidazione dopo l'assorbimento nel sangue. In questo caso, la N-glucuronidazione non avviene durante tutto il metabolismo. Oltre alla via sopra menzionata, la psilocina stessa subisce anche un metabolismo ossidativo. La demetilazione e la desaminazione della 4-idrossiindolo-3-il-acetaldeide (4-HIA) con successiva ossidazione (presumibilmente da parte dell'aldeide deidrogenasi epatica e della monoamino ossidasi) porta alla formazione di acido 4-idrossiindolo-3-acetico (4-HIAA) e 4-idrossitriptofolo (4-HT). Questi metaboliti insignificanti (circa il 4% si disintegra nel modo descritto sopra) possono essere rilevati nel plasma sanguigno umano. La terza via del metabolismo della psilocina prevede l'ossidazione da parte delle idrossindolossidasi, come già detto. La psilocina si distribuisce a tutti i tessuti, compreso il cervello, e viene eliminata entro 24 ore. La maggior parte viene eliminata entro le prime 8 ore (circa il 65% nelle urine e il 15-20% con la bile e le feci). Può essere rilevata nelle urine per 2 settimane. Le concentrazioni più elevate di psilocina si trovano nella neocorteccia, nell'ippocampo, nel sistema motorio extrapiramidale e nella formazione reticolare. Nell'uomo, la psilocibina e la psilocina possono essere rilevate nel plasma sanguigno dopo 20-40 minuti dalla somministrazione orale. Le concentrazioni massime vengono raggiunte in 80-100 minuti e possono essere rilevate entro sei ore. Il periodo di emivita della psilocina nel plasma sanguigno è di circa 2/5 ore dopo la somministrazione orale e di 1,23 ore dopo la somministrazione parenterale. Come già detto, circa l'80% della psilocina nel plasma è in forma coniugata. La psilocina (90-97%) e la psilocibina (3-10%) possono essere rilevate nelle urine immutate o coniugate con acido glucoronico. L'emivita di eliminazione è di circa 50 minuti, la costante di eliminazione è pari a 0,307/h. La maggior parte della sostanza viene eliminata entro le prime tre ore dalla somministrazione orale e viene completamente escreta nelle urine entro 24 ore. La via metabolica completa della psilocibina è stata studiata molto poco e ci sono ancora molte informazioni da raccogliere per determinare gli esatti meccanismi coinvolti nel suo metabolismo.
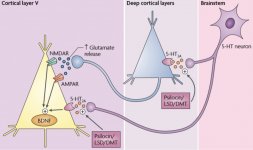
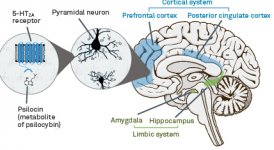
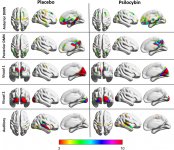
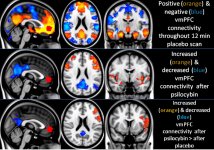
La farmacologia della psilocibina è molto complessa e non è stata sufficientemente studiata. La psilocibina può presumibilmente avere una sua attività insignificante; tuttavia, agisce soprattutto come prodrug della psilocina. Quest'ultima passa facilmente attraverso la barriera emato-encefalica e vi esercita il suo effetto psicoattivo. I principali siti di legame sono riassunti nella tabella precedente. La psilocina ha il legame più forte con i recettori della serotonina: 5-HT1D,2B,2C,5,6,7), ma ha anche un potenziale di legame moderato con i recettori della serotonina (5-HT1A, 1B, 2A). Oltre ai recettori della serotonina, la psilocina ha una certa affinità per i recettori dell'istamina del primo tipo (H1), per i recettori alfa-2A e -2B e per i recettori della dopamina del terzo tipo (D3). Nei neuroni che esprimono il recettore 5HT2A, ma non in quelli knockout 5HT2A, la psilocibina aumenta l'espressione dei geni precoci (erg-1, erg-2, c-fos, jun-B, period-1, gpcr-26, fra-1, N- 10, I-κBα) e riduce l'espressione della sti-chinasi. Inutile dire che la precisa via di segnalazione che porta dal recettore all'attivazione dei geni precoci non è ancora nota. Dato che anche una lisuride non allucinogena attiva il c-fos, è probabile che l'espressione del c-fos rifletta solo l'aumento dell'attività neuronale, mentre l'espressione di egr-1/ egr-2 è specifica per l'effetto allucinogeno. Gonzales-Meaeso ha spiegato questa selettività con la "teoria del traffico agonista della segnalazione recettoriale", secondo cui gli allucinogeni attivano l'eterocomplesso recettoriale 5HT2A/mGlu2 e proteine G diverse rispetto agli agonisti 5-HT2A non allucinogeni. Questa ipotesi è supportata da uno studio in cui topi con il gene knockout per il recettore mGlu2 non mostrano alcun comportamento di head twitch. È stato dimostrato che la psilocilina inibisce il trasportatore di serotonina sodio-dipendente (SERT), con conseguente aumento della concentrazione di serotonina. La serotonina rimane nella fessura sinaptica dopo il suo rilascio, il che porta all'attivazione ripetuta dei neuroni serotoninergici postgangliari. Per quanto riguarda la valutazione dell'affinità di legame ai recettori, essi sono ordinati come segue: 5HT2B > 5HT1D > D1 > 5HT1E > 5HT1A > 5HT5A > 5HT7 > 5HT6 > D3 > 5HT2C > 5HT1B > 5HT2A. È stato dimostrato anche il legame con i recettori imidazolinici del primo tipo. È interessante notare che l'affinità della psilocibina per i recettori 5-Н2А umani è 15 volte superiore a quella dei ratti. L'agonismo dei recettori 5НТ2А e l'attivazione di un numero eccessivo di questi recettori e sottotipi di recettori sono responsabili degli effetti psichedelici unici e intensi provocati dalla psilocibina. In passato si è discusso molto se i recettori 5-НТ2А o 5-НТ2С siano responsabili delle allucinazioni isolate dopo l'ingestione di funghi contenenti psilocibina. Gli studi hanno dimostrato che i 5-НТ2А-antagonisti sopprimono le allucinazioni, mentre gli antagonisti dei 5-НТ2С non hanno né il potenziamento delle allucinazioni né l'effetto di livellamento delle stesse. Pertanto, l'agonismo dei recettori 5-НТ2А è associato all'eccitazione generale dei neuroni, al miglioramento della memoria e dell'apprendimento, alla contrazione del tessuto muscolare liscio vascolare, del tratto gastrointestinale e dei bronchi, a una certa attività antinfiammatoria, all'aumento della produzione di prolattina e ossitocina, dell'ormone adrenocorticotropo e della renina in seguito all'attivazione del sistema renina-angiotensina-aldosterone. Per quanto riguarda l'attivazione del 5-НТ2С da parte della psilocina, si verifica l'attivazione della proopiomelanocortina (precursore dell'ormone α-, β- e γ-stimolante dei melanociti e dell'ormone adrenocorticotropo) e il rilascio di cortisolo. Questi ormoni garantiscono un aumento dell'appetito, della sensibilità all'insulina, del metabolismo del glucosio, della stabilizzazione agli stimoli ansiogeni e stressanti. La psilocina agisce come agonista parziale dei recettori 5-Н1А, che sono espressi principalmente nel nucleo del rafe (DRN) e nel nucleo del rafe mediano (MRN), situati vicino alla linea mediana del tronco encefalico lungo tutta la sua estensione rostro-caudale, come autorecettori somatodendritici. Il MRN promuove l'attivazione dei processi di consolidamento della memoria ed è proiettato all'ippocampo, mentre il VRN è uno dei più grandi nuclei serotoninergici del cervello umano, che fornisce una quantità significativa di innervazione serotoninergica del prosencefalo; inoltre, il MRN ha fibre di proiezione nell'amigdala e nell'ipotalamo, che è associato alla regolazione del ritmo circadiano e di diversi tipi di cellule che producono catecolamine e sostanza-P. Il DRN e il MRN sono ricchi di recettori 5-Н1А presinaptici e la psilocina ha un effetto più volte (5-6 volte) più forte soprattutto sui siti presinaptici rispetto a quelli postsinaptici. Questa preferenza si spiega con l'alta densità di recettori 5-НТ1А, che si trovano in queste aree. Questo certo tipo di recettori, situati sui corpi delle cellule serotoninergiche della zona del rafe, non si trova, ad esempio, sulle membrane postsinaptiche. Gli studi condotti con la fMRI hanno rivelato che la psilocibina riduce significativamente il flusso sanguigno e l'ossigenazione venosa nel cervello. Questo fatto è correlato al suo effetto soggettivo e riduce significativamente la connessione positiva tra due nodi strutturali chiave (mPFC и PCC). È dimostrato che la psilocibina aumenta il metabolismo del glucosio nel cervello. Inoltre, alcuni esperimenti hanno dimostrato che la DMN è cruciale anche per mantenere l'integrazione e le limitazioni cognitive in condizioni normali. Dopo che la psilocina si lega ai recettori presinaptici 5-Н1А dell'area DRN, sopprime gli effetti di quest'area, mentre le cellule sottostanti rimangono intatte e potenziano l'attività simpatica associata al locus coeruleus. Altre localizzazioni dei recettori 5-НТ2А dimostrano una rapida diminuzione dell'attività di questo recettore e una diminuzione della sua densità all'attivazione della psilocina. Quindi, la psilocibina non ha alcuna tolleranza all'azione inibitoria del DRN. È importante notare che gli agonisti selettivi dei recettori 5-НТ1а non sono allucinogeni nel loro nucleo, ma hanno un ruolo nell'influenzare gli effetti inibitori identificati nel DRN.
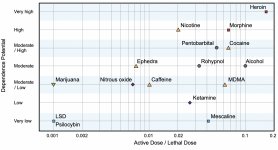
Sebbene i recettori della dopamina del secondo tipo svolgano un ruolo significativo nelle allucinazioni che si formano in varie malattie mentali, si presume che non abbiano una relazione attiva e indiretta con l'azione della psilocina. Questa ipotesi è stata dimostrata per la prima volta da Vollenweider et al. quando hanno scoperto che la somministrazione di galoperidolo (agonista del D2R) non indebolisce gli effetti psicoattivi della psilocina. Anche se gli effetti dopaminergici della psilocina sono considerati minimi, essa ha una capacità di legame relativamente elevata con il recettore D3, rispetto ad altri sottotipi di recettori dopaminergici. Nonostante gli effetti mediati dal D3R siano stati poco studiati, è presumibile che contribuiscano alle proprietà psicoattive caratteristiche della psilocibina e alla sua capacità di causare dipendenza. Il precursore chimico della psilocina, la 4-acetossi-N,N-dimetiltriptamina, ha il gruppo fosforilossico sostituito da un gruppo acetossi. Viene metabolizzata allo stesso modo del gruppo fosforilossico e questa modifica consente di aggirare alcuni processi metabolici della prima fase. Nonostante la psilacetina sia una sostituzione farmacologica identica a quella della psilocibina, molti utenti riferiscono di avere alcune differenze insignificanti ma distinguibili tra loro. La psilacetina viene spesso descritta come una sostanza con un inizio d'azione più rapido, che non comporta ansia e nausea (che sono associate all'uso di psilocibina a causa della mancanza di chitina, solitamente contenuta nei funghi) e ha una durata più breve. È noto che la dose letale mediana nei ratti è di circa 293 mg/kg, il che indica un'enorme finestra terapeutica della psilocina. La tachifilassi, ovvero la rapida desensibilizzazione a una sostanza che porta a una diminuzione dell'effetto fisiologico, è un fenomeno associato all'uso di molti allucinogeni. La tolleranza alla psilocibina inizia a svilupparsi già dopo il primo uso singolo. Il meccanismo prevede una risposta fisiologica all'eccessiva stimolazione dei recettori 5-НТ2А con una rapida riduzione dei siti recettoriali e una diminuzione della densità dei recettori sulla cellula. In generale, si ritiene che questi siti recettoriali tornino al cinquanta per cento del livello originale in 3-7 giorni dall'uso iniziale. Ritornano alla quantità originale in 4 settimane, a seconda della dose e della durata dell'uso ripetuto. Inoltre, esiste una tolleranza incrociata tra le classi di allucinogeni indole-alchilamina e fenilalchilamina.
Attachments
-
 aDjgnEic18.jpg572.2 KB · Views: 1,641
aDjgnEic18.jpg572.2 KB · Views: 1,641 -
 sRHGpjI9LU.jpg788.9 KB · Views: 1,613
sRHGpjI9LU.jpg788.9 KB · Views: 1,613 -
 TQv018fRJh.jpg128.6 KB · Views: 959
TQv018fRJh.jpg128.6 KB · Views: 959 -
lF1rOfpW8k.jpg2.6 MB · Views: 993
-
 TSkYz5Gq6P.jpg363.8 KB · Views: 1,773
TSkYz5Gq6P.jpg363.8 KB · Views: 1,773 -
 sPlo2QDBMe.jpg551.6 KB · Views: 1,744
sPlo2QDBMe.jpg551.6 KB · Views: 1,744 -
 AxRV2Hfutv.jpg697.8 KB · Views: 1,766
AxRV2Hfutv.jpg697.8 KB · Views: 1,766 -
 b2Ma0wsVTD.jpg607.2 KB · Views: 1,838
b2Ma0wsVTD.jpg607.2 KB · Views: 1,838 -
 QtXjIHo7PJ.jpg438.5 KB · Views: 1,635
QtXjIHo7PJ.jpg438.5 KB · Views: 1,635 -
 rI0YMKgE6z.jpg1.1 MB · Views: 1,777
rI0YMKgE6z.jpg1.1 MB · Views: 1,777 -
 Q1ueUSGlFN.jpg614.4 KB · Views: 1,787
Q1ueUSGlFN.jpg614.4 KB · Views: 1,787
Last edited by a moderator:
