Mefedron (4-metylometkatynon) jest β-ketoamfetaminą, stymulującym narkotykiem o bliskim strukturalnym i mechanistycznym podobieństwie do metamfetaminy. Jednym z najsilniejszych działań związanych z mefedronem jest zdolność do stymulowania uwalniania dopaminy (DA) i blokowania jej wychwytu zwrotnego poprzez interakcję z transporterem dopaminy (DAT). Chociaż mefedron nie powoduje toksyczności dla zakończeń nerwowych DA, jego zdolność do blokowania DAT może zapewnić ochronę przed neurotoksycznością wywołaną metamfetaminą, podobnie jak inne inhibitory DAT. Aby sprawdzić tę możliwość, myszom podawano mefedron (10, 20 lub 40 mg/kg) przed każdym wstrzyknięciem neurotoksycznego schematu metamfetaminy (4 wstrzyknięcia 2,5 lub 5,0 mg/kg w odstępach 2-godzinnych). Integralność zakończeń nerwowych DA w prążkowiu oceniano za pomocą pomiarów poziomów DA, DAT i hydroksylazy tyrozynowej. Umiarkowana do ciężkiej toksyczność DA związana z różnymi dawkami metamfetaminy nie była powstrzymywana przez żadną dawkę mefedronu, ale w rzeczywistości była znacznie zwiększona. Hipertermia wywołana połączonym leczeniem mefedronem i metamfetaminą była taka sama, jak obserwowana po podaniu każdego z tych leków osobno. Mefedron wzmacniał również neurotoksyczne działanie amfetaminy i MDMA na zakończenia nerwowe DA. Natomiast nomifensyna chroniła przed neurotoksycznością wywołaną metamfetaminą. Ponieważ mefedron zwiększa neurotoksyczność metamfetaminy, obecne wyniki sugerują, że oddziałuje on z DAT w sposób odmienny od innych typowych inhibitorów DAT. Stosunkowo nieszkodliwy wpływ samego mefedronu na zakończenia nerwowe DA maskuje potencjalnie niebezpieczną interakcję z lekami, które często są z nim współużytkowane, prowadząc do zwiększonej neurotoksyczności.
Mefedron (4-metylometkatynon) jest pochodną katynonu i strukturalnym analogiem metamfetaminy i 3,4-metylenodioksy-metamfetaminy (MDMA). Mefedron jest jednym z psychoaktywnych składników "soli do kąpieli" wraz z innymi związkami, takimi jak metylon, butylon i 3,4-metylenodioksypyrowaleron (MDPV). β-ketoamfetaminy są nadużywane w coraz większym stopniu ze względu na wysoce ograniczoną dostępność prekursorów potrzebnych do syntezy metamfetaminy i MDMA w tajnych laboratoriach oraz odpowiednie zmniejszenie ich czystości (Winstock i in. 2011b, Brunt i in. 2011). Ponieważ nadużywanie β-ketoamfetamin wciąż rośnie, lista ich negatywnych skutków powiększyła się o powikłania sercowo-naczyniowe, pobudzenie, bezsenność, psychozę i depresję (Schifano i in. 2011, Prosser i Nelson 2012).
Jako chemiczne kongenery metamfetaminy i MDMA, nie jest zaskakujące, że β-ketoamfetaminy mają wiele takich samych skutków jak te pierwsze narkotyki na ośrodkowy układ nerwowy. Na przykład, narkotyki te blokują transportery dopaminy (DA) i serotoniny (5-HT) (odpowiednio DAT i SERT) (Cozzi i wsp. 1999, Rothman i wsp. 2003, Fleckenstein i wsp. 2000, Lopez-Arnau i wsp. 2012) i stymulują uwalnianie monoamin in vitro (Kalix i Glennon 1986, Gygi i wsp. 1997, Rothman i wsp. 2003) oraz in vivo (Gygi i wsp. 1997, Kehr i wsp. 2011). Metkatynon powoduje trwałe zmniejszenie aktywności hydroksylazy tryptofanu i hydroksylazy tyrozyny (TH) oraz wyczerpanie DA i 5-HT (Gygi i wsp. 1997, Gygi i wsp. 1996, Sparago i wsp. 1996). Badania obrazowania PET u abstynentów stosujących metkatynon wykazały zmniejszoną gęstość DAT w prążkowiu, co sugeruje utratę terminali DA (McCann i in. 1998). Jednoczesna stymulacja uwalniania DA i hamowanie jej wychwytu odzwierciedlają krytyczne elementy leżące u podstaw neurotoksyczności związanej z metamfetaminą (Kuhn i in. 2008, Yamamoto i Bankson 2005, Cadet i in. 2007, Fleckenstein i in. 2007).
My (Angoa-Perez et al. 2012) i inni (Baumann et al. 2012, Hadlock et al. 2011) niedawno zbadaliśmy możliwość, że mefedron może powodować neurotoksyczność jak metamfetamina i MDMA. Co zaskakujące, mefedron nie był toksyczny dla zakończeń nerwowych DA w prążkowiu (Hadlock i wsp. 2011, Baumann i wsp. 2012, Angoa-Perez i wsp. 2012). Kwestia tego, czy mefedron uszkadza zakończenia nerwowe 5-HT pozostaje nierozstrzygnięta, ponieważ jedno badanie udokumentowało pozytywne efekty (Hadlock et al. 2011), podczas gdy inne było negatywne (Baumann et al. 2012). W świetle stosunkowo łagodnego wpływu mefedronu na zakończenia nerwowe DA i biorąc pod uwagę jego właściwości jako blokera DAT, postawiliśmy hipotezę, że może on faktycznie chronić układ neuronów DA przed neurotoksycznym działaniem metamfetaminy, podobnie jak ma to miejsce w przypadku innych blokerów DAT, takich jak kwas amfonelowy (Pu i wsp. 1994, Schmidt i Gibb 1985, Marek i wsp. 1990) i nomifensyna (Poth i wsp. 2012). Obecnie donosimy, że mefedron znacząco zwiększa neurotoksyczność metamfetaminy. Efekt ten rozciąga się na amfetaminę i MDMA, narkotyki, które są często nadużywane razem z mefedronem (Feyissa i Kelly 2008, Schifano i wsp. 2011). Te zaskakujące wyniki stawiają nadużywanie mefedronu w nowym świetle i dodają pilnej potrzeby uznania tej subtelnej i niebezpiecznej właściwości tej β-ketoamfetaminy.
Materiały i metody
Narkotyki i odczynniki
Chlorowodorek mefedronu i 3,4-metylenodioksymetamfetamina (MDMA) zostały uzyskane z NIDA Research Resources Drug Supply Program. (+) Chlorowodorek metamfetaminy, maleinian nomifensyny, siarczan d-amfetaminy, pentobarbital, DA oraz wszystkie bufory i odczynniki HPLC zostały zakupione od Sigma-Aldrich (St. Louis, MO, USA). Zestawy do oznaczania białka kwasu bicinchoninowego otrzymano od firmy Pierce (Rockford, IL, USA). Przeciwciała poliklonalne przeciwko TH szczura zostały wyprodukowane zgodnie z wcześniejszym opisem (Kuhn i Billingsley 1987). Przeciwciała monoklonalne przeciwko DAT szczura zostały hojnie dostarczone przez dr Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA). Drugorzędowe przeciwciała anty-IgG sprzężone z HRP zostały dostarczone przez Jackson ImmunoResearch Laboratories, Inc (West Grove, PA, USA).
Zwierzęta
Samice myszy C57BL/6 (Harlan, Indianapolis, IN, USA) ważące 20-25 g w czasie eksperymentu były trzymane po 5 na klatkę w dużych klatkach typu shoe-box w jasnym (12 h światła/ciemności) i kontrolowanym temperaturowo pomieszczeniu. Użyto samic myszy, ponieważ wiadomo, że są one bardzo wrażliwe na uszkodzenia neuronów przez neurotoksyczne amfetaminy i aby zachować spójność z naszymi wcześniejszymi badaniami neurotoksyczności metamfetaminy (Thomas i wsp. 2010, Thomas i wsp. 2008, Thomas i wsp. 2009). Myszy miały swobodny dostęp do pożywienia i wody. Instytucjonalny Komitet ds. Opieki nad Zwierzętami i Stosowania Procedur Wayne State University zatwierdził opiekę nad zwierzętami i procedury eksperymentalne. Wszystkie procedury były również zgodne z NIH Guide for the Care and Use of Laboratory Animals.
Procedury farmakologiczne, fizjologiczne i behawioralne
Myszy leczono mefedronem przy użyciu schematu przypominającego binge, składającego się z 4 wstrzyknięć 10, 20 lub 40 mg/kg z 2-godzinną przerwą między każdym wstrzyknięciem. Ten schemat leczenia, gdy jest stosowany do wstrzykiwania podstawionych amfetamin i pochodnych katynonu, powoduje rozległe uszkodzenie zakończenia nerwu DA. Stosowane obecnie dawki mefedronu okazały się wcześniej nietoksyczne dla zakończeń nerwowych DA (Angoa-Perez et al. 2012). Myszy leczono metamfetaminą (4X 2,5 lub 5 mg/kg), amfetaminą (4X 5 mg/kg) lub MDMA (4X 20 mg/kg) samodzielnie lub w połączeniu z mefedronem. W przypadku leczenia dwoma lekami, myszy otrzymywały zastrzyk mefedronu 30 minut przed każdym z 4 zastrzyków metamfetaminy, amfetaminy lub MDMA. Osobom kontrolnym wstrzykiwano sól fizjologiczną według tego samego schematu, co w przypadku samego mefedronu lub w połączeniu z innymi amfetaminami. Jako kontrolę wpływu inhibitora DAT na toksyczność metamfetaminy, myszom podawano nomifenzynę (4X 5 mg/kg) 30 minut przed każdym wstrzyknięciem metamfetaminy (4X 5 mg/kg). Wszystkie zastrzyki podawano drogą dożylną. Myszy uśmiercano 2 dni po ostatnim podaniu leku, gdy neurotoksyczność związana z amfetaminą osiągnęła maksimum. Temperaturę ciała monitorowano telemetrycznie za pomocą wszczepialnych transponderów temperatury IPTT-300 firmy Bio Medic Data Systems, Inc. (Seaford, DE, USA). Temperatury były rejestrowane nieinwazyjnie co 20 minut, począwszy od 60 minut przed pierwszym wstrzyknięciem METH i kontynuowane przez 9 godzin później przy użyciu systemu konsoli DAS-5001 firmy Bio Medic.
Określenie zawartości DA w prążkowiu
Tkankę prążkowia wycięto obustronnie z mózgu po leczeniu i przechowywano w temperaturze -80°C. Zamrożone tkanki zważono i poddano sonikacji w 10 objętościach 0,16 N kwasu nadchlorowego w temperaturze 4°C. Nierozpuszczalne białko usunięto przez odwirowanie, a DA oznaczono metodą HPLC z detekcją elektrochemiczną, jak opisano wcześniej dla metamfetaminy (Thomas i in. 2010, Thomas i in., 2009).
Oznaczanie poziomów białek TH i DAT metodą immunoblottingu
Wpływ leczenia farmakologicznego na poziomy TH i DAT w prążkowiu określono metodą immunoblottingu jako wskaźnik toksyczności dla zakończeń nerwowych DA w prążkowiu. Myszy uśmiercono przez dekapitację po leczeniu, a prążkowie wycięto obustronnie. Tkankę przechowywano w temperaturze -80°C. Zamrożoną tkankę rozbijano przez sonikację w 1% SDS w temperaturze 95°C, a nierozpuszczalny materiał sedymentowano przez odwirowanie. Białko oznaczono metodą kwasu dwuchoninowego, a równe ilości białka (70 μg/pas) rozdzielono za pomocą elektroforezy w żelu SDS-poliakryloamidowym, a następnie elektroblotowano na nitrocelulozie. Bloty blokowano w soli fizjologicznej buforowanej Tris zawierającej Tween 20 (0,1% v/v) i 5% suchego mleka beztłuszczowego przez 1 godzinę w temperaturze pokojowej. Pierwotne przeciwciała przeciwko TH (1:1000) lub DAT (1:1000) dodano do blotów i pozostawiono do inkubacji przez 16 godzin w temperaturze 4°C. Bloty płukano 3-krotnie w soli fizjologicznej buforowanej Tris w celu usunięcia nieprzereagowanych przeciwciał, a następnie inkubowano z drugorzędowym przeciwciałem anty-IgG sprzężonym z HRP (1:4000) przez 1 godzinę w temperaturze pokojowej. Immunoreaktywne prążki wizualizowano za pomocą wzmocnionej chemiluminescencji, a względną gęstość prążków reagujących z TH i DAT określono przez obrazowanie za pomocą Kodak Image Station (Carestream Molecular Systems, Rochester, NY, USA) i oceniono ilościowo za pomocą oprogramowania ImageJ (NIH).
Analiza danych
Dwukierunkowe ANOVA przeprowadzono w celu analizy wpływu dawki metamfetaminy w porównaniu z mefedronem na DA, DAT i TH. Wpływ leczenia farmakologicznego na zawartość DA, TH i DAT w prążkowiu testowano pod kątem istotności za pomocą jednokierunkowej ANOVA, a następnie testu wielokrotnego porównania Tukeya. Wyniki leczenia lekami na temperaturę rdzenia ciała w czasie analizowano za pomocą dwukierunkowej ANOVA, a następnie testu Bonferroniego w celu określenia istotności różnic w temperaturze w poszczególnych okresach po leczeniu. Różnice uznano za istotne, jeśli p < 0,05. Wszystkie analizy statystyczne przeprowadzono przy użyciu GraphPad Prism w wersji 5.02 dla Windows (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Przejdź do:
Wyniki
Wpływ mefedronu na neurotoksyczność wywołaną metamfetaminą
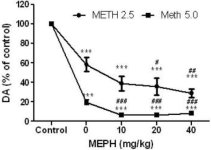
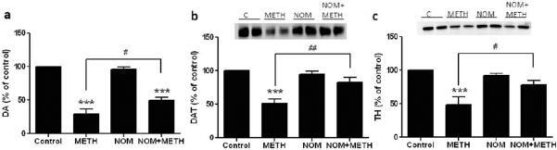
Mefedron w dawkach (10, 20 lub 40 mg/kg), o których wiadomo, że nie powodują toksyczności zakończeń nerwowych DA (Angoa-Perez i wsp. 2012) podawano 30 min przed każdym wstrzyknięciem metamfetaminy. Metamfetaminę podawano w dawkach powodujących umiarkowane (4X 2,5 mg/kg) lub poważne (4X 5 mg/kg) uszkodzenie zakończeń nerwowych DA prążkowia (Thomas i wsp. 2004, Thomas i wsp. 2010). Wyniki przedstawione na rycinie 1 pokazują, że główny wpływ dawki metamfetaminy (F1,40 = 66,60, p < 0,0001) i dawki mefedronu (F4,40 = 131,3, p < 0,0001) na poziomy DA w prążkowiu był wysoce istotny w dwukierunkowej ANOVA. Główny efekt mefedronu podawanego w połączeniu z 2,5 mg/kg (F4,22 = 35,96, p < 0,001) lub 5,0 mg/kg metamfetaminy (F4,17 = 953,9, p < 0,0001) był również wysoce istotny w jednokierunkowej ANOVA. Wszystkie zabiegi z użyciem dowolnej dawki metamfetaminy ± mefedronu spowodowały znacznie większe zmniejszenie DA w porównaniu z odpowiednią kontrolą (p < 0,0001 dla wszystkich). Ryc. 1 pokazuje również, że dawki mefedronu 20 (p < 0,01) i 40 mg/kg (p < 0,001) znacząco wzmocniły uszczuplający wpływ metamfetaminy 2,5 mg/kg na DA, podczas gdy wszystkie dawki mefedronu znacząco wzmocniły wpływ metamfetaminy 5,0 mg/kg na poziomy DA (p < 0,0001 dla wszystkich).
Rys.1
Wpływ mefedronu na indukowane metamfetaminą zmniejszenie DA w prążkowiu. Myszy leczono wskazanymi dawkami mefedronu (MEPH) 30 minut przed każdym wstrzyknięciem 2,5 (-) lub 5,0 mg/kg (■) metamfetaminy (METH) i uśmiercano 2d później w celu oznaczenia poziomów prążkowia DA za pomocą HPLC. Dane są średnie ± SEM dla 5-7 myszy na grupę. Niektóre słupki błędów były zbyt małe, aby przekroczyć rozmiar symboli i nie są widoczne. ***p < 0,001 vs kontrole i #p < 0,01, ##p < 0,001 lub ###p < 0,0001 vs odpowiednia dawka metamfetaminy (test porównań wielokrotnych Tukeya).
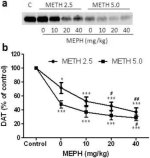
Ryc. 2a pokazuje, że mefedron znacząco zwiększył indukowane metamfetaminą obniżenie poziomu DAT, jak określono za pomocą immunoblottingu. Immunobloty poddano analizie ilościowej i zgodnie z wynikami dla DA, główny wpływ dawki metamfetaminy (F1,92 = 9,48, p < 0,001) i dawki mefedronu (F4,92 = 37,56, p < 0,0001) na poziomy DAT w prążkowiu był wysoce istotny w dwukierunkowej ANOVA (ryc. 2b). Główny efekt mefedronu podawanego w połączeniu z 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) lub 5,0 mg/kg metamfetaminy (F4,39 = 24,84, p < 0,0001) był również wysoce istotny w jednokierunkowej ANOVA. Wszystkie zabiegi z użyciem dowolnej dawki metamfetaminy ± mefedronu spowodowały znacznie większe zmniejszenie DAT w porównaniu z odpowiednią kontrolą (p < 0,01 dla samej metamfetaminy 2,5 mg/kg; p < 0,0001 dla wszystkich innych zabiegów). Rys. 2b pokazuje również, że dawki mefedronu 20 mg/kg (p < 0,01) i 40 mg/kg (p < 0,001) znacząco zwiększyły redukcję DAT spowodowaną przez 2,5 mg/kg metamfetaminy, podczas gdy tylko dawka 40 mg/kg mefedronu znacząco zwiększyła (p < 0,01) wpływ 5,0 mg/kg metamfetaminy na redukcję DAT.
Rys. 2
Wpływ mefedronu na indukowane metamfetaminą zmniejszenie DAT w prążkowiu. Myszy leczono wskazanymi dawkami mefedronu (MEPH) 30 minut przed każdym wstrzyknięciem 2,5 (●) lub 5,0 mg/kg (■) metamfetaminy (METH) i uśmiercano 2d później w celu określenia poziomów DAT w prążkowiu metodą immunoblottingu (a). Plamy zostały ocenione ilościowo za pomocą ImageJ, a dane są średnie ± SEM dla 10-12 myszy na grupę (b). *p < 0,01 lub ***p < 0,0001 vs kontrola (C) i #p < 0,01 lub ##p < 0,001 vs odpowiednia dawka metamfetaminy (test porównań wielokrotnych Tukeya).
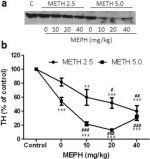
Ryc. 3a pokazuje, że mefedron znacząco zwiększył indukowane metamfetaminą obniżenie poziomu TH, jak określono za pomocą immunoblottingu. Immunobloty poddano analizie ilościowej i zgodnie z powyższymi wynikami dla DA i DAT, główne efekty dawki metamfetaminy (F1,81 = 47,89, p < 0,0001) i dawki mefedronu (F4,81 = 63,57, p < 0,0001) były wysoce istotne w dwukierunkowej ANOVA (ryc. 3b). Główny efekt mefedronu podawanego w połączeniu z 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) lub 5,0 mg/kg metamfetaminy (F4,49 = 99,16, p < 0,0001) był również wysoce istotny w jednokierunkowej ANOVA. Wszystkie zabiegi z użyciem dowolnej dawki metamfetaminy ± mefedronu spowodowały znacznie większe zmniejszenie TH w porównaniu z odpowiednią kontrolą (p < 0,001 dla 2,5 mg/kg metamfetaminy + 10 mg/kg mefedronu; p < 0,0001 dla wszystkich innych kombinacji), z wyjątkiem samej metamfetaminy w dawce 2,5 mg/kg, która nie zmieniła znacząco poziomów TH (tj. brak toksyczności). Rys. 3b pokazuje również, że dawki mefedronu wynoszące 20 mg/kg (p < 0,01) i 40 mg/kg (p < 0,001) znacząco zwiększyły redukcję TH spowodowaną przez metamfetaminę w dawce 2,5 mg/kg, a wszystkie trzy dawki mefedronu znacząco (p < 0,0001) zwiększyły wpływ metamfetaminy w dawce 5,0 mg/kg na redukcję TH.
Rys. 3
Wpływ mefedronu na indukowane metamfetaminą zmniejszenie TH w prążkowiu. Myszy leczono wskazanymi dawkami mefedronu (MEPH) 30 minut przed każdym wstrzyknięciem 2,5 (●) lub 5,0 mg/kg (■) metamfetaminy (METH) i uśmiercano 2d później w celu określenia poziomów TH w prążkowiu metodą immunoblottingu (a). Bloty zostały ocenione ilościowo za pomocą ImageJ, a dane są średnie ± SEM dla 10-12 myszy na grupę (b). Niektóre słupki błędów były zbyt małe, aby przekroczyć rozmiar symboli i nie są widoczne. **p < 0,001 lub ***p < 0,0001 vs kontrola (C) i #p < 0,01, ##p < 0,001 lub ###p < 0,0001) vs odpowiednia dawka metamfetaminy (test porównań wielokrotnych Tukeya).
Wpływ mefedronu na hipertermię wywołaną metamfetaminą
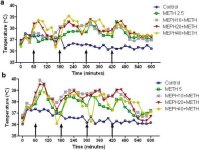
Mefedron, podobnie jak metamfetamina, powoduje znaczną hipertermię (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Gdy mefedron podawano 30 minut przed każdym wstrzyknięciem metamfetaminy, na ryc. 4 widać, że główne efekty dawek metamfetaminy i mefedronu (F1,300 = 11,99, p < 0,0001) w czasie (F4,300 = 51,73, p < 0,0001) były wysoce znaczące w dwukierunkowej ANOVA. Główne efekty mefedronu podawanego w połączeniu z 2,5 mg/kg metamfetaminy (F4,120 = 41,44, p < 0,0001, panel a) w czasie (F30,120 = 3,84, p < 0,0001) lub 5,0 mg/kg metamfetaminy (F4,120 = 78,09, p < 0,0001, panel b) w czasie (F30,120 = 9,98, p < 0,0001) były również wysoce istotne w dwukierunkowej ANOVA. Wszystkie zabiegi z dowolną dawką metamfetaminy ± mefedronu różniły się znacząco od odpowiednich kontroli (p < 0,0001 dla wszystkich zabiegów).
Rys. 4
Wpływ mefedronu na hipertermię wywołaną metamfetaminą. Myszy leczono wskazanymi dawkami mefedronu (MEPH) 30 minut przed każdym wstrzyknięciem 2,5 (a) lub 5,0 mg/kg (b) metamfetaminy (METH). Temperaturę rdzenia mierzono w odstępach 20-minutowych za pomocą telemetrii, począwszy od 60 minut przed pierwszym wstrzyknięciem metamfetaminy. 4 zastrzyki metamfetaminy są oznaczone strzałkami spoczywającymi na osi x. Dane są wyrażone jako średnia temperatura ciała 6-8 myszy na grupę. SEM zawsze wynosiły < 10% średniej i zostały pominięte ze względu na przejrzystość.
Wpływ mefedronu na neurotoksyczność wywołaną amfetaminą i MDMA
Aby sprawdzić, czy wzmacniające działanie mefedronu na metamfetaminę można rozszerzyć na inne neurotoksyczne amfetaminy, myszy leczono tą β-ketoamfetaminą (20 mg/kg) plus amfetaminą (4X 5 mg/kg) lub MDMA (4X 20 mg/kg), a wyniki przedstawiono na ryc. 5. Przypomnijmy, że sam mefedron nie zmniejsza prążkowia DA, DAT ani TH (Angoa-Perez i wsp. 2012). Główny efekt leku (F5,27 = 27.18, p < 0.0001) był wysoce znaczący w jednokierunkowej ANOVA dla redukcji DA (ryc. 5a). Na ryc. 5a można również zauważyć, że wszystkie terapie amfetaminą (p < 0,001) lub MDMA (p < 0,001) samodzielnie lub w połączeniu z mefedronem (p < 0,0001 dla obu leków) znacząco obniżyły poziom DA w stosunku do kontroli. Mefedron znacząco zwiększył redukcję DA spowodowaną przez amfetaminę (p < 0,01) lub MDMA (p < 0,01). Ryc. 5b pokazuje podobny wpływ leczenia skojarzonego na poziomy DAT w prążkowiu. Główny efekt leku (F4,49 = 42,63, p < 0,0001) był wysoce znaczący w jednokierunkowej ANOVA dla DAT. Można również zauważyć na ryc. 5b, że wszystkie terapie amfetaminą lub MDMA były znacząco (p < 0,0001 dla wszystkich) niższe w porównaniu z kontrolą. Mefedron również znacząco zwiększył redukcję DAT spowodowaną przez amfetaminę lub MDMA (p < 0.0001 w obu przypadkach). Wreszcie, ryc. 5c pokazuje, że główny efekt leku (F4,50 = 75,06, p < 0,0001) był wysoce znaczący w jednokierunkowej ANOVA dla redukcji TH. Na ryc. 5c widać również, że wszystkie terapie amfetaminą lub MDMA były znacząco (p < 0,0001 dla wszystkich) niższe w porównaniu do kontroli. Mefedron również znacząco zwiększył redukcję TH spowodowaną przez amfetaminę lub MDMA (p < 0,0001 w obu przypadkach)
Rys. 5
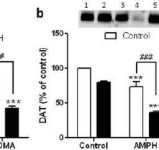
Wpływ mefedronu na neurotoksyczność zakończeń nerwowych DA wywołaną amfetaminą lub MDMA. Myszy leczono 20 mg/kg mefedronu (MEPH) 30 min przed każdym wstrzyknięciem 5,0 mg/kg amfetaminy (AMPH) lub 20 mg/kg MDMA i uśmiercano 2d po leczeniu w celu określenia poziomów prążkowia (a) DA za pomocą HPLC. (b) DAT i (c) TH określono za pomocą immunoblottingu, a bloty określono ilościowo za pomocą ImageJ. Reprezentatywne immunobloty dla DAT i TH są zawarte jako wstawki do paneli (b) i (c), a leczenie dla obu paneli jest oznaczone przez 1,5: kontrola; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; i 8: MDMA + MEPH. Dane są średnimi ± SEM dla 5-12 myszy w każdej grupie. **p < 0,001 lub ***p < 0,0001 vs kontrola i #p < 0,01 lub ###p < 0,0001 vs AMPH lub MDMA (test porównań wielokrotnych Tukeya).
Wpływ nomifenzyny na neurotoksyczność wywołaną metamfetaminą
Nomifensyna, silny bloker DAT bez znanego potencjału nadużywania lub neurotoksyczności, została przetestowana pod kątem jej zdolności do ochrony przed neurotoksycznością indukowaną metamfetaminą oraz w przeciwieństwie do działania mefedronu na toksyczność zakończeń nerwowych DA wywołaną przez metamfetaminę, amfetaminę i MDMA. Wyniki na ryc. 6a pokazują, że główny wpływ leku (F3,16 = 63,39, p < 0,0001) na poziomy DA był wysoce istotny w jednokierunkowej ANOVA. Sama nomifensyna nie zmieniała poziomów DA, ale redukcja spowodowana metamfetaminą (p < 0,0001) była nieznacznie, ale znacząco odwrócona przez nomifensynę (p < 0,01). Główny wpływ leku (F3,20 = 16,78, p < 0,0001) na poziomy DAT był wysoce znaczący w jednokierunkowej ANOVA, jak pokazano na ryc. 6b. Nomifensyna nie zmieniła poziomów DAT, ale zapewniła znaczną ochronę (p < 0.001) przed zmniejszeniem DAT prążkowia spowodowanym przez metamfetaminę (p < 0.0001) w porównaniu z kontrolą. Wreszcie ryc. 6c pokazuje, że główny wpływ leku (F3,15 = 14.10, p < 0.0001) na poziomy TH był wysoce istotny w jednokierunkowej ANOVA. Jak zaobserwowano w przypadku DA i DAT, zmniejszeniu TH spowodowanemu przez metamfetaminę (p < 0.0001) nieznacznie, ale znacząco zapobiegła nomifensyna (p < 0.01).
Rys. 6
Wpływ nomifenzyny na neurotoksyczność zakończeń nerwowych DA wywołaną metamfetaminą. Myszy leczono 5,0 mg/kg nomifenzyny (NOM) 30 min przed każdym wstrzyknięciem 5,0 mg/kg metamfetaminy (METH) i uśmiercano 2d później w celu określenia poziomów prążkowia (a) DA za pomocą HPLC. (b) DAT i (c) TH określono za pomocą immunoblottingu, a bloty określono ilościowo za pomocą ImageJ. Reprezentatywne immunobloty dla DAT i TH są zawarte jako wstawki do paneli (b) i (c). Dane są średnią plus SEM dla 5-7 myszy na grupę. ***p < 0.0001 vs kontrola (C) i #p < 0.01 lub ##p < 0.001 vs sama metamfetamina (test wielokrotnego porównania Tukeya).
Dyskusja
Celem niniejszego badania było ustalenie, czy mefedron zapobiegnie toksyczności zakończeń nerwowych DA wywołanej przez metamfetaminę. Opierając się na jego podobieństwie chemicznym do metamfetaminy i MDMA, początkowo oczekiwano, że mefedron będzie wywierał szkodliwy wpływ na układ neuronów DA. Jednak kilka badań niemal jednocześnie wykazało, że mefedron nie jest toksyczny dla zakończeń nerwowych DA (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Pytanie, czy lek ten powoduje uszkodzenie układu neuronalnego 5-HT pozostaje otwarte. Jedno z badań wykazało trwałe zmniejszenie funkcji zakończeń nerwowych 5-HT (Hadlock i wsp. 2011), podczas gdy inne wykazało, że mefedron nie powoduje uszkodzeń (Baumann i wsp. 2012). Mefedron oddziałuje z zakończeniem nerwowym DA w sposób, który sugeruje, że rzeczywiście stymuluje uwalnianie i blokuje wychwyt zwrotny DA poprzez interakcje z DAT. Kluczowym aspektem neurotoksycznego mechanizmu działania metamfetaminy jest jej zdolność do uzyskiwania dostępu do zakończeń nerwowych DA poprzez DAT i zakłócania homeostazy DA (Sulzer 2011). Jeśli ten wczesny etap w neurotoksycznej kaskadzie metamfetaminy zostanie powstrzymany przez zahamowanie DAT, toksyczność zostanie powstrzymana (Pu i wsp. 1994, Poth i wsp. 2012, Marek i wsp. 1990, Schmidt i Gibb 1985). Uznaliśmy, że mefedron może mieć tę samą właściwość ochronną, co inne inhibitory DAT, ale zamiast tego zaobserwowaliśmy znaczne zwiększenie toksyczności. Interakcję tę zaobserwowano przy użyciu dwóch różnych dawek metamfetaminy, które powodują umiarkowane lub poważne uszkodzenie zakończeń nerwowych DA (odpowiednio 4X 2,5 lub 5,0 mg/kg). To nasilające działanie mefedronu nie ograniczało się do metamfetaminy i rozciągało się na amfetaminę i MDMA, dwa narkotyki, które są często nadużywane razem z mefedronem i innymi β-ketoamfetaminami (Feyissa i Kelly 2008, Schifano i wsp. 2011, Kelly 2011). Dlatego też, pomimo faktu, że mefedron nie powoduje toksyczności przynajmniej zakończeń nerwowych DA prążkowia, nasila on neurotoksyczne działanie innych nadużywanych narkotyków. To nowe odkrycie powinno postawić nadużywanie mefedronu w jeszcze ostrzejszym świetle, ponieważ jego brak wewnętrznej neurotoksyczności może sprawiać, że wydaje się on nieszkodliwy.
Hipertermia jest powszechnie zgłaszanym ostrym działaniem niepożądanym po spożyciu metamfetaminy (Greene i in. 2008) i β-ketoamfetaminy u ludzi (Borek i Holstege 2012, Prosser i Nelson 2012). Podobnie jak metamfetamina, wiele β-ketoamfetamin również powoduje znaczne podwyższenie temperatury ciała u gryzoni (Angoa-Perez i wsp. 2012, Hadlock i wsp. 2011, Baumann i wsp. 2012, Rockhold i wsp. 1997). Podczas gdy hipertermia wywołana przez metamfetaminę może przyczyniać się do jej morfologicznych i neuronalnych szkodliwych skutków, niekoniecznie jest tak, że hipertermia jest bezpośrednią przyczyną tych skutków (Kiyatkin i Sharma 2009). Rejestrowaliśmy temperaturę ciała u myszy leczonych mefedronem i metamfetaminą i zaobserwowaliśmy, że połączone leczenie nie zwiększyło temperatury poza maksymalny wzrost obserwowany po podaniu samego leku. Metamfetamina powodowała zależny od dawki wzrost temperatury ciała, a hipertermia ta była niezmienna w całym badanym zakresie dawek mefedronu. W rzeczywistości, spadek temperatury ciała obserwowany po wstrzyknięciu mefedronu (Angoa-Perez et al. 2012) utrzymywał się przy wyższych dawkach mefedronu i metamfetaminy. Mimo że hipertermia wywołana lekami nie została wzmocniona przez skojarzone leczenie lekami, efekty neurotoksyczne były addytywne. Dlatego też, przynajmniej w tym przypadku, wydaje się, że neurotoksyczne działanie metamfetaminy może być wzmocnione przez mefedron w sposób niezależny od hipertermii.
Mefedron wyraźnie hamuje funkcję DAT i blokuje wychwyt zwrotny DA in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). Mefedron wypiera WIN-35,428 z jego miejsca wiązania na DAT, co sugeruje, że jest on konkurencyjnym inhibitorem wychwytu DA (Martinez-Clemente i wsp. 2012, Lopez-Arnau i wsp. 2012). Siła działania mefedronu pod tym względem jest bardzo podobna do metamfetaminy (Cozzi i in. 1999) i MDMA (Escubedo i in. 2011). Nie wiadomo, czy mefedron jest transportowany przez DAT, ale metkatynon tak (Cozzi i Foley 2003). Nomifensyna i kwas amfonelowy, które wiążą się z DAT i hamują wychwyt DA, zapewniają znaczną ochronę przed neurotoksycznością indukowaną metamfetaminą (Pu i wsp. 1994, Marek i wsp. 1990, Schmidt i Gibb 1985, Poth i wsp. 2012), a myszy pozbawione DAT są odporne na neuronalną toksyczność metamfetaminy (Fumagalli i wsp. 1998). Wiedząc, że mefedron nie jest neurotoksyczny, a bloker DAT prowadzi do przewidywania, że powinien on zapobiegać toksyczności. Przetestowaliśmy nomifenzynę pod tym względem jako kontrolę pozytywną i potwierdziliśmy, że chroni ona przed wywołanym metamfetaminą wyczerpaniem DA, DAT i TH. Nomifensyna hamuje również transporter noradrenaliny (Brogden i wsp. 1979), ale ta właściwość nie może wyjaśniać obecnych wyników, ponieważ większość β-ketoamfetamin, w tym mefedron, hamuje transporter noradrenaliny i blokuje wychwyt noradrenaliny (Kelly 2011, Rothman i wsp. 2003, Cozzi i wsp. 1999, Sogawa i wsp. 2011, Lopez-Arnau i wsp. 2012). Rola układu neuronalnego 5-HT w niektórych działaniach farmakologicznych mefedronu jest możliwa w świetle zdolności tego leku, podobnie jak MDMA (Yamamoto i wsp. 1995), do powodowania wypływu prążkowia DA poprzez jego interakcje z receptorami 5-HT2A (Lopez-Arnau i wsp. 2012, Martinez-Clemente i wsp. 2012). Hiperlokomocja wywołana przez mefedron jest zależna od endogennego 5-HT (Lopez-Arnau i wsp. 2012), a lek ten stymuluje również uwalnianie 5-HT i hamuje jego wychwyt in vitro (Sogawa i wsp. 2011, Cozzi i wsp. 1999, Nagai i wsp. 2007, Hadlock i wsp. 2011, Lopez-Arnau i wsp. 2012, Martinez-Clemente i wsp. 2012) oraz in vivo (Baumann i wsp. 2012, Kehr i wsp. 2011). Możemy jednak wykluczyć rolę endogennego 5-HT w neurotoksyczności DA przynajmniej metamfetaminy, wykazując, że myszy genetycznie pozbawione 5-HT zachowują wrażliwość na neurotoksyczność (Thomas i wsp. 2010).
Mefedron może zwiększać neurotoksyczność metamfetaminy poprzez kilka możliwych mechanizmów. Po pierwsze, mefedron może oddziaływać z VMAT, powodując wyciek DA do cytoplazmy presynaptycznego zakończenia nerwowego. Zabiegi zwiększające cytoplazmatyczną pulę (tj. uwalnianą przez lek) DA zwiększają neurotoksyczność metamfetaminy (Thomas i wsp. 2008, Thomas i wsp. 2009, Schmidt i wsp. 1985). Mechanizm ten nie jest prawdopodobny, ponieważ metkatynon tylko słabo oddziałuje z VMAT (Cozzi i wsp. 1999). Po drugie, połączenie mefedronu i metamfetaminy może mieć synergistyczny wpływ na niepęcherzykowe uwalnianie DA, ale ta możliwość również wydaje się mało prawdopodobna w świetle wyników pokazujących, że leczenie komórek CHO z ekspresją DAT lub SERT metylonem i metamfetaminą nie ma addytywnego wpływu na uwalnianie DA lub 5-HT (Sogawa i wsp. 2011). Po trzecie, mefedron może oddziaływać z DAT w nowy sposób, który przyczynia się do toksyczności addytywnej. Wykazano, że metylon w połączeniu z metamfetaminą powoduje synergistyczną cytotoksyczność w komórkach CHO wyrażających DAT lub SERT, ale nie w komórkach CHO typu dzikiego pozbawionych transporterów (Sogawa i in. 2011). Cytotoksyczność obserwowana w hodowanych komórkach w tych badaniach (tj. uwalnianie LDH) bardzo różni się od uszkodzeń zakończeń nerwowych DA spowodowanych przez metamfetaminę, ale mechanizm ten sugeruje interesującą, ale nieokreśloną rolę DAT w zwiększonej cytotoksyczności. Wreszcie, mefedron może zmieniać metabolizm metamfetaminy. Mefedron jest metabolizowany głównie przez N-demetylację (Meyer i Maurer 2010), podobnie jak metamfetamina i MDMA (Caldwell 1976). Wsparcie dla tego mechanizmu wynika z wykazania, że metamfetamina i MDMA wzajemnie hamują produkcję swoich głównych metabolitów i podnoszą poziomy leku w osoczu powyżej tych obserwowanych po podaniu samego leku (Kuwayama et al. 2012). Dawki mefedronu stosowane obecnie i w naszym poprzednim badaniu (Angoa-Perez et al. 2012), choć wysokie, nie są neurotoksyczne i mieszczą się w zakresie nadużywanym przez ludzi (McErath i O'Neill 2011). Dlatego mefedron może działać jak MDMA, zwiększając poziom metamfetaminy w osoczu poprzez hamowanie jej metabolizmu. Aby potwierdzić tę ostatnią możliwość, konieczna będzie dogłębna analiza farmakokinetyczna.
Nadużywanie β-ketoamfetamin wzrasta w alarmującym tempie, a mefedron jest obecnie jednym z najczęściej używanych narkotyków po konopiach indyjskich, MDMA i kokainie (Morris 2010, Winstock i in. 2011b). Ponadto, mefedron wywołuje u ludzi silniejsze uczucie głodu w porównaniu z MDMA (Brunt i in. 2011), a użytkownicy, którzy wciągają mefedron, oceniają go jako bardziej uzależniający niż kokaina (Winstock i in. 2011b). Mefedron jest spożywany przez ludzi w sposób przypominający upijanie się (tj. "stacking") i jest często przyjmowany z innymi narkotykami, takimi jak konopie indyjskie i psychostymulanty amfetaminowe (Schifano i in. 2011, Fass i in. 2012, Winstock i in. 2011a, Kelly 2011, Torrance i Cooper 2010). Mefedron jest coraz częściej spotykany w tabletkach sprzedawanych jako MDMA (Brunt i in. 2011), a jego użycie prawdopodobnie przewyższy MDMA, ponieważ czystość tego ostatniego narkotyku nadal spada (Brunt i in. 2011, Tanner-Smith 2006, Teng i in. 2006). Opierając się na powszechnych wzorcach nadużywania mefedronu i innych składników "soli do kąpieli", ważne jest, aby rozważyć, czy dodatkowe zagrożenia dla zdrowia powstają u ludzi, gdy leki te są celowo lub nieświadomie łączone z amfetaminami. Nasze wyniki pokazujące, że przynajmniej mefedron znacząco zwiększa neurotoksyczność zakończeń nerwowych DA prążkowia wywołaną przez metamfetaminę, amfetaminę i MDMA, ujawniają szczególnie niebezpieczną i nieoczekiwaną właściwość tej β-ketoamfetaminy.
Użyte skróty
5-HT serotonina
DA dopamina
transporter DAT DA
MDMA 3,4-metylenodioksymetamfetamina
TH hydroksylaza tyrozynowa
VMAT pęcherzykowy transporter monoaminowy
Mefedron (4-metylometkatynon) jest pochodną katynonu i strukturalnym analogiem metamfetaminy i 3,4-metylenodioksy-metamfetaminy (MDMA). Mefedron jest jednym z psychoaktywnych składników "soli do kąpieli" wraz z innymi związkami, takimi jak metylon, butylon i 3,4-metylenodioksypyrowaleron (MDPV). β-ketoamfetaminy są nadużywane w coraz większym stopniu ze względu na wysoce ograniczoną dostępność prekursorów potrzebnych do syntezy metamfetaminy i MDMA w tajnych laboratoriach oraz odpowiednie zmniejszenie ich czystości (Winstock i in. 2011b, Brunt i in. 2011). Ponieważ nadużywanie β-ketoamfetamin wciąż rośnie, lista ich negatywnych skutków powiększyła się o powikłania sercowo-naczyniowe, pobudzenie, bezsenność, psychozę i depresję (Schifano i in. 2011, Prosser i Nelson 2012).
Jako chemiczne kongenery metamfetaminy i MDMA, nie jest zaskakujące, że β-ketoamfetaminy mają wiele takich samych skutków jak te pierwsze narkotyki na ośrodkowy układ nerwowy. Na przykład, narkotyki te blokują transportery dopaminy (DA) i serotoniny (5-HT) (odpowiednio DAT i SERT) (Cozzi i wsp. 1999, Rothman i wsp. 2003, Fleckenstein i wsp. 2000, Lopez-Arnau i wsp. 2012) i stymulują uwalnianie monoamin in vitro (Kalix i Glennon 1986, Gygi i wsp. 1997, Rothman i wsp. 2003) oraz in vivo (Gygi i wsp. 1997, Kehr i wsp. 2011). Metkatynon powoduje trwałe zmniejszenie aktywności hydroksylazy tryptofanu i hydroksylazy tyrozyny (TH) oraz wyczerpanie DA i 5-HT (Gygi i wsp. 1997, Gygi i wsp. 1996, Sparago i wsp. 1996). Badania obrazowania PET u abstynentów stosujących metkatynon wykazały zmniejszoną gęstość DAT w prążkowiu, co sugeruje utratę terminali DA (McCann i in. 1998). Jednoczesna stymulacja uwalniania DA i hamowanie jej wychwytu odzwierciedlają krytyczne elementy leżące u podstaw neurotoksyczności związanej z metamfetaminą (Kuhn i in. 2008, Yamamoto i Bankson 2005, Cadet i in. 2007, Fleckenstein i in. 2007).
My (Angoa-Perez et al. 2012) i inni (Baumann et al. 2012, Hadlock et al. 2011) niedawno zbadaliśmy możliwość, że mefedron może powodować neurotoksyczność jak metamfetamina i MDMA. Co zaskakujące, mefedron nie był toksyczny dla zakończeń nerwowych DA w prążkowiu (Hadlock i wsp. 2011, Baumann i wsp. 2012, Angoa-Perez i wsp. 2012). Kwestia tego, czy mefedron uszkadza zakończenia nerwowe 5-HT pozostaje nierozstrzygnięta, ponieważ jedno badanie udokumentowało pozytywne efekty (Hadlock et al. 2011), podczas gdy inne było negatywne (Baumann et al. 2012). W świetle stosunkowo łagodnego wpływu mefedronu na zakończenia nerwowe DA i biorąc pod uwagę jego właściwości jako blokera DAT, postawiliśmy hipotezę, że może on faktycznie chronić układ neuronów DA przed neurotoksycznym działaniem metamfetaminy, podobnie jak ma to miejsce w przypadku innych blokerów DAT, takich jak kwas amfonelowy (Pu i wsp. 1994, Schmidt i Gibb 1985, Marek i wsp. 1990) i nomifensyna (Poth i wsp. 2012). Obecnie donosimy, że mefedron znacząco zwiększa neurotoksyczność metamfetaminy. Efekt ten rozciąga się na amfetaminę i MDMA, narkotyki, które są często nadużywane razem z mefedronem (Feyissa i Kelly 2008, Schifano i wsp. 2011). Te zaskakujące wyniki stawiają nadużywanie mefedronu w nowym świetle i dodają pilnej potrzeby uznania tej subtelnej i niebezpiecznej właściwości tej β-ketoamfetaminy.
Materiały i metody
Narkotyki i odczynniki
Chlorowodorek mefedronu i 3,4-metylenodioksymetamfetamina (MDMA) zostały uzyskane z NIDA Research Resources Drug Supply Program. (+) Chlorowodorek metamfetaminy, maleinian nomifensyny, siarczan d-amfetaminy, pentobarbital, DA oraz wszystkie bufory i odczynniki HPLC zostały zakupione od Sigma-Aldrich (St. Louis, MO, USA). Zestawy do oznaczania białka kwasu bicinchoninowego otrzymano od firmy Pierce (Rockford, IL, USA). Przeciwciała poliklonalne przeciwko TH szczura zostały wyprodukowane zgodnie z wcześniejszym opisem (Kuhn i Billingsley 1987). Przeciwciała monoklonalne przeciwko DAT szczura zostały hojnie dostarczone przez dr Roxanne A. Vaughan (University of North Dakota, Grand Forks, ND, USA). Drugorzędowe przeciwciała anty-IgG sprzężone z HRP zostały dostarczone przez Jackson ImmunoResearch Laboratories, Inc (West Grove, PA, USA).
Zwierzęta
Samice myszy C57BL/6 (Harlan, Indianapolis, IN, USA) ważące 20-25 g w czasie eksperymentu były trzymane po 5 na klatkę w dużych klatkach typu shoe-box w jasnym (12 h światła/ciemności) i kontrolowanym temperaturowo pomieszczeniu. Użyto samic myszy, ponieważ wiadomo, że są one bardzo wrażliwe na uszkodzenia neuronów przez neurotoksyczne amfetaminy i aby zachować spójność z naszymi wcześniejszymi badaniami neurotoksyczności metamfetaminy (Thomas i wsp. 2010, Thomas i wsp. 2008, Thomas i wsp. 2009). Myszy miały swobodny dostęp do pożywienia i wody. Instytucjonalny Komitet ds. Opieki nad Zwierzętami i Stosowania Procedur Wayne State University zatwierdził opiekę nad zwierzętami i procedury eksperymentalne. Wszystkie procedury były również zgodne z NIH Guide for the Care and Use of Laboratory Animals.
Procedury farmakologiczne, fizjologiczne i behawioralne
Myszy leczono mefedronem przy użyciu schematu przypominającego binge, składającego się z 4 wstrzyknięć 10, 20 lub 40 mg/kg z 2-godzinną przerwą między każdym wstrzyknięciem. Ten schemat leczenia, gdy jest stosowany do wstrzykiwania podstawionych amfetamin i pochodnych katynonu, powoduje rozległe uszkodzenie zakończenia nerwu DA. Stosowane obecnie dawki mefedronu okazały się wcześniej nietoksyczne dla zakończeń nerwowych DA (Angoa-Perez et al. 2012). Myszy leczono metamfetaminą (4X 2,5 lub 5 mg/kg), amfetaminą (4X 5 mg/kg) lub MDMA (4X 20 mg/kg) samodzielnie lub w połączeniu z mefedronem. W przypadku leczenia dwoma lekami, myszy otrzymywały zastrzyk mefedronu 30 minut przed każdym z 4 zastrzyków metamfetaminy, amfetaminy lub MDMA. Osobom kontrolnym wstrzykiwano sól fizjologiczną według tego samego schematu, co w przypadku samego mefedronu lub w połączeniu z innymi amfetaminami. Jako kontrolę wpływu inhibitora DAT na toksyczność metamfetaminy, myszom podawano nomifenzynę (4X 5 mg/kg) 30 minut przed każdym wstrzyknięciem metamfetaminy (4X 5 mg/kg). Wszystkie zastrzyki podawano drogą dożylną. Myszy uśmiercano 2 dni po ostatnim podaniu leku, gdy neurotoksyczność związana z amfetaminą osiągnęła maksimum. Temperaturę ciała monitorowano telemetrycznie za pomocą wszczepialnych transponderów temperatury IPTT-300 firmy Bio Medic Data Systems, Inc. (Seaford, DE, USA). Temperatury były rejestrowane nieinwazyjnie co 20 minut, począwszy od 60 minut przed pierwszym wstrzyknięciem METH i kontynuowane przez 9 godzin później przy użyciu systemu konsoli DAS-5001 firmy Bio Medic.
Określenie zawartości DA w prążkowiu
Tkankę prążkowia wycięto obustronnie z mózgu po leczeniu i przechowywano w temperaturze -80°C. Zamrożone tkanki zważono i poddano sonikacji w 10 objętościach 0,16 N kwasu nadchlorowego w temperaturze 4°C. Nierozpuszczalne białko usunięto przez odwirowanie, a DA oznaczono metodą HPLC z detekcją elektrochemiczną, jak opisano wcześniej dla metamfetaminy (Thomas i in. 2010, Thomas i in., 2009).
Oznaczanie poziomów białek TH i DAT metodą immunoblottingu
Wpływ leczenia farmakologicznego na poziomy TH i DAT w prążkowiu określono metodą immunoblottingu jako wskaźnik toksyczności dla zakończeń nerwowych DA w prążkowiu. Myszy uśmiercono przez dekapitację po leczeniu, a prążkowie wycięto obustronnie. Tkankę przechowywano w temperaturze -80°C. Zamrożoną tkankę rozbijano przez sonikację w 1% SDS w temperaturze 95°C, a nierozpuszczalny materiał sedymentowano przez odwirowanie. Białko oznaczono metodą kwasu dwuchoninowego, a równe ilości białka (70 μg/pas) rozdzielono za pomocą elektroforezy w żelu SDS-poliakryloamidowym, a następnie elektroblotowano na nitrocelulozie. Bloty blokowano w soli fizjologicznej buforowanej Tris zawierającej Tween 20 (0,1% v/v) i 5% suchego mleka beztłuszczowego przez 1 godzinę w temperaturze pokojowej. Pierwotne przeciwciała przeciwko TH (1:1000) lub DAT (1:1000) dodano do blotów i pozostawiono do inkubacji przez 16 godzin w temperaturze 4°C. Bloty płukano 3-krotnie w soli fizjologicznej buforowanej Tris w celu usunięcia nieprzereagowanych przeciwciał, a następnie inkubowano z drugorzędowym przeciwciałem anty-IgG sprzężonym z HRP (1:4000) przez 1 godzinę w temperaturze pokojowej. Immunoreaktywne prążki wizualizowano za pomocą wzmocnionej chemiluminescencji, a względną gęstość prążków reagujących z TH i DAT określono przez obrazowanie za pomocą Kodak Image Station (Carestream Molecular Systems, Rochester, NY, USA) i oceniono ilościowo za pomocą oprogramowania ImageJ (NIH).
Analiza danych
Dwukierunkowe ANOVA przeprowadzono w celu analizy wpływu dawki metamfetaminy w porównaniu z mefedronem na DA, DAT i TH. Wpływ leczenia farmakologicznego na zawartość DA, TH i DAT w prążkowiu testowano pod kątem istotności za pomocą jednokierunkowej ANOVA, a następnie testu wielokrotnego porównania Tukeya. Wyniki leczenia lekami na temperaturę rdzenia ciała w czasie analizowano za pomocą dwukierunkowej ANOVA, a następnie testu Bonferroniego w celu określenia istotności różnic w temperaturze w poszczególnych okresach po leczeniu. Różnice uznano za istotne, jeśli p < 0,05. Wszystkie analizy statystyczne przeprowadzono przy użyciu GraphPad Prism w wersji 5.02 dla Windows (GraphPad Software, San Diego, CA, USA, www.graphpad.com).
Przejdź do:
Wyniki
Wpływ mefedronu na neurotoksyczność wywołaną metamfetaminą
Mefedron w dawkach (10, 20 lub 40 mg/kg), o których wiadomo, że nie powodują toksyczności zakończeń nerwowych DA (Angoa-Perez i wsp. 2012) podawano 30 min przed każdym wstrzyknięciem metamfetaminy. Metamfetaminę podawano w dawkach powodujących umiarkowane (4X 2,5 mg/kg) lub poważne (4X 5 mg/kg) uszkodzenie zakończeń nerwowych DA prążkowia (Thomas i wsp. 2004, Thomas i wsp. 2010). Wyniki przedstawione na rycinie 1 pokazują, że główny wpływ dawki metamfetaminy (F1,40 = 66,60, p < 0,0001) i dawki mefedronu (F4,40 = 131,3, p < 0,0001) na poziomy DA w prążkowiu był wysoce istotny w dwukierunkowej ANOVA. Główny efekt mefedronu podawanego w połączeniu z 2,5 mg/kg (F4,22 = 35,96, p < 0,001) lub 5,0 mg/kg metamfetaminy (F4,17 = 953,9, p < 0,0001) był również wysoce istotny w jednokierunkowej ANOVA. Wszystkie zabiegi z użyciem dowolnej dawki metamfetaminy ± mefedronu spowodowały znacznie większe zmniejszenie DA w porównaniu z odpowiednią kontrolą (p < 0,0001 dla wszystkich). Ryc. 1 pokazuje również, że dawki mefedronu 20 (p < 0,01) i 40 mg/kg (p < 0,001) znacząco wzmocniły uszczuplający wpływ metamfetaminy 2,5 mg/kg na DA, podczas gdy wszystkie dawki mefedronu znacząco wzmocniły wpływ metamfetaminy 5,0 mg/kg na poziomy DA (p < 0,0001 dla wszystkich).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/sywobkqrnd-jpg.47/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Rys.1
Wpływ mefedronu na indukowane metamfetaminą zmniejszenie DA w prążkowiu. Myszy leczono wskazanymi dawkami mefedronu (MEPH) 30 minut przed każdym wstrzyknięciem 2,5 (-) lub 5,0 mg/kg (■) metamfetaminy (METH) i uśmiercano 2d później w celu oznaczenia poziomów prążkowia DA za pomocą HPLC. Dane są średnie ± SEM dla 5-7 myszy na grupę. Niektóre słupki błędów były zbyt małe, aby przekroczyć rozmiar symboli i nie są widoczne. ***p < 0,001 vs kontrole i #p < 0,01, ##p < 0,001 lub ###p < 0,0001 vs odpowiednia dawka metamfetaminy (test porównań wielokrotnych Tukeya).
Ryc. 2a pokazuje, że mefedron znacząco zwiększył indukowane metamfetaminą obniżenie poziomu DAT, jak określono za pomocą immunoblottingu. Immunobloty poddano analizie ilościowej i zgodnie z wynikami dla DA, główny wpływ dawki metamfetaminy (F1,92 = 9,48, p < 0,001) i dawki mefedronu (F4,92 = 37,56, p < 0,0001) na poziomy DAT w prążkowiu był wysoce istotny w dwukierunkowej ANOVA (ryc. 2b). Główny efekt mefedronu podawanego w połączeniu z 2,5 mg/kg (F4,56 = 15,55, p < 0,0001) lub 5,0 mg/kg metamfetaminy (F4,39 = 24,84, p < 0,0001) był również wysoce istotny w jednokierunkowej ANOVA. Wszystkie zabiegi z użyciem dowolnej dawki metamfetaminy ± mefedronu spowodowały znacznie większe zmniejszenie DAT w porównaniu z odpowiednią kontrolą (p < 0,01 dla samej metamfetaminy 2,5 mg/kg; p < 0,0001 dla wszystkich innych zabiegów). Rys. 2b pokazuje również, że dawki mefedronu 20 mg/kg (p < 0,01) i 40 mg/kg (p < 0,001) znacząco zwiększyły redukcję DAT spowodowaną przez 2,5 mg/kg metamfetaminy, podczas gdy tylko dawka 40 mg/kg mefedronu znacząco zwiększyła (p < 0,01) wpływ 5,0 mg/kg metamfetaminy na redukcję DAT.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/bfu3sx5dnr-jpg.4797/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Rys. 2
Wpływ mefedronu na indukowane metamfetaminą zmniejszenie DAT w prążkowiu. Myszy leczono wskazanymi dawkami mefedronu (MEPH) 30 minut przed każdym wstrzyknięciem 2,5 (●) lub 5,0 mg/kg (■) metamfetaminy (METH) i uśmiercano 2d później w celu określenia poziomów DAT w prążkowiu metodą immunoblottingu (a). Plamy zostały ocenione ilościowo za pomocą ImageJ, a dane są średnie ± SEM dla 10-12 myszy na grupę (b). *p < 0,01 lub ***p < 0,0001 vs kontrola (C) i #p < 0,01 lub ##p < 0,001 vs odpowiednia dawka metamfetaminy (test porównań wielokrotnych Tukeya).
Ryc. 3a pokazuje, że mefedron znacząco zwiększył indukowane metamfetaminą obniżenie poziomu TH, jak określono za pomocą immunoblottingu. Immunobloty poddano analizie ilościowej i zgodnie z powyższymi wynikami dla DA i DAT, główne efekty dawki metamfetaminy (F1,81 = 47,89, p < 0,0001) i dawki mefedronu (F4,81 = 63,57, p < 0,0001) były wysoce istotne w dwukierunkowej ANOVA (ryc. 3b). Główny efekt mefedronu podawanego w połączeniu z 2,5 mg/kg (F4,34 = 12,98, p < 0,0001) lub 5,0 mg/kg metamfetaminy (F4,49 = 99,16, p < 0,0001) był również wysoce istotny w jednokierunkowej ANOVA. Wszystkie zabiegi z użyciem dowolnej dawki metamfetaminy ± mefedronu spowodowały znacznie większe zmniejszenie TH w porównaniu z odpowiednią kontrolą (p < 0,001 dla 2,5 mg/kg metamfetaminy + 10 mg/kg mefedronu; p < 0,0001 dla wszystkich innych kombinacji), z wyjątkiem samej metamfetaminy w dawce 2,5 mg/kg, która nie zmieniła znacząco poziomów TH (tj. brak toksyczności). Rys. 3b pokazuje również, że dawki mefedronu wynoszące 20 mg/kg (p < 0,01) i 40 mg/kg (p < 0,001) znacząco zwiększyły redukcję TH spowodowaną przez metamfetaminę w dawce 2,5 mg/kg, a wszystkie trzy dawki mefedronu znacząco (p < 0,0001) zwiększyły wpływ metamfetaminy w dawce 5,0 mg/kg na redukcję TH.
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/tggfrjpqru-jpg.4798/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Rys. 3
Wpływ mefedronu na indukowane metamfetaminą zmniejszenie TH w prążkowiu. Myszy leczono wskazanymi dawkami mefedronu (MEPH) 30 minut przed każdym wstrzyknięciem 2,5 (●) lub 5,0 mg/kg (■) metamfetaminy (METH) i uśmiercano 2d później w celu określenia poziomów TH w prążkowiu metodą immunoblottingu (a). Bloty zostały ocenione ilościowo za pomocą ImageJ, a dane są średnie ± SEM dla 10-12 myszy na grupę (b). Niektóre słupki błędów były zbyt małe, aby przekroczyć rozmiar symboli i nie są widoczne. **p < 0,001 lub ***p < 0,0001 vs kontrola (C) i #p < 0,01, ##p < 0,001 lub ###p < 0,0001) vs odpowiednia dawka metamfetaminy (test porównań wielokrotnych Tukeya).
Wpływ mefedronu na hipertermię wywołaną metamfetaminą
Mefedron, podobnie jak metamfetamina, powoduje znaczną hipertermię (Hadlock et al. 2011, Baumann et al. 2012, Angoa-Perez et al. 2012). Gdy mefedron podawano 30 minut przed każdym wstrzyknięciem metamfetaminy, na ryc. 4 widać, że główne efekty dawek metamfetaminy i mefedronu (F1,300 = 11,99, p < 0,0001) w czasie (F4,300 = 51,73, p < 0,0001) były wysoce znaczące w dwukierunkowej ANOVA. Główne efekty mefedronu podawanego w połączeniu z 2,5 mg/kg metamfetaminy (F4,120 = 41,44, p < 0,0001, panel a) w czasie (F30,120 = 3,84, p < 0,0001) lub 5,0 mg/kg metamfetaminy (F4,120 = 78,09, p < 0,0001, panel b) w czasie (F30,120 = 9,98, p < 0,0001) były również wysoce istotne w dwukierunkowej ANOVA. Wszystkie zabiegi z dowolną dawką metamfetaminy ± mefedronu różniły się znacząco od odpowiednich kontroli (p < 0,0001 dla wszystkich zabiegów).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/x0ik9hdwsw-jpg.4799/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Rys. 4
Wpływ mefedronu na hipertermię wywołaną metamfetaminą. Myszy leczono wskazanymi dawkami mefedronu (MEPH) 30 minut przed każdym wstrzyknięciem 2,5 (a) lub 5,0 mg/kg (b) metamfetaminy (METH). Temperaturę rdzenia mierzono w odstępach 20-minutowych za pomocą telemetrii, począwszy od 60 minut przed pierwszym wstrzyknięciem metamfetaminy. 4 zastrzyki metamfetaminy są oznaczone strzałkami spoczywającymi na osi x. Dane są wyrażone jako średnia temperatura ciała 6-8 myszy na grupę. SEM zawsze wynosiły < 10% średniej i zostały pominięte ze względu na przejrzystość.
Wpływ mefedronu na neurotoksyczność wywołaną amfetaminą i MDMA
Aby sprawdzić, czy wzmacniające działanie mefedronu na metamfetaminę można rozszerzyć na inne neurotoksyczne amfetaminy, myszy leczono tą β-ketoamfetaminą (20 mg/kg) plus amfetaminą (4X 5 mg/kg) lub MDMA (4X 20 mg/kg), a wyniki przedstawiono na ryc. 5. Przypomnijmy, że sam mefedron nie zmniejsza prążkowia DA, DAT ani TH (Angoa-Perez i wsp. 2012). Główny efekt leku (F5,27 = 27.18, p < 0.0001) był wysoce znaczący w jednokierunkowej ANOVA dla redukcji DA (ryc. 5a). Na ryc. 5a można również zauważyć, że wszystkie terapie amfetaminą (p < 0,001) lub MDMA (p < 0,001) samodzielnie lub w połączeniu z mefedronem (p < 0,0001 dla obu leków) znacząco obniżyły poziom DA w stosunku do kontroli. Mefedron znacząco zwiększył redukcję DA spowodowaną przez amfetaminę (p < 0,01) lub MDMA (p < 0,01). Ryc. 5b pokazuje podobny wpływ leczenia skojarzonego na poziomy DAT w prążkowiu. Główny efekt leku (F4,49 = 42,63, p < 0,0001) był wysoce znaczący w jednokierunkowej ANOVA dla DAT. Można również zauważyć na ryc. 5b, że wszystkie terapie amfetaminą lub MDMA były znacząco (p < 0,0001 dla wszystkich) niższe w porównaniu z kontrolą. Mefedron również znacząco zwiększył redukcję DAT spowodowaną przez amfetaminę lub MDMA (p < 0.0001 w obu przypadkach). Wreszcie, ryc. 5c pokazuje, że główny efekt leku (F4,50 = 75,06, p < 0,0001) był wysoce znaczący w jednokierunkowej ANOVA dla redukcji TH. Na ryc. 5c widać również, że wszystkie terapie amfetaminą lub MDMA były znacząco (p < 0,0001 dla wszystkich) niższe w porównaniu do kontroli. Mefedron również znacząco zwiększył redukcję TH spowodowaną przez amfetaminę lub MDMA (p < 0,0001 w obu przypadkach)
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/onvypkgxvn-jpg.4800/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Rys. 5
Wpływ mefedronu na neurotoksyczność zakończeń nerwowych DA wywołaną amfetaminą lub MDMA. Myszy leczono 20 mg/kg mefedronu (MEPH) 30 min przed każdym wstrzyknięciem 5,0 mg/kg amfetaminy (AMPH) lub 20 mg/kg MDMA i uśmiercano 2d po leczeniu w celu określenia poziomów prążkowia (a) DA za pomocą HPLC. (b) DAT i (c) TH określono za pomocą immunoblottingu, a bloty określono ilościowo za pomocą ImageJ. Reprezentatywne immunobloty dla DAT i TH są zawarte jako wstawki do paneli (b) i (c), a leczenie dla obu paneli jest oznaczone przez 1,5: kontrola; 2,6: MEPH; 3: AMPH; 4: AMPH + MEPH; 7: MDMA; i 8: MDMA + MEPH. Dane są średnimi ± SEM dla 5-12 myszy w każdej grupie. **p < 0,001 lub ***p < 0,0001 vs kontrola i #p < 0,01 lub ###p < 0,0001 vs AMPH lub MDMA (test porównań wielokrotnych Tukeya).
Wpływ nomifenzyny na neurotoksyczność wywołaną metamfetaminą
Nomifensyna, silny bloker DAT bez znanego potencjału nadużywania lub neurotoksyczności, została przetestowana pod kątem jej zdolności do ochrony przed neurotoksycznością indukowaną metamfetaminą oraz w przeciwieństwie do działania mefedronu na toksyczność zakończeń nerwowych DA wywołaną przez metamfetaminę, amfetaminę i MDMA. Wyniki na ryc. 6a pokazują, że główny wpływ leku (F3,16 = 63,39, p < 0,0001) na poziomy DA był wysoce istotny w jednokierunkowej ANOVA. Sama nomifensyna nie zmieniała poziomów DA, ale redukcja spowodowana metamfetaminą (p < 0,0001) była nieznacznie, ale znacząco odwrócona przez nomifensynę (p < 0,01). Główny wpływ leku (F3,20 = 16,78, p < 0,0001) na poziomy DAT był wysoce znaczący w jednokierunkowej ANOVA, jak pokazano na ryc. 6b. Nomifensyna nie zmieniła poziomów DAT, ale zapewniła znaczną ochronę (p < 0.001) przed zmniejszeniem DAT prążkowia spowodowanym przez metamfetaminę (p < 0.0001) w porównaniu z kontrolą. Wreszcie ryc. 6c pokazuje, że główny wpływ leku (F3,15 = 14.10, p < 0.0001) na poziomy TH był wysoce istotny w jednokierunkowej ANOVA. Jak zaobserwowano w przypadku DA i DAT, zmniejszeniu TH spowodowanemu przez metamfetaminę (p < 0.0001) nieznacznie, ale znacząco zapobiegła nomifensyna (p < 0.01).
http://bbzzzsvqcrqtki6umym6itiixfhni37ybtt7mkbjyxn2pgllzxf2qgyd.onion/index.php?attachments/daczg9cwfv-jpg.4801/&hash=f31155ada4e59f22a35f9110aaa6a7e5
Rys. 6
Wpływ nomifenzyny na neurotoksyczność zakończeń nerwowych DA wywołaną metamfetaminą. Myszy leczono 5,0 mg/kg nomifenzyny (NOM) 30 min przed każdym wstrzyknięciem 5,0 mg/kg metamfetaminy (METH) i uśmiercano 2d później w celu określenia poziomów prążkowia (a) DA za pomocą HPLC. (b) DAT i (c) TH określono za pomocą immunoblottingu, a bloty określono ilościowo za pomocą ImageJ. Reprezentatywne immunobloty dla DAT i TH są zawarte jako wstawki do paneli (b) i (c). Dane są średnią plus SEM dla 5-7 myszy na grupę. ***p < 0.0001 vs kontrola (C) i #p < 0.01 lub ##p < 0.001 vs sama metamfetamina (test wielokrotnego porównania Tukeya).
Dyskusja
Celem niniejszego badania było ustalenie, czy mefedron zapobiegnie toksyczności zakończeń nerwowych DA wywołanej przez metamfetaminę. Opierając się na jego podobieństwie chemicznym do metamfetaminy i MDMA, początkowo oczekiwano, że mefedron będzie wywierał szkodliwy wpływ na układ neuronów DA. Jednak kilka badań niemal jednocześnie wykazało, że mefedron nie jest toksyczny dla zakończeń nerwowych DA (Angoa-Perez et al. 2012, Baumann et al. 2012, Hadlock et al. 2011). Pytanie, czy lek ten powoduje uszkodzenie układu neuronalnego 5-HT pozostaje otwarte. Jedno z badań wykazało trwałe zmniejszenie funkcji zakończeń nerwowych 5-HT (Hadlock i wsp. 2011), podczas gdy inne wykazało, że mefedron nie powoduje uszkodzeń (Baumann i wsp. 2012). Mefedron oddziałuje z zakończeniem nerwowym DA w sposób, który sugeruje, że rzeczywiście stymuluje uwalnianie i blokuje wychwyt zwrotny DA poprzez interakcje z DAT. Kluczowym aspektem neurotoksycznego mechanizmu działania metamfetaminy jest jej zdolność do uzyskiwania dostępu do zakończeń nerwowych DA poprzez DAT i zakłócania homeostazy DA (Sulzer 2011). Jeśli ten wczesny etap w neurotoksycznej kaskadzie metamfetaminy zostanie powstrzymany przez zahamowanie DAT, toksyczność zostanie powstrzymana (Pu i wsp. 1994, Poth i wsp. 2012, Marek i wsp. 1990, Schmidt i Gibb 1985). Uznaliśmy, że mefedron może mieć tę samą właściwość ochronną, co inne inhibitory DAT, ale zamiast tego zaobserwowaliśmy znaczne zwiększenie toksyczności. Interakcję tę zaobserwowano przy użyciu dwóch różnych dawek metamfetaminy, które powodują umiarkowane lub poważne uszkodzenie zakończeń nerwowych DA (odpowiednio 4X 2,5 lub 5,0 mg/kg). To nasilające działanie mefedronu nie ograniczało się do metamfetaminy i rozciągało się na amfetaminę i MDMA, dwa narkotyki, które są często nadużywane razem z mefedronem i innymi β-ketoamfetaminami (Feyissa i Kelly 2008, Schifano i wsp. 2011, Kelly 2011). Dlatego też, pomimo faktu, że mefedron nie powoduje toksyczności przynajmniej zakończeń nerwowych DA prążkowia, nasila on neurotoksyczne działanie innych nadużywanych narkotyków. To nowe odkrycie powinno postawić nadużywanie mefedronu w jeszcze ostrzejszym świetle, ponieważ jego brak wewnętrznej neurotoksyczności może sprawiać, że wydaje się on nieszkodliwy.
Hipertermia jest powszechnie zgłaszanym ostrym działaniem niepożądanym po spożyciu metamfetaminy (Greene i in. 2008) i β-ketoamfetaminy u ludzi (Borek i Holstege 2012, Prosser i Nelson 2012). Podobnie jak metamfetamina, wiele β-ketoamfetamin również powoduje znaczne podwyższenie temperatury ciała u gryzoni (Angoa-Perez i wsp. 2012, Hadlock i wsp. 2011, Baumann i wsp. 2012, Rockhold i wsp. 1997). Podczas gdy hipertermia wywołana przez metamfetaminę może przyczyniać się do jej morfologicznych i neuronalnych szkodliwych skutków, niekoniecznie jest tak, że hipertermia jest bezpośrednią przyczyną tych skutków (Kiyatkin i Sharma 2009). Rejestrowaliśmy temperaturę ciała u myszy leczonych mefedronem i metamfetaminą i zaobserwowaliśmy, że połączone leczenie nie zwiększyło temperatury poza maksymalny wzrost obserwowany po podaniu samego leku. Metamfetamina powodowała zależny od dawki wzrost temperatury ciała, a hipertermia ta była niezmienna w całym badanym zakresie dawek mefedronu. W rzeczywistości, spadek temperatury ciała obserwowany po wstrzyknięciu mefedronu (Angoa-Perez et al. 2012) utrzymywał się przy wyższych dawkach mefedronu i metamfetaminy. Mimo że hipertermia wywołana lekami nie została wzmocniona przez skojarzone leczenie lekami, efekty neurotoksyczne były addytywne. Dlatego też, przynajmniej w tym przypadku, wydaje się, że neurotoksyczne działanie metamfetaminy może być wzmocnione przez mefedron w sposób niezależny od hipertermii.
Mefedron wyraźnie hamuje funkcję DAT i blokuje wychwyt zwrotny DA in vitro (Lopez-Arnau et al. 2012, Hadlock et al. 2011, Kehr et al. 2011, Martinez-Clemente et al. 2012, Cozzi et al. 1999). Mefedron wypiera WIN-35,428 z jego miejsca wiązania na DAT, co sugeruje, że jest on konkurencyjnym inhibitorem wychwytu DA (Martinez-Clemente i wsp. 2012, Lopez-Arnau i wsp. 2012). Siła działania mefedronu pod tym względem jest bardzo podobna do metamfetaminy (Cozzi i in. 1999) i MDMA (Escubedo i in. 2011). Nie wiadomo, czy mefedron jest transportowany przez DAT, ale metkatynon tak (Cozzi i Foley 2003). Nomifensyna i kwas amfonelowy, które wiążą się z DAT i hamują wychwyt DA, zapewniają znaczną ochronę przed neurotoksycznością indukowaną metamfetaminą (Pu i wsp. 1994, Marek i wsp. 1990, Schmidt i Gibb 1985, Poth i wsp. 2012), a myszy pozbawione DAT są odporne na neuronalną toksyczność metamfetaminy (Fumagalli i wsp. 1998). Wiedząc, że mefedron nie jest neurotoksyczny, a bloker DAT prowadzi do przewidywania, że powinien on zapobiegać toksyczności. Przetestowaliśmy nomifenzynę pod tym względem jako kontrolę pozytywną i potwierdziliśmy, że chroni ona przed wywołanym metamfetaminą wyczerpaniem DA, DAT i TH. Nomifensyna hamuje również transporter noradrenaliny (Brogden i wsp. 1979), ale ta właściwość nie może wyjaśniać obecnych wyników, ponieważ większość β-ketoamfetamin, w tym mefedron, hamuje transporter noradrenaliny i blokuje wychwyt noradrenaliny (Kelly 2011, Rothman i wsp. 2003, Cozzi i wsp. 1999, Sogawa i wsp. 2011, Lopez-Arnau i wsp. 2012). Rola układu neuronalnego 5-HT w niektórych działaniach farmakologicznych mefedronu jest możliwa w świetle zdolności tego leku, podobnie jak MDMA (Yamamoto i wsp. 1995), do powodowania wypływu prążkowia DA poprzez jego interakcje z receptorami 5-HT2A (Lopez-Arnau i wsp. 2012, Martinez-Clemente i wsp. 2012). Hiperlokomocja wywołana przez mefedron jest zależna od endogennego 5-HT (Lopez-Arnau i wsp. 2012), a lek ten stymuluje również uwalnianie 5-HT i hamuje jego wychwyt in vitro (Sogawa i wsp. 2011, Cozzi i wsp. 1999, Nagai i wsp. 2007, Hadlock i wsp. 2011, Lopez-Arnau i wsp. 2012, Martinez-Clemente i wsp. 2012) oraz in vivo (Baumann i wsp. 2012, Kehr i wsp. 2011). Możemy jednak wykluczyć rolę endogennego 5-HT w neurotoksyczności DA przynajmniej metamfetaminy, wykazując, że myszy genetycznie pozbawione 5-HT zachowują wrażliwość na neurotoksyczność (Thomas i wsp. 2010).
Mefedron może zwiększać neurotoksyczność metamfetaminy poprzez kilka możliwych mechanizmów. Po pierwsze, mefedron może oddziaływać z VMAT, powodując wyciek DA do cytoplazmy presynaptycznego zakończenia nerwowego. Zabiegi zwiększające cytoplazmatyczną pulę (tj. uwalnianą przez lek) DA zwiększają neurotoksyczność metamfetaminy (Thomas i wsp. 2008, Thomas i wsp. 2009, Schmidt i wsp. 1985). Mechanizm ten nie jest prawdopodobny, ponieważ metkatynon tylko słabo oddziałuje z VMAT (Cozzi i wsp. 1999). Po drugie, połączenie mefedronu i metamfetaminy może mieć synergistyczny wpływ na niepęcherzykowe uwalnianie DA, ale ta możliwość również wydaje się mało prawdopodobna w świetle wyników pokazujących, że leczenie komórek CHO z ekspresją DAT lub SERT metylonem i metamfetaminą nie ma addytywnego wpływu na uwalnianie DA lub 5-HT (Sogawa i wsp. 2011). Po trzecie, mefedron może oddziaływać z DAT w nowy sposób, który przyczynia się do toksyczności addytywnej. Wykazano, że metylon w połączeniu z metamfetaminą powoduje synergistyczną cytotoksyczność w komórkach CHO wyrażających DAT lub SERT, ale nie w komórkach CHO typu dzikiego pozbawionych transporterów (Sogawa i in. 2011). Cytotoksyczność obserwowana w hodowanych komórkach w tych badaniach (tj. uwalnianie LDH) bardzo różni się od uszkodzeń zakończeń nerwowych DA spowodowanych przez metamfetaminę, ale mechanizm ten sugeruje interesującą, ale nieokreśloną rolę DAT w zwiększonej cytotoksyczności. Wreszcie, mefedron może zmieniać metabolizm metamfetaminy. Mefedron jest metabolizowany głównie przez N-demetylację (Meyer i Maurer 2010), podobnie jak metamfetamina i MDMA (Caldwell 1976). Wsparcie dla tego mechanizmu wynika z wykazania, że metamfetamina i MDMA wzajemnie hamują produkcję swoich głównych metabolitów i podnoszą poziomy leku w osoczu powyżej tych obserwowanych po podaniu samego leku (Kuwayama et al. 2012). Dawki mefedronu stosowane obecnie i w naszym poprzednim badaniu (Angoa-Perez et al. 2012), choć wysokie, nie są neurotoksyczne i mieszczą się w zakresie nadużywanym przez ludzi (McErath i O'Neill 2011). Dlatego mefedron może działać jak MDMA, zwiększając poziom metamfetaminy w osoczu poprzez hamowanie jej metabolizmu. Aby potwierdzić tę ostatnią możliwość, konieczna będzie dogłębna analiza farmakokinetyczna.
Nadużywanie β-ketoamfetamin wzrasta w alarmującym tempie, a mefedron jest obecnie jednym z najczęściej używanych narkotyków po konopiach indyjskich, MDMA i kokainie (Morris 2010, Winstock i in. 2011b). Ponadto, mefedron wywołuje u ludzi silniejsze uczucie głodu w porównaniu z MDMA (Brunt i in. 2011), a użytkownicy, którzy wciągają mefedron, oceniają go jako bardziej uzależniający niż kokaina (Winstock i in. 2011b). Mefedron jest spożywany przez ludzi w sposób przypominający upijanie się (tj. "stacking") i jest często przyjmowany z innymi narkotykami, takimi jak konopie indyjskie i psychostymulanty amfetaminowe (Schifano i in. 2011, Fass i in. 2012, Winstock i in. 2011a, Kelly 2011, Torrance i Cooper 2010). Mefedron jest coraz częściej spotykany w tabletkach sprzedawanych jako MDMA (Brunt i in. 2011), a jego użycie prawdopodobnie przewyższy MDMA, ponieważ czystość tego ostatniego narkotyku nadal spada (Brunt i in. 2011, Tanner-Smith 2006, Teng i in. 2006). Opierając się na powszechnych wzorcach nadużywania mefedronu i innych składników "soli do kąpieli", ważne jest, aby rozważyć, czy dodatkowe zagrożenia dla zdrowia powstają u ludzi, gdy leki te są celowo lub nieświadomie łączone z amfetaminami. Nasze wyniki pokazujące, że przynajmniej mefedron znacząco zwiększa neurotoksyczność zakończeń nerwowych DA prążkowia wywołaną przez metamfetaminę, amfetaminę i MDMA, ujawniają szczególnie niebezpieczną i nieoczekiwaną właściwość tej β-ketoamfetaminy.
Użyte skróty
5-HT serotonina
DA dopamina
transporter DAT DA
MDMA 3,4-metylenodioksymetamfetamina
TH hydroksylaza tyrozynowa
VMAT pęcherzykowy transporter monoaminowy