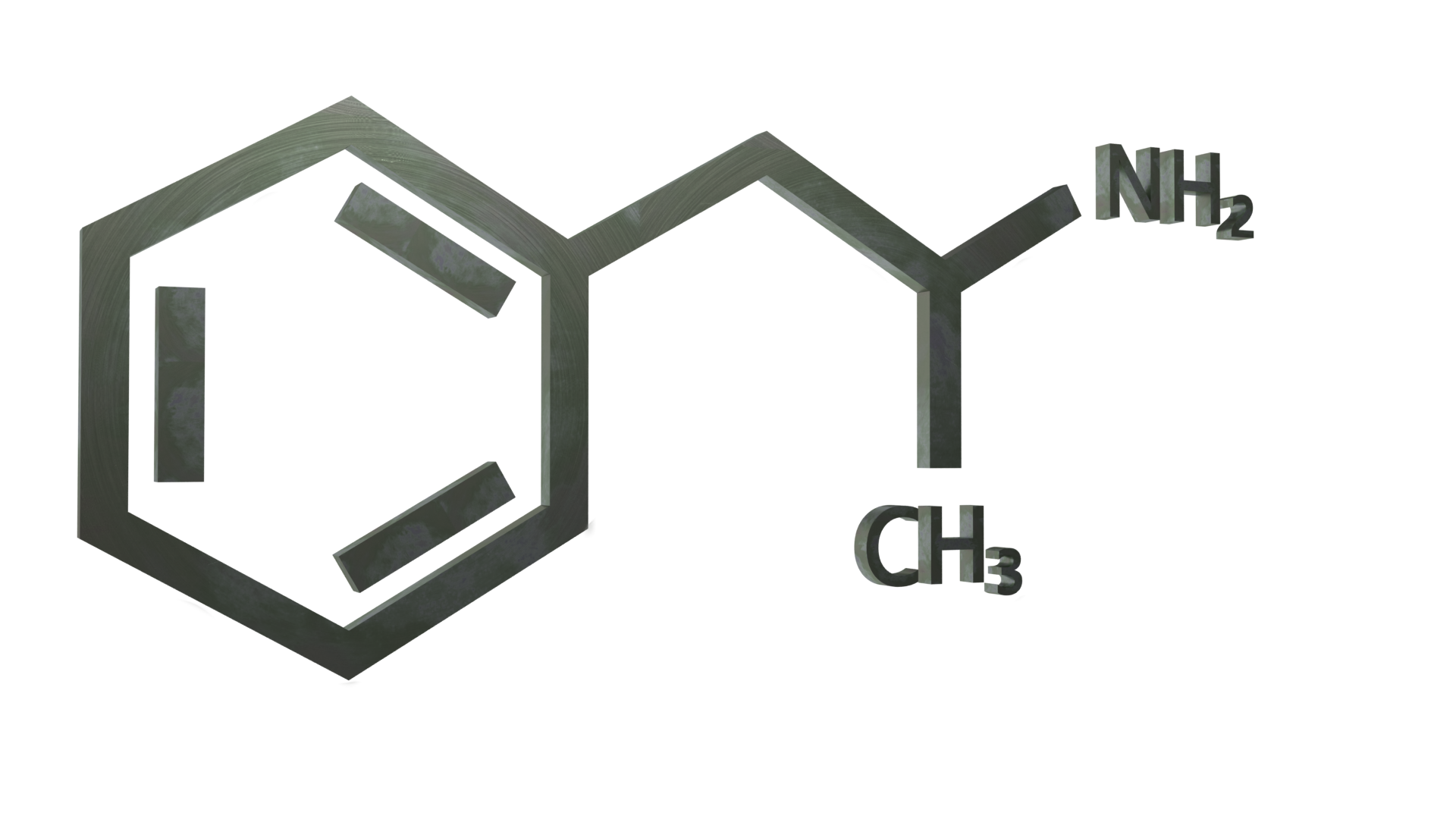
Anfetamina
DRAFT
Comentários, adições e correções sugeridas sobre os procedimentos sintéticos da anfetamina e assuntos relacionados
Este documento é um rascunho e apresenta uma visão geral dos procedimentos sintéticos gerais para a preparação de anfetamina e seus análogos, principalmente em larga escala.
O documento foi preparado como suplemento e correção do artigo atual sobre anfetamina, principalmente da seção sobre procedimentos sintéticos. Vários comentários, adições e correções sugeridas estão incluídos.
Várias representações dos enantiômeros da anfetamina
Fig. 1 Representação básica de dois enantiômeros, (+) S e (-) R
Exibir anexo FOknWcvPsy.jpg
Fig. 2. Imagem da anfetamina (+) S, somente geometria (png, fundo transparente, 600 dpi)
Fig. 3. Imagem de (+) S anfetamina, somente geometria (png, fundo transparente, ~500 dpi, renderização diferente)
Fig. 4. Imagem de (+) S anfetamina, geometria e volume aproximado, semitransparente
Introdução
Embora existam vários métodos para sintetizar anfetamina e seus análogos em uma escala laboratorial pequena (geralmente <1 g), apenas alguns procedimentos são adequados para quantidades de vários gramas e quilogramas. Para isso, muitos fatores devem ser considerados, inclusive a relação custo-benefício, a disponibilidade do equipamento e dos produtos químicos, os possíveis riscos (por exemplo, riscos de explosão, riscos de incêndio, subprodutos nocivos, medidas de proteção pessoal necessárias), o número e a complexidade das etapas da reação, o tamanho dos lotes, o tempo total necessário para produzir as quantidades necessárias e outros.
Os equipamentos aqui considerados incluem vários frascos de reatores, até o volume de 20 L, vasos de hidrogenação de aço de baixa pressão com capacidade semelhante, agitadores mecânicos e magnéticos de grande volume, sistemas de aquecimento apropriados, vidraria e utensílios de plástico padrão de laboratório etc. Não foram considerados equipamentos de produção em escala industrial (especialmente vasos de reatores metálicos).
Os precursores químicos necessários para as sínteses estão limitados à fenilacetona (BMK) ou seus análogos substituídos, bem como ao benzaldeído e seus derivados. Sínteses detalhadas e em várias etapas dos precursores necessários podem ser descritas em um documento separado.
O exame cuidadoso da literatura científica publicada (artigos, patentes, relatórios etc.), bem como a extensa experiência em primeira mão, reduzem essencialmente a metodologia disponível a quatro procedimentos gerais, conforme mostrado no Esquema 1. (Com exceção da alquilação redutiva direta do BMK, os procedimentos correspondem às reações mencionadas brevemente no artigo atual sobre anfetamina).
O documento consiste em cinco capítulos curtos. Quatro correspondem aos procedimentos de reação indicados como A, B, C e D no Esquema 1, enquanto o capítulo E representa um procedimento para separar dois enantiômeros de anfetamina: (+)S e (-)R.
Após cada capítulo, são fornecidas referências relevantes, principalmente para os exemplos específicos. Cada referência pode ser baixada, gratuitamente e de forma anônima, nos links de download direto fornecidos.
Esquema 1. Métodos práticos gerais, A-D, para a síntese de anfetamina e alguns de seus análogos
Referências para a introdução
(Referências gerais em química orgânica, síntese e farmacologia)
1. March's Advanced Organic Chemistry Reactions, Mechanisms, And Structure 6th Ed. Michael B. Smith, ; Jerry March. Wiley-Interscience, A John Wiley & Sons, Inc., Publicação, Copyright 2007. ISBN 13: 978-0-471-72091-1; ISBN 10: 0-471-72091-7
Faça o download em Library Genesis,
https://libgen.is/ (e outros domínios, se houver) e nos links espelhados (alguns podem não funcionar). Pesquise no site usando ISBN
978-0-471-72091-1
2. Vogel's Textbook Of Practical Organic Chemistry, 5th Ed. Longman Scientific & Technical. Longman Group UK Limited. ©Longman Group UK Limited I989. ISBN 0-582-46236-3.
Faça o download em:
https://archive.org/details/TextbookOfPracticalOrganicChemistry5thEd (versão: pdf com texto)
ou:
https://libgen.is/ (e outros domínios da Library Genesis, se houver) e os links espelhados (alguns podem não funcionar). Pesquise usando ISBN
0-582-46236-3
3. Comprehensive Organic Synthesis Reference Work (Trabalho de referência abrangente de síntese orgânica) - Segunda edição - 2014. Editor-chefe: Paul Knochel ISBN 978-0-08-097743-0 Copyright © 2014 Elsevier Ltd.
Faça o download em
https://libgen.is/ (e em outros domínios da Library Genesis, se houver) e nos links espelhados (alguns podem não funcionar). Pesquise no site usando ISBN
978-0-08-097743-0
4. Comprehensive Organic Synthesis Reference Work - 1991 Editores-chefes: Barry M. Trost e Ian Fleming. ISBN 978-0-08-052349-1 Copyright © 1991 Elsevier Science Ltd.
Faça o download em: https:
//libgen.is/ (e outros domínios, se houver) e os links espelho nele contidos (alguns podem não funcionar). Pesquise no site usando o texto "
Comprehensive Organic Synthesis Trost", versão em pdf, cada volume é um arquivo separado.
5. Goodman&Gilman's The Pharmacological Basis of Therapeutcs, 14th Ed. Editores: Laurence L. Brunton, PhD, Björn C. Knollmann, MD, PhD. Copyright © 2023 por McGraw Hill LLC. ISBN: 978-1-26-425808-6
Faça o download em:
https://libgen.is/ (e outros domínios, se houver) e os links espelhados nele contidos (alguns podem não funcionar). Pesquise no site usando ISBN
978-1-26-425808-6
Capítulo A.
Um procedimento geral de duas etapas para a preparação de
várias anfetaminas por meio da redução de aril-nitroalcenos
Os aril-nitroalcenos são facilmente preparados pela condensação de aldeídos aromáticos com nitroalcanos alifáticos (nitrometano, nitroetano etc.). A condensação é um processo de duas etapas, que envolve a reação de nitroaldol (reação de Henry)1, seguida pela desidratação espontânea. Posteriormente, a redução total de aril-nitroalcenos (tanto do grupo nitro quanto da ligação dupla) fornece a amina primária correspondente, como a anfetamina, conforme mostrado no Esquema 2.
Esquema 2. Procedimento geral para a síntese de anfetaminas, via aril-nitroalcenos
A primeira etapa, condensação/desidratação de aldol, é realizada na presença de um catalisador, principalmente bases suaves, como butil amina em tolueno, acetato de amônio em ácido acético ou um acetato de amônio sólido puro. (O uso da anilina, C6H5NH2, como catalisador, mostrado no esquema original, não foi identificado na literatura, mas pode ser possível, embora ela forme iminas estáveis com aldeídos aromáticos, conhecidos como bases de Shiff). O procedimento é exemplificado por três referências.2
A redução dos nitroalcenos obtidos, usando vários reagentes, é elaborada abaixo.
Vale ressaltar que uma redução parcial de nitroalcenos, usando ferro metálico e ácido clorídrico, produz as cetonas correspondentes (como a fenilacetona e seus análogos), em vez das anfetaminas, como no Esquema 3. 3,4
Esquema 3 Redução parcial de aril-nitroalcenos a aril-acetonas e cetonas relacionadas
A segunda etapa de redução produz uma amina saturada (por exemplo, anfetamina). A grande maioria dessas reduções foi realizada com hidreto de lítio e alumínio (LiAlH4, LAH), em éter ou tetrahidrofurano (THF), conforme mostrado nas referências selecionadas.5a-5d
Apenas alguns exemplos envolveram hidrogenação catalítica (por exemplo, H2, Pd/C, 1 atm, HCl, etanol).5e
Muito recentemente, um novo método foi publicado, usando NaBH4/CuCl2 como agente redutor. O método parece ser simples, barato e prático, mas o artigo não foi revisado por pares e, até o momento, os resultados não parecem ter sido verificados de forma independente.5f
Concluindo, a formação e a redução do aril-nitroalceno representam um método eficiente e confiável, em duas etapas, para preparar várias anfetaminas, inclusive a própria anfetamina. Ele requer o uso de LiAlH4 (LAH) como agente redutor e vários éteres como solvente (principalmente éter dietílico ou tetrahidrofurano, THF). As principais desvantagens do procedimento, especialmente em larga escala, são a necessidade de solventes estritamente anidros, a exclusão de umidade durante a redução e os riscos de explosão. A explosão pode ocorrer se o LAH entrar em contato com água, álcoois ou ácidos, seja durante o trabalho ou acidentalmente. Além disso, os éteres são altamente inflamáveis, e os vapores podem se inflamar facilmente de forma explosiva. (Faíscas eletrostáticas são comumente encontradas em laboratórios, instalações de produção e residências, e não têm relação com as faíscas produzidas por aparelhos elétricos). Além disso, se não forem devidamente estabilizados e em contato com o ar, os éteres formam facilmente peróxidos que são altamente explosivos e espontâneos, sem qualquer fonte de calor. As explosões podem ser devastadoras (e potencialmente letais), conforme testemunhado em primeira mão.
Em conclusão, o esquema original, mostrado abaixo, bem como o texto principal, podem ser modificados de acordo com o Esquema 2 e a discussão acima.
Referências para o capítulo A
1. Revisões da reação de Henry (reação do nitroaldol):
1a) Goffredo Rosini, 1.10 - The Henry (Nitroaldol) Reaction, em Comprehensive Organic Synthesis,
Pergamon, 1991, Páginas 321-340, Editor(es): Barry M. Trost, Ian Fleming, ISBN 9780080523491,
Faça o download no site
https://sci-hub.se/ usando o número DOI fornecido (
10.1016/B978-0-08-052349-1.00032-9)
(Link direto para a página do editor:
https://doi.org/10.1016/B978-0-08-052349-1.00032-9).
1b) Sasai, H. (2014). 2.13 A Reação de Henry (Nitroaldol). Comprehensive Organic Synthesis II, 543-570. doi:10.1016/b978-0-08-097742-3.00214-7. Faça o download no site
https://sci-hub.se/: usando o número DOI fornecido (
10.1016/b978-0-08-097742-3.00214-7)
2. Três exemplos de preparações de nitroalcenos (condensação de aldeído aromático e nitroalcano).
2a Organic Syntheses, Coll. Vol. 4, p.573 (1963); Vol. 35, p.74 (1955). DOI:10.15227/orgsyn.035.0074; (Conditions:
Catalisador: butil amina; solvente:
tolueno; rfl., ~5 h, rendimento: >~80-90%). Faça o download diretamente do endereço:
https://www.orgsyn.org/Content/pdfs/procedures/CV4P0573.pdf
2b J. Chem Sci 135, 20 (2023). DOI:10.1007/s12039-023-02144-7 (Conditions:
Catalisador: acetato de amônio; sem solvente; 2h ~100oC, rendimentos: >~80-90%). Faça o download diretamente do endereço:
https://doi.org/10.1007/s12039-023-02144-7 (artigo de acesso aberto).
2c Catherine B. Gairaud et al. The Synthesis of w-Nitrostyrenes. The Journal Of Organic Chemistry 1953 18 (1), 1-3. DOI: 10.1021/Jo01129a001 (Condições:
Catalisador: acetato de amônio; solvente: ácido acético; 2h. ~120oC, rendimento isolado: >~55%) .
Faça o download no site https://sci-hub.se/, usando o número DOI fornecido (10.1021/Jo01129a001).
3. Organic Syntheses, Coll. Vol. 4, p.573
(1963). o-Metoxifenilacetona. DOI:10.15227/orgsyn.035.0074.
Faça o download diretamente do endereço:
https://orgsyn.org/Content/pdfs/procedures/CV4P0573.pdf
4. R. V. Heinzelman. Physiologically Active Secondary Amines (Aminas secundárias fisiologicamente ativas). β-(o-Metoxifenil)-isopropil-N-metilamina e compostos relacionados. Journal of the American Chemical Society
1953 75 (4), 921-925. DOI: 10.1021/ja01100a043
Faça o download no site https://sci-hub.se/, usando o número DOI fornecido (10.1021/ja01100a043)
5. Exemplos de redução completa de nitroalcenos
Quatro exemplos de redução de nitroalcano à amina primária saturada, usando LiAlH4.
5a Beng-Thong Ho
et al. Análogos da a-metilfenetilamina (anfetamina). I. Síntese e atividade farmacológica de alguns análogos metoxi e/ou metil. Journal of Medicinal Chemistry 1970 13 (1), 26-30 DOI: 10.1021/jm00295a007
Faça o download no site https://sci-hub.se/, usando o número DOI fornecido (10.1021/jm00295a007).
5b Alejandra Gallardo-Godoy et al. Sulfur-Substituted α-Alkyl Phenethylamines as Selective and Reversible MAO-A Inhibitors:Biological Activities, CoMFA Analysis, and Active Site Modeling. Journal of Medicinal Chemistry 2005 48 (7), 2407-2419. DOI: 10.1021/jm0493109
Faça o download no site https://sci-hub.se/, usando o número DOI fornecido (10.1021/jm0493109).
5c Danielle M. Schultz, et al. 'Hybrid' benzofuran-benzopyran congeners as rigid analogs of hallucinogenic phenethylamines, Bioorganic & Medicinal Chemistry, Volume 16, Issue 11, 2008, 6242-6251. DOI 10.1016/j.bmc.2008.04.030
Faça o download no site https://sci-hub.se/, usando o número DOI (10.1016/j.bmc.2008.04.030
).
5d Michael
P. Johnson et al. Síntese e exame farmacológico de 1-(3-metoxi-4-metilfenil)-2-aminopropano e 5-metoxi-6-metil-2-aminoindan: semelhanças com a 3,4-(metilenodioxi)metanfetamina (MDMA). Journal of Medicinal Chemistry 1991. 34 (5), 1662-1668 DOI: 10.1021/jm00109a020
Um exemplo de hidrogenação catalítica do nitroalceno para a amina primária saturada.
5e Masahiko Kohno et al. Synthesis of Phenethylamines by Hydrogenation of β-Nitrostyrenes, Bulletin of the Chemical Society of Japan, Volume 63, Edição 4, abril de 1990, Páginas 1252-1254, https://doi.org/10.1246/bcsj.63.1252
Faça o download do site https://sci-hub.se/, usando o número DOI (10.1246/bcsj.63.1252).
Um exemplo de redução do nitroalceno à amina primária saturada, usando NaBH4/CuCl2.
5f d'Andrea L, et al. One-pot Reduction of Nitrostyrenes to Phenethylamines using Sodium Borohydride and Copper(II) chloride (Redução de nitro-estirenos a fenetilaminas em um único lote usando borohidreto de sódio e cloreto de cobre (II). ChemRxiv. 2023; doi:10.26434/chemrxiv-2023-nwn3x-v4 Este conteúdo é uma pré-impressão e não foi revisado por pares. (Acesso aberto)
Download do site https://chemrxiv.org/engage/chemrxiv/article-details/6509cee9b927619fe76fde7a
Capítulo B.
Um procedimento geral de duas etapas para a preparação de várias anfetaminas via redução de oximas
O procedimento é aplicável à própria anfetamina, bem como aos vários análogos, substituídos no anel benzênico. Os análogos requerem fenilacetona (BMK) adequadamente substituída
Introdução
O procedimento envolve duas etapas: 1. Preparação da oxima e 2. Redução da oxima.
Os compostos de carbonila, aldeídos e cetonas reagem prontamente com a hidroxilamina (na forma de sal de cloridrato) para formar oximas. Esses compostos geralmente são sólidos, estáveis, fáceis de isolar, purificar e manusear. Embora não sejam particularmente reativas, as oximas podem ser reduzidas a aminas primárias, usando agentes redutores como LiAlH4 (LAH), sódio metálico em álcoois (etanol anidro, propanol), hidrogenação catalítica e, menos comumente, outros reagentes.
As oximas a partir de adeídos (aldoximas) e cetonas (cetoximas) têm sido usadas há muito tempo como precursores imediatos de aminas primárias, obtendo assim esses compostos a partir de compostos de carbonila, em um procedimento de duas etapas.
A síntese geral está resumida no Esquema 4 e exemplificada na preparação de anfetamina a partir de BMK. Essa abordagem, que envolve a redução de sódio/propanol (incluindo também a separação do racemato de anfetamina), foi publicada recentemente.1

Esquema 4. Um procedimento geral para a síntese de anfetamina e análogos, por meio da redução do intermediário de oxima
1. A primeira etapa: formação da oxima. A condensação ocorre de forma rápida e quantitativa, na presença de uma base suave, que libera a hidroxilamina livre de seu sal de cloridrato. (A hidroxilamina livre é instável, ao contrário de seu sal. Ambos são muito tóxicos e devem ser manuseados com cuidado).
As condições gerais incluem (entre outras): Na2CO3, etanol, água;2a dil. NaOH, água, etanol;2b e acetato de sódio, metanol.2c
Essa etapa não deve ser particularmente perigosa em nenhuma escala.
2. A segunda etapa: redução da oxima à amina primária (por exemplo, anfetamina e seus análogos). As condições gerais incluem, entre outras: a) hidrogenação catalítica (hidrogênio e um catalisador),3a, 3b b) metal de sódio/álcool (etanol, propanol)1, 3c, 3d c) LiAlH4 em éteres.3e, 3f, 3g e outros d), e ), f).
a) Os procedimentos conhecidos para hidrogenação catalítica3a,3b exigem altas pressões (>100 atm) e equipamentos especiais (bombas de hidrogenação, tanque de hidrogênio, medidores e reguladores de pressão etc.). O catalisador usual é o níquel Raney, uma vez que os catalisadores de paládio são frequentemente propensos ao envenenamento do catalisador (inativação). Em geral, a hidrogenação não parece ser conveniente em escalas substanciais (por exemplo, >50-100 g). (Talvez existam procedimentos melhores e mais econômicos).
b) Os procedimentos que usam sódio metálico em álcoois1,3c,3d (etanol, propanol) exigem um grande excesso de sódio (10 eq), que é adicionado gradualmente à mistura de reação. (Um processo inconveniente e perigoso em grande escala). Além disso, são necessários álcoois anidros e o método apresenta um sério risco de explosão, pois o sódio reage violentamente com o álcool (e explosivamente com a água, em caso de acidente). Além disso, ocorre a formação de gás hidrogênio altamente inflamável e explosivo. Em geral, os protocolos específicos conhecidos são impraticáveis, caros e muito perigosos para escalas maiores, por exemplo, >20-50 g. (Modificações mais convenientes e menos perigosas podem ser desenvolvidas).
c) Os procedimentos que usam LiAlH4 em éteres (éter dietílico, THF) são geralmente mais convenientes, embora exijam grandes volumes de solvente (éter dietílico). Muitos exemplos foram relatados na literatura, e três referências são citadas.3e-3g Considerando os volumes necessários de solvente, a escalabilidade do método é provavelmente limitada a 50-100 g de anfetamina por lote, se não menos.
Outros métodos para reduzir oximas a aminas primárias foram relatados na literatura científica, mas são menos bem estudados, podem falhar completamente ou resultar em baixos rendimentos e produtos secundários. (Alguns podem ser melhorados por meio de mais experimentos e otimização). Esses são os seguintes:
d) Método geral para redução de oxima usando NaBH4 e NiCl2 hidratado em metanol.3h
O método foi aplicado à redução de várias oximas a aminas primárias, mas não à anfetamina ou seus análogos. Os rendimentos são geralmente >90%, mas a grande desvantagem é o uso de um grande excesso de NaBH4 (10 eq) e 2 eq de NiCl2 x 6 H2O, por 1 eq de uma oxima. Embora seja possível fazer modificações, em sua forma atual ele não tem potencial de produção.
e) Método geral para redução de oxima usando formiato de amônio e magnésio metálico em pó como catalisador.3i
O método foi aplicado à redução de várias oximas a aminas primárias, mas não à anfetamina ou seus análogos. Os rendimentos são geralmente >80%. Ele usa 3 eq de HCO2NH4 e 4 eq de pó de Mg por 1 eq da oxima, efetuando a conversão completa em menos de 1 h. O método, se reproduzívelpode ter um potencial de produção moderado. As possíveis desvantagens são as propriedades do pó de Mg comercial (disponível em vários fornecedores) e o procedimento de isolamento (a anfetamina, que é relativamente volátil, teria de ser destilada). Em geral, provavelmente vale a pena fazer experimentos.
f) Método geral para redução de oxima usando zinco metálico e ácido acético ou amálgama de alumínio.
Embora seja eficaz para algumas oximas ativadas3j, 3k , o zinco aparentemente produz apenas baixos rendimentos de aminas a partir de cetoximas comuns, provavelmente incluindo anfetaminas. A folha de alumínio, coberta com uma película muito fina de amálgama, reduziu com eficiência uma oxima ativada3l; no entanto, as reduções de cetoximas comuns (incluindo o precursor da anfetamina) parecem fornecer rendimentos mais baixos e pode haver produtos colaterais. Além disso, o procedimento usa cloreto de mercúrio (II) altamente tóxico (HgCl2). Portanto, ele apresenta um risco real de contaminação e intoxicação com mercúrio elementar e seus compostos, e deve ser evitado para qualquer produto destinado ao consumo.
Em conclusão, a reação original, esquema abaixo, está errada. Os procedimentos corretos são discutidos no Capítulo B, acima, e mostrados no Esquema 4. Portanto, o esquema original deve ser corrigido de acordo e possivelmente modificado e ampliado
Esquema original:
Referências para o Capítulo B
1. Síntese completa recente de anfetamina (e metanfetamina):
Kristýna Dobšíková et al. Conformational analysis of amphetamine and methamphetamine: a comprehensive approach by vibrational and chiroptical spectroscopy. Analyst, 2023,148, 1337-1348. DOI
https://doi.org/10.1039/D2AN02014A.(Artigo de acesso aberto). O procedimento sintético detalhado para a síntese de anfetamina é apresentado em um arquivo separado, (informações suplementares, no endereço:
https://www.rsc.org/suppdata/d2/an/d2an02014a/d2an02014a1.pdf (Breve descrição: O experimento envolve a preparação da oxima, seguida da redução para anfetamina racêmica, usando Na/propanol. Rendimento: ~8,5 g, ~85% em duas etapas). Também estão incluídos os procedimentos para a separação da anfetamina racêmica (método do ácido tartárico) e a síntese da metanfetamina, em duas etapas, a partir da anfetamina).
2. Métodos gerais para a preparação de oxima (a partir de cetonas e cloridrato de hidroxilamina)
2a Org. Synth. 2010, 87, 36. DOI: 10.15227/orgsyn.087.0036 (Condições: Na2CO3, etanol, água)
h
ttps://www.orgsyn.org/Content/pdfs/procedures/v87p0036.pdf
Org. Synth. 2011, 88, 33-41. DOI: 10.15227/orgsyn.088.0033 (Condições: NaOH diluído, água, etanol)
h
ttps://www.orgsyn.org/Content/pdfs/procedures/v88p0033.pdf
Org. Synth. 2023, 100, 248-270. DOI: 10.15227/orgsyn.100.0248 (Condições: acetato de sódio, metanol)
h
ttps://www.orgsyn.org/Content/pdfs/procedures/v100p0248.pdf
Reduções catalíticas (hidrogênio e um catalisador)
3a Fred W. Hoover
et al. Synthesis of 2-Amino-1-Phenyl-1-Propanol and its Methylated Derivatives (Síntese de 2-amino-1-fenil-1-propanol e seus derivados metilados). The Journal of Organic Chemistry 1947 12 (4), 506-509. DOI: 10.1021/jo01168a003
Faça o download no site https://sci-hub.se/ usando o número DOI 10.1021/jo01168a003
3b R. V. Heinzelman. Physiologically Active Secondary Amines (Aminas secundárias fisiologicamente ativas). β-(o-Metoxifenil)-isopropil-N-metilamina e compostos relacionados. Journal of the American Chemical Society 1953 75 (4), 921-925. DOI: 10.1021/ja01100a043
Faça download do site https://sci-hub.se/ usando o número DOI 10.1021/ja01100a043
Reduction using sodium metal/alcohols
3c Vogel's Textbook of Practical Organic Chemistry Fifth Edition, Longman Scientific & Technical, 1989. ISBN 0-582-46236-3, p. 776.
(download em https://archive.org/details/TextbookOfPracticalOrganicChemistry5thEd ) .
3d Xing Fan,
et al. Efficient synthesis and identification of novel propane-1,3-diamino bridged CCR5 antagonists with variation on the basic center carrier. European Journal of Medicinal Chemistry, Volume 45, Edição 7, 2010, 2827. DOI: 10.1016/j.ejmech.2010.03.003
Download do site https://sci-hub.se/ usando o número DOI 10.1016/j.ejmech.2010.03.003
Reductions using LiAlH4 (LAH)
3e Organic Syntheses, Coll. Vol. 10, p.305 (2004); DOI:10.15227/orgsyn.079.0130
h
ttps://www.orgsyn.org/Content/pdfs/procedures/V79P0130.pdf
Kulkarni, Mahesh R.;
et al. Discovery of tetrahydrocarbazoles as dual pERK and pRb inhibitors (Descoberta de tetrahidrocarbazóis como inibidores duplos de pERK e pRb). European Journal of Medicinal Chemistry (2017), 134, 366-378 DOI:10.1016/j.ejmech.2017.02.062
Faça o download no site
https://sci-hub.se/, usando o número de DOI 10.1016/j.ejmech.2017.02.062.
3g Ricci, Antonio
et al. Estudo de ressonância paramagnética eletrônica (EPR) de derivados de camptotecina marcados com spin: A Different Look of the Ternary Complex (Uma visão diferente do complexo ternário). Journal of Medicinal Chemistry (2011), 54(4), 1003-1009. DOI: 10.1021/jm101232t. Faça o download no site
https://sci-hub.se/, usando o número DOI (10.1021/jm101232t ).
Outros reagentes para redução de oxima
3h Ipaktschi, J. Reduction von Oximen mit Natriumboranat in Gegenwart von Übergangsmetallverbindungen. Chem. Ber., 1984 117: 856-858.
https://doi.org/10.1002/cber.19841170237
Faça o download no site
https://sci-hub.se/, usando o número DOI 10.1002/cber.19841170237.
3i K. Abiraj et al. Magnesium-Catalyzed Proficient Reduction of Oximes to Amines Using Ammonium Formate. Synthetic Communications: An International Journal for Rapid Communication of Synthetic Organic Chemistry, 2004, 34:4, 599-605. DOI: 10.1081/SCC-120027707 Faça o download no site
https://sci-hub.se/, usando o número DOI 10.1081/SCC-120027707.
3j https://www.orgsyn.org/Content/pdfs/procedures/CV5P0373.pdf
3k https://www.orgsyn.org/Content/pdfs/procedures/CV3P0513.pdf
3l https://www.orgsyn.org/Content/pdfs/procedures/CV5P0032.pdf
Capítulo C.
Um procedimento geral de uma etapa para a preparação de várias
anfetaminas via hidrogenação catalítica.
A maioria das cetonas, inclusive a fenilacetona (BMK), pode ser convertida diretamente nas aminas primárias correspondentes, usando a reação conhecida como alquilação redutiva (ou seja, aminação redutiva). A reação envolve a adição inicial de amônia a um grupo carbonila e a formação reversível de uma imina instável, que não é isolada. A imina é então reduzida a amina, usando hidrogênio na presença de um catalisador (níquel Raney, PtO2 etc.). A formação de uma amina secundária é amplamente suprimida pela presença de amônia, em grande excesso. Os primeiros procedimentos envolviam pressões muito altas (~350 atm, ~150oC), o que é inconveniente e altamente perigoso, exigindo também equipamentos especiais.1 Modificações posteriores permitiram pressões e temperaturas muito mais baixas, tornando a reação prática.2,3 Embora os rendimentos tendam a ser moderados, em parte devido à formação de aminas secundárias como produtos secundários, a reação pode ser econômica em larga escala. A amina primária obtida é purificada por destilação sob pressão reduzida.
O procedimento geral é ilustrado em uma alquilação redutora catalítica de fenilacetona (BMK) com amônia, Esquema 5:
Esquema 5. Procedimento geral para a síntese de anfetaminas, via alquilação redutora catalítica de amônia
O equipamento de hidrogenação dedicado e de baixa pressão é obrigatório. (Muitos estão prontamente disponíveis, pois são usados na indústria alimentícia). Além disso, o aparelho pode ser construído de acordo com as instruções da Organic Syntheses (com modificações significativas, usando peças e materiais modernos).4 O sistema de agitação, mostrado na Fig. 5, deve ser substituído por um potente agitador magnético e o recipiente de hidrogenação deve ser feito de aço inoxidável não magnético (somente para soluções não corrosivas). (Normalmente, ele é feito de vidro). Observe que todas as operações com hidrogênio gasoso, especialmente sob pressão, são inerentemente altamente perigosas de várias maneiras (por exemplo, vazamentos e ignição explosiva). Além disso,o manuseio inadequado do catalisador, em contato com o ar, resultará em ignição espontânea. Além disso, é obrigatório usar tanques de hidrogênio comerciais de alta pressão como fonte de hidrogênio e os reguladores de pressão redutores dedicados para o hidrogênio.

Fig. 5 Aparelho de hidrogenação caseiro
Em conclusão, esse método geral é viável para a produção de anfetamina e seus análogos, desde que o equipamento de hidrogenação especializado esteja disponível. Alguns experimentos e modificações adicionais do procedimento são necessários, incluindo variações do catalisador.
Referências para o Capítulo C
1. Organic Syntheses, Coll. Vol. 3, p.717 (1955). DOI:10.15227/orgsyn.023.0068
Download do site
https://www.orgsyn.org/Content/pdfs/procedures/CV3P0717.pdf
2. Elliot R. Alexander
et al. A Low Pressure Reductive Alkylation Method for the Conversion of Ketones to Primary Amines (Método de alquilação redutiva de baixa pressão para a conversão de cetonas em aminas primárias). Journal of the American Chemical Society 1948 70 (4), 1315-1316. DOI: 10.1021/ja01184a007
Faça o download no site
https://sci-hub.se/, usando o número DOI fornecido (10.1021/ja01184a007)
3. R. V. Heinzelman. Physiologically Active Secondary Amines (Aminas secundárias fisiologicamente ativas). β-(o-Metoxifenil)-isopropil-N-metilamina e compostos relacionados. Journal of the American Chemical Society 1953 75 (4), 921-925. DOI: 10.1021/ja01100a043
Faça o download no site
https://sci-hub.se/, usando o número DOI fornecido (10.1021/ja01100a043)
4. Org. Synth. CV1P0061. Aparelho para redução catalítica. DOI: 10.15227/orgsyn.008.0010.
Download do site
https://www.orgsyn.org/Content/pdfs/procedures/CV1P0061.pdf
Capítulo D.
Preparação de várias anfetaminas por meio da reação de Leuckart em duas etapas
A reação de Leuckart, também conhecida como reação de Leuckart-Wallach, envolve um procedimento de duas etapas, redução e hidrólise, conforme detalhado abaixo. A reação foi revisada.1a,1b
Na primeira etapa, os compostos de carbonila (aldeídos ou cetonas) são convertidos redutivamente nas formamidas correspondentes, usando reagentes como formiato de amônio aquoso2 , formiato de amônio seco, misturas contendo ácido fórmico livre e/ou formamida, formamida pura etc. O uso de formamida/água, em vez de formiato de amônio, foi otimizado para outras aminas além da anfetamina.3
Na segunda etapa, a formamida obtida (que é estável, mas geralmente não é isolada) é hidrolisada com ácido até o sal de amina, enquanto a amina livre é isolada pela basificação da mistura. A hidrólise básica da formamida é muito mais lenta e não oferece vantagens, mas pode ser usada se a reação for realizada em reatores de aço que não sejam resistentes a ácidos.
Existem muitas variantes, incluindo algumas modificações mais recentes (por exemplo, catalisadores especiais,4 radiação de micro-ondas (MW) 5 etc.). No entanto, esses procedimentos mais recentes, embora úteis e eficientes, não podem ser aplicados na prática em grandes escalas, por exemplo, >50-100 g. Isso se deve ao custo do catalisador e à sensibilidade do ar, ou à falta de equipamentos necessários, como fontes potentes de micro-ondas. (A exposição direta a fontes potentes e desprotegidas de MW é altamente perigosa. Embora não seja uma radiação ionizante, ela causa rápido aquecimento interno, danos aos órgãos e morte).
A reação clássica de Leuckart aplicada à preparação de anfetamina é mostrada no Esquema 6.

Esquema 6. Preparação de anfetamina usando a reação de Leuckart.
Embora a reação seja demorada, trabalhosa (envolvendo várias etapas operacionais) e exija altas temperaturas, ela é econômica e adequada para produções em larga escala. Além disso, não é necessário nenhum equipamento especial. Assim, ele tem sido amplamente usado em laboratório, principalmente para vários análogos de anfetamina (e muitas outras aminas primárias não relacionadas), industrialmente e também por vários grupos que operam fora das estruturas legais.
Em conclusão, esse método geral é praticado com bastante frequência na produção de anfetamina e seus análogos, principalmente substituídos no anel aromático. Correções/adições:
Há um erro na segunda parte do esquema de reação original, abaixo, porque o peróxido de hidrogênio (H2O2) nunca é usado no procedimento de Leuckart, até onde se sabe. Em vez disso, o reagente em questão é o ácido clorídrico, ou seja, HCl/H2O. Além disso, o esquema pode ser modificado ainda mais, com base no Esquema 6 e na discussão no Capítulo D, acima.
Esquema original:
Referências para o Capítulo D
1.
Comentários
1a. M. L. Moore, Org. React. 5, 301-330 (1949);
https://onlinelibrary.wiley.com/doi/10.1002/0471264180.or005.07;
https://doi.org/10.1002/0471264180.or005.07 Download do site
1b. Umar, Q.
et al. Uma breve revisão: Advancement in the Synthesis of Amine through the Leuckart Reaction (Avanço na síntese de aminas por meio da reação de Leuckart). Reactions 2023, 4, 117-147.
https://doi.org/10.3390/reactions4010007 (Acesso aberto)
Formiato de amônio gerado in situ
2a. A. W. Ingersoll. α-Feniletilamina. Org. Synth. 1937, 17, 76. DOI: 10.15227/orgsyn.017.0076
h
ttps://www.orgsyn.org/Content/pdfs/procedures/CV2P0503.pdf
. R. V. Heinzelman. Physiologically Active Secondary Amines (Aminas secundárias fisiologicamente ativas). β-(o-Metoxifenil)-isopropil-N-metilamina e compostos relacionados. Journal of the American Chemical Society 1953 75 (4), 921-925. DOI: 10.1021/ja01100a043
Faça o download no site
https://sci-hub.se/, usando o número DOI fornecido (10.1021/ja01100a043)
3. Carlson, Rolf at al. An Optimized Procedure for the Reductive Amination of Acetophenone by the Leuckart Reaction, Acta Chemica Scandinavica, 1993: 47: 1046-1049. Número do DOI: 10.3891/acta.chem.scand.47-1046.
http://actachemscand.org/doi/10.3891/acta.chem.scand.47-1046 (Acesso aberto)
Uso de um catalisador especial
4. Kitamura et al. Catalytic Leuckart-Wallach-Type Reductive Amination of Ketones. The Journal of Organic Chemistry 2002 67 (24), 8685. DOI: 10.1021/jo0203701.
Faça o download no site
https://sci-hub.se/, usando o número DOI fornecido (10.1021/jo0203701)
Uso de radiação de micro-ondas
5. Loupy et al. Towards the rehabilitation of the Leuckart reductive amination reaction using microwave technology (Rumo à reabilitação da reação de aminação redutiva de Leuckart usando tecnologia de micro-ondas). Tetrahedron Letters, Volume 37, 1996, 8177. DOI: 10.1016/0040-4039(96)01865-5
Faça o download do site
https://sci-hub.se/, usando o número DOI fornecido (10.1016/0040-4039(96)01865-5)
Capítulo E.
Separação dos enantiômeros (+)S e (-)R da anfetamina
Em escala preparativa, a anfetamina é sempre obtida como mistura racêmica, que é opticamente inativa (composta de quantidades iguais de enantiômero
S e
R ). No caso da anfetamina, a forma dextro, ou seja, o enantiômero (+
)S, é um estimulante muito mais forte do sistema nervoso central (SNC) do que o enantiômero (-
)R e tem menos efeitos colaterais.
Como a anfetamina tem sido usada como medicamento de prescrição há décadas (por exemplo, o medicamento Adderall1), houve a necessidade de usar o enantiômero mais ativo, ou seja, a anfetamina (+)S. Por isso, foram desenvolvidos métodos eficientes para a separação de enantiômeros. (No entanto, para a atividade farmacológica ideal, o Adderall contém ambos os enantiômeros, na proporção (+)S/ (-)R = 75:25).
Atualmente, a principal separação prática e em larga escala dos enantiômeros da anfetamina consiste em uma cristalização fracionada dos sais, obtidos de ácidos opticamente ativos que ocorrem naturalmente. (Diversas outras aminas opticamente ativas, não relacionadas à anfetamina, também são obtidas de forma análoga). Normalmente, esses ácidos são o ácido L-(+) tartárico e seus derivados, e o ácido L-(-) málico. Em geral, no entanto, apenas um enantiômero puro da amina pode ser isolado, enquanto o oposto é obtido usando o enantiômero oposto do ácido, por exemplo, o ácido D-(-) tartárico. Como esses ácidos não ocorrem naturalmente, eles próprios precisam ser enantioseparados e, portanto, são muito mais caros. (Nos últimos anos, várias enantioseparações enzimáticas se tornaram industrialmente viáveis, mas elas exigem uma escolha cuidadosa das cepas de enzimas, das condições de reação etc., e geralmente não são adequadas para separações simples. Entretanto, muitos exemplos simples e preparativos são conhecidos, por exemplo, o descrito em Vogel2).
No caso da própria anfetamina, a anfetamina (+)S desejada (ou seja, a dextroanfetamina) requer ácido L-(+) tartárico e a separação é relativamente simples, conforme descrito abaixo. Deve-se observar que, em geral, os rendimentos não são altos, estando na faixa de ~50-60%, resultando em rendimentos totais de apenas ~25% (se o enantiômero oposto for descartado). Embora a separação deva ser realizada com metanfetamina, já que a levometanfetamina é praticamente inativa, no caso da anfetamina, a enantiosseparação nem sempre é obrigatória, dependendo do composto específico e do uso pretendido (como observado acima, o Adderall é uma mistura S/R na proporção 75/25).
A separação da dextranfetamina foi alcançada décadas atrás (Temmler, GB 508757, 1939; Nabenhauer, US 2276508, 1942 para SK&F).3 Um método de separação semelhante, pela cristalização fracionada de sais diastereoisoméricos, foi publicado em um artigo científico muito recente4 e é apresentado no Esquema 7, abaixo.
Também é digno de nota que o monitoramento da separação de enzimas não é um procedimento simples, embora tenha sido praticado usando polarímetros manuais desde o século XIX. (Usando polarímetros, a enantiopureza de um composto conhecido pode ser calculada a partir de uma equação simples, não mostrada aqui. Entretanto, outros compostos opticamente ativos não devem estar presentes). Outros métodos, especialmente equipamentos de HPLC com colunas quirais, têm sido amplamente utilizados nos últimos anos e permitem a presença de outros compostos opticamente ativos. Entretanto, o equipamento é bastante caro.
Exibir anexo G09DPhZORt.png
Esquema 7. Procedimento de separação da anfetamina racêmica para os enantiômeros (+)S e (-)R puros.
Referências para o Capítulo E
1.
https://www.drugs.com/tips/adderall-patient-tips
2. Vogel's Textbook Of Practical Organic Chemistry, 5th Ed. Longman Scientific & Technical. Longman Group UK Limited. ©Longman Group UK Limited I989. ISBN 0-582-46236-3.
Página: 812.
3. Em geral, os textos integrais das patentes podem ser baixados gratuitamente e de forma anônima nos sites de vários escritórios nacionais de patentes. O escritório de patentes alemão é particularmente rico, fornecendo milhões de patentes de países do mundo todo. Se o número da patente e o código do país forem conhecidos (por exemplo, US2276508), a pesquisa no banco de dados de patentes é muito simples, assim como o download do texto completo, como arquivo PDF. (Também estão disponíveis opções de pesquisa mais avançadas). O endereço relevante para a pesquisa é:
O DEPATISnet está disponível para consulta no Deutschen Patent- und Markenamt (DPMA) e permite que você obtenha pesquisas on-line sobre publicações de patentes de todo o mundo, que estejam no banco de dados do sistema de informações de patentes alemão DEPATIS.
depatisnet.dpma.de
4Kristýna Dobšíková et al. Conformational analysis of amphetamine and methamphetamine: a comprehensive approach by vibrational and chiroptical spectroscopy. Analyst, 2023,148, 1337-1348.
DOI:
https://doi.org/10.1039/D2AN02014A.(Artigo de acesso aberto).
O procedimento sintético detalhado para a síntese de anfetamina e resolução de enantiômeros é apresentado em um arquivo separado, informações suplementares, no endereço:
https://www.rsc.org/suppdata/d2/an/d2an02014a/d2an02014a1.pdf (A referência também é citada no capítulo B).
Notes on the Pharmacological Activity of Amphetamine and its Synthetic Derivatives, as well as Some Endogenous Physiologicaly Active Amines, Including Various Neurotransmitters (Notas sobre a atividade farmacológica da anfetamina e seus derivados sintéticos, bem como algumas aminas fisiologicamente ativas endógenas, incluindo vários neurotransmissores)
Uma apresentação abrangente da farmacologia da anfetamina pode ser encontrada na ref. 1. Ela também abrange a comparação farmacológica da anfetamina, das catecolaminas endógenas, de vários análogos, bem como da 2-feniletil amina (que são todos muito diferentes).
Referências para notas
1a. Goodman&Gilman's The Pharmacological Basis of Therapeutcs, 14th Ed. Editores: Laurence L. Brunton, PhD, Björn C. Knollmann, MD, PhD. Copyright © 2023 por McGraw Hill LLC. ISBN: 978-1-26-425808-6
Faça o download em:
https://libgen.is/ (e em outros domínios, se houver) e nos links espelhados nele contidos (alguns podem não funcionar). Pesquise no site usando ISBN
978-1-26-425808-6
1b. Martindale The Complete Drug Reference. Trigésima oitava edição. ISBN 978 0 85711 139 5, ISSN 0263-5364. Publicado pela Pharmaceutical Press, 1 Lambeth High Street, London SE1 7JN, Reino Unido ©Pharmaceutical Press 2014
Faça o download em:
https://libgen.is/(https://libgen.rs/ e outros domínios, se houver) e os links espelhados nele contidos (alguns podem não funcionar). Pesquise no site usando ISBN
978-0-85711-139-5 ou "Martindale: The Complete Drug Reference"