- Joined
- Jun 24, 2021
- Messages
- 1,651
- Solutions
- 2
- Reaction score
- 1,769
- Points
- 113
- Deals
- 666
Informações gerais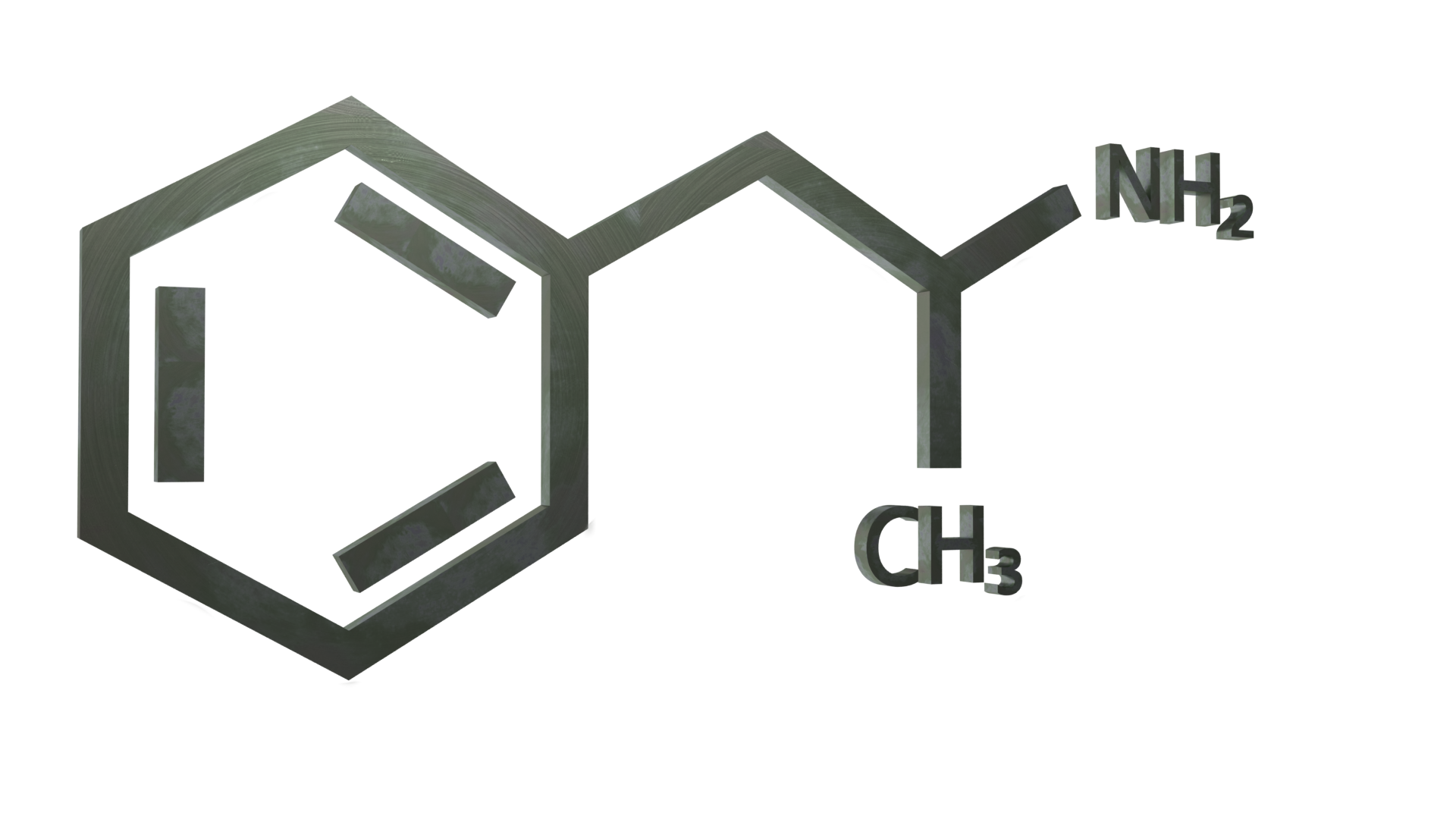
A anfetamina (também conhecida como alfa-metilfenetilamina, amfetamina e speed) é uma substância estimulante clássica da classe das fenetilaminas. É o composto principal das anfetaminas substituídas, um grupo diverso que inclui a metanfetamina, a MDMA, a catinona e a bupropiona. O seu mecanismo de ação consiste em promover a libertação dos neurotransmissores dopamina e norepinefrina.
A anfetamina, uma substância descoberta há mais de 100 anos, é uma das drogas controladas mais restritas. Anteriormente, era utilizada para uma grande variedade de doenças, tendo mudado até à atualidade, em que o seu uso é altamente restrito. A anfetamina, com a fórmula química alfa-metil-fenetilamina, foi descoberta em 1910 e sintetizada pela primeira vez em 1927. Após ter sido provado que reduzia a anestesia induzida por drogas e produzia excitação e insónia, a mistura racémica de anfetamina foi registada por Smith, Kline e French em 1935. A estrutura da anfetamina apresenta um centro quiral e existe sob a forma de isómeros dextro e levo. O primeiro produto da Smith, Kline and French foi aprovado pela FDA em 1976.
Na década de 1930, era vendido sem receita médica com o nome de "Benzedrina" como descongestionante. Tornou-se amplamente utilizada para tratar uma série de doenças como a ressaca do álcool, a narcolepsia, a depressão e a obesidade. Durante a Segunda Guerra Mundial, a anfetamina foi utilizada para promover o estado de vigília dos soldados. Esta utilização levou a uma grande sobreprodução de anfetaminas e todo o excedente após o fim da guerra acabou no mercado negro, dando início ao abuso. Devido a problemas de dependência e abuso, acabou por ser listada como substância controlada ao abrigo da "Convenção sobre Substâncias Psicotrópicas" das Nações Unidas de 1971.
Atualmente, a anfetamina é sobretudo um medicamento sujeito a receita médica utilizado para tratar a perturbação de défice de atenção e hiperatividade (PHDA), a narcolepsia e a obesidade. Além disso, é utilizada ilicitamente de forma generalizada como agente de melhoria do desempenho e substância recreativa.
Propriedades físicas
- Fórmula C9H13N
- Massa molar 135,210 g/mol
- Densidade 0,936 g/cm3 a 25 °C
- Ponto de fusão 11,3 °C (52,3 °F)
- Ponto de ebulição 200-203 °C (397 °F) a 760 mmHg
Propriedades químicas
A base livre da anfetamina é um líquido oleoso volátil incolor com um odor caraterístico a "peixe" e um sabor acre a queimado, pouco solúvel em água, facilmente solúvel em solventes orgânicos, ponto de ebulição 200-203 °C.
A anfetamina é um metil homólogo do neurotransmissor dos mamíferos fenetilamina, com a fórmula química C9H13N. O átomo de carbono adjacente à amina primária é um centro estereogénico e a anfetamina é composta por uma mistura racémica 1:1 de dois enantiómeros. Esta mistura racémica pode ser separada nos seus isómeros ópticos: levoanfetamina e dextroanfetamina (isómeros l- e d-). Os sais sólidos de anfetamina frequentemente preparados incluem o cloridrato, o fosfato e o sulfato de anfetamina. O sulfato de dextroanfetamina é o sal enantiopuro mais comum. A anfetamina é também o composto principal da sua própria classe estrutural, que inclui uma série de derivados psicoactivos.
Formas de síntese
Existe uma lista das formas mais populares de síntese da anfetamina. Todas elas têm vantagens e desvantagens próprias. A síntese não selectiva mais popular é a redução P2NP, que pode ser efectuada com amálgama de alumínio(Al). Também é possível reduzir por NaBH4, LAH ou hidrogénio gasoso com catalisador (PtO2 ou Pd/C) e excesso de pressão. O P2NP pode ser sintetizado por simples condensação de nitroetano com benzaldeído.
Um dos métodos mais comuns de produção clandestina de anfetaminas é a reação de Leuckart, que consiste na condensação da fenilacetona (fenil-2-propanona, P2P) com formamida ou formiato de amónio na presença de ácido fórmico e subsequente hidrólise ácida da N-formilanfetamina resultante.
A mfetamina pode também ser preparada por aminação redutora da fenilacetona (P2P) na presença de um catalisador metálico. A reação prossegue com a formação de uma imina intermédia. Exemplos de reação são: Redução catalítica heterogénea da fenilacetona com amoníaco. O catalisador pode ser paládio sobre carbono, óxido de platina ou níquel Raney. Restauração com amálgamas de alumínio, zinco ou magnésio.
Se necessário, os estereoisómeros anfetamínicos dextroanfetamina e levoanfetamina podem ser separados com ácido tartárico. Além disso, foi publicado um método para a síntese estereosselectiva da dextroanfetamina, que consiste na aminação redutora da fenilacetona com S-α-metilbenzilamina. A imina obtida é reduzida com Pd/C ou níquel Raney e recristalizada como cloridrato. O grupo N-benzilo é então hidrogenolizado na presença de paládio sobre carvão para formar dextroanfetamina de elevada pureza ótica.
Análise e purificação
Em todos os processos de síntese da anfetamina são utilizadas substâncias tóxicas e perigosas. Existem dois métodos de purificação da anfetamina: "Lavagem do produto" e o método mais avançado "Extração ácido-base".
A lavagem do medicamento é uma parte essencial e final de quase todas as sínteses. Por vezes, é repetida várias vezes. O método está disponível para qualquer pessoa, não requer competências, pode melhorar significativamente a qualidade do produto e a apresentação. O método é ideal para pequenas quantidades. A lavagem é indicada para resíduos de P2NP, álcalis, ácidos, etc. A lavagem não remove contaminantes (acetaminofeno, cafeína, etc.) e sais de mercúrio.
O método mais acessível, e por conseguinte mais fácil, é a lavagem da anfetamina com álcool isopropílico (IPA). Mais difícil de utilizar é a acetona anidra. O IPA não contém água, pelo que não dissolve o sal de anfetamina. A chave para o sucesso do processo é a ausência de água. É necessária para evitar a dissolução da ânfa com poluentes, uma vez que estes serão deitados fora.
A extração ácido-base (ABE), como método de purificação, permite obter um medicamento de alta qualidade. O método é bom devido à utilização de reagentes, ferramentas e instrumentos disponíveis.
A anfetamina é cortada com uma frequência inaceitável por cafeína, amido, nootrópicos como a cinarizina e o piracetam, a-PVP, metanfetamina e outros estimulantes e substâncias farmacêuticas. Existem vários métodos para verificar a presença de anfetaminas. O método mais popular e mais fácil é o dos reagentes de despistagem de drogas. Pode ler sobre outros métodos no Protocolo de avaliação das anfetaminas.
Há imagens de diferentes amostras de anfetaminas após testes com reagentes
Efeitos e dosagem
Os efeitos subjectivos incluem estimulação, aumento da concentração, aumento da motivação, aumento da libido, supressão do apetite e euforia. É geralmente tomada por via oral, mas também pode ser insuflada, injectada ou administrada por via rectal. As doses mais baixas tendem a aumentar a concentração e a produtividade, enquanto as doses mais elevadas tendem a aumentar a sociabilidade, o desejo sexual e a euforia.
A anfetamina tem um elevado potencial de abuso. O uso crónico (isto é, doses elevadas, administração repetida) está associado a redosagem compulsiva, tolerância crescente e dependência psicológica. Além disso, o abuso tem sido associado a uma série de problemas de saúde, nomeadamente cardiovasculares, como a hipertensão arterial e o aumento do risco de acidente vascular cerebral. Aconselha-se vivamente a utilização de práticas de redução de danos ao consumir esta substância.
[Efeitos físicos]
Estimulação - A anfetamina é considerada muito energética e estimulante. Pode encorajar actividades físicas como a dança, a socialização, a corrida ou a limpeza. O estilo particular de estimulação que a anfetamina produz pode ser descrito como forçado. Isto significa que, com doses mais elevadas, torna-se difícil ou impossível manter-se imóvel. O cerrar dos maxilares, os tremores corporais involuntários e as vibrações tornam-se presentes, resultando em tremores extremos de todo o corpo, instabilidade das mãos e uma perda geral do controlo motor fino. Durante o período de duração da experiência, esta é substituída por uma ligeira fadiga e exaustão geral.
-
Sensações corporais espontâneas - O "efeito corporal" da anfetamina pode ser descrito como uma sensação de formigueiro eufórico moderado que envolve todo o corpo. Esta sensação mantém uma presença constante, que aumenta com o início e atinge o seu limite quando o pico é atingido.
-
Euforia física
-
Batimento cardíaco anormal
-
Aumento do ritmo cardíaco
-
Aumento da pressão arterial - em cerca de 30 mmHg sistólica e 20 mmHg diastólica, em utilizadores ingénuos que tomam 40 mg de d-AMP.
-
Supressão do apetite
-
Broncodilatação
-
Desidratação
-
Boca seca
-
Micção frequente
-
Dificuldade em urinar
-
Aumento da temperatura corporal
-
Aumento da transpiração
-
Mania - A anfetamina pode produzir mania em indivíduos geneticamente predispostos, como os que se encontram no espetro da perturbação bipolar ou da esquizofrenia. Doses mais elevadas e privação de sono parecem aumentar o risco.
-
Náuseas - Este efeito pode ser atenuado comendo antes da dose e durante a experiência.
-
Dilatação da pupila - Este efeito é sentido apenas em doses comuns a elevadas e é mais proeminente na fase de descida.
-
Síncope reflexa
-
Aumento da resistência
-
Ranger de dentes - O ranger de dentes pode estar presente em doses mais elevadas. Contudo, é menos intenso do que o da MDMA.
-
Disfunção erétil temporária
-
Vasoconstrição - O consumo de anfetaminas provoca a contração dos vasos sanguíneos, o que faz com que não chegue sangue suficiente a algumas partes do corpo. Isto pode causar sensações de formigueiro ou dor, sensação de frio, dormência, palidez ou alterações da cor da pele, especialmente nos dedos das mãos e dos pés.
[/SPOILER]
[SPOILER=Efeito visual]
-
Os efeitos visuais da anfetamina são inconsistentes e só são ligeiramente perceptíveis em doses mais elevadas. São de certa forma comparáveis a visões delirantes e ocorrem mais facilmente em zonas mais escuras.
[/SPOILER]
[SPOILER=Distorções]
-
Deriva - Este efeito é normalmente subtil e pouco percetível e só ocorre em doses mais elevadas ou quando combinado com canábis. Geralmente consiste em desvios de nível 1-2.
- Alteração da luminosidade - A anfetamina pode fazer com que os espaços pareçam mais luminosos devido aos seus efeitos de dilatação das pupilas.
- Traçadores - Este efeito é impercetível com doses baixas. É mais pronunciado com doses mais elevadas e especialmente quando alguém fica privado de sono, o que, por outro lado, pode ser facilmente provocado por outros efeitos desta substância. Transformações - Este efeito ocorre muito raramente, e tipicamente apenas quando o utilizador tomou doses elevadas, está a descer, ou esteve acordado durante períodos invulgarmente longos. Quando ocorrem, são normalmente muito ligeiros.
[/SPOILER]
[SPOILER=Estados alucinatórios]
-
Transformações - Este efeito ocorre muito raramente, e tipicamente apenas quando o utilizador tomou doses elevadas, está a descer, ou esteve acordado durante períodos invulgarmente longos. Quando ocorrem, são normalmente muito ligeiros.
-
Geometria - Este efeito é relatado por alguns utilizadores de anfetaminas e substâncias relacionadas, normalmente em doses mais elevadas quando se está a tentar dormir. Pode ser descrito, nas suas variações, como simplista, algorítmico, sintético, pouco iluminado, multicolorido, brilhante, com arestas vivas, com zoom, suave, angular, imersivo e progressivo. Ocorre normalmente no nível 3, mas pode progredir para 4 e 5 quando combinado com substâncias como a canábis ou o DXM.
[/SPOILER]
[SPOILER=Efeitos cognitivos]
- Melhoria da análise
- Euforia cognitiva
- Redose compulsiva
- Inflação do ego
- Supressão de emoções - Este efeito é tipicamente mais intenso em doses ligeiras e comuns, e é mais frequentemente relatado em utilizações médicas do que recreativas.
- Aumento da concentração - Este efeito é mais eficaz com doses baixas a moderadas, pois qualquer dose superior prejudica a concentração.
- Aumento da libido - Embora o consumo de anfetaminas possa causar sensações de melhoria sexual, a constrição dos vasos sanguíneos pode dificultar a obtenção ou a manutenção de uma ereção.
- Aumento da apreciação da música
- Irritabilidade - É mais provável que ocorra com doses mais elevadas.
- Melhoria da memória
- Aumento da motivação
- Psicose - Este efeito só ocorre em indivíduos predispostos, ou após uma utilização crónica e frequente, ou devido a privação do sono.
- Supressão da sugestibilidade
- Aceleração do pensamento
- Organização do pensamento
- Distorção do tempo - Pode ser descrita como a experiência do tempo a acelerar e a passar muito mais depressa do que normalmente passaria quando sóbrio.
- Despertar
[/SPOILER]
[SPOILER=Efeitos posteriores]
Os efeitos que ocorrem durante a fase de compensação de uma experiência estimulante são geralmente negativos e desconfortáveis em comparação com os efeitos que ocorreram durante o pico. Este efeito é frequentemente designado por "descida" e ocorre devido à depleção de neurotransmissores. Os seus efeitos incluem normalmente:
- Ansiedade - A ansiedade pode atingir níveis graves durante a descida em alguns utilizadores.
- Supressão do apetite
- Cansaço cognitivo
- Depressão
- Aumento do ritmo cardíaco - Enquanto a concentração sanguínea de anfetamina e a maioria dos efeitos subjectivos são mais elevados cerca de 3 horas após a administração, o ritmo cardíaco atinge o seu máximo muito mais tarde, 10 horas após a administração.
- Irritabilidade
- Supressão da motivação
- Pernas inquietas
- Paralisia do sono - Alguns utilizadores notam paralisia do sono após o consumo de anfetaminas.
- Supressão de sonhos
- Desaceleração do pensamento
- Despertar - A insónia que se segue a uma série repetida de doses de anfetaminas pode durar mais de um dia em alguns utilizadores.
- Supressão da motivação - As experiências podem variar desde uma ligeira desmotivação até estados extremos de desinteresse. Este efeito é mais proeminente em doses comuns e pesadas.
[/SPOILER]
Farmacologia
A anfetamina exerce os seus efeitos comportamentais aumentando a atividade de sinalização dos neurotransmissores norepinefrina e dopamina nas vias de recompensa e de função executiva do cérebro. Os efeitos reforçadores e motivadores da anfetamina devem-se sobretudo ao aumento da atividade dopaminérgica na via mesolímbica.
Os efeitos eufóricos e locomotores da anfetamina dependem da magnitude e da velocidade com que aumenta as concentrações sinápticas de dopamina e norepinefrina no estriado.
É um potente agonista completo do recetor 1 associado à amina vestigial (TAAR1) e interage com o transportador vesicular de monoamina 2 (VMAT2). A ação combinada sobre o TAAR1 e o VMAT2 resulta num aumento das concentrações de dopamina e norepinefrina nas sinapses, o que estimula a atividade neuronal.
A dextroanfetamina é um agonista mais potente do TAAR1 do que a levoanfetamina. Por conseguinte, a dextroanfetamina produz uma maior estimulação do SNC do que a levoanfetamina, cerca de três a quatro vezes mais, mas a levoanfetamina tem efeitos cardiovasculares e periféricos ligeiramente mais fortes.
A biodisponibilidade exacta da anfetamina não é conhecida, mas pensa-se que é superior a 75% por via oral e superior por injeção ou administração intranasal. A sua absorção e excreção podem depender do pH. Como se trata de uma base fraca, quanto mais básico for o ambiente, mais a droga se encontra numa forma lipossolúvel e a absorção através das membranas celulares ricas em lípidos é altamente favorecida. O pico de resposta da anfetamina ocorre 1-3 horas após a administração oral e aproximadamente 15 minutos após a injeção. A absorção completa da anfetamina ocorre geralmente após 4-6 horas. A forma básica é mais facilmente absorvida no intestino e menos facilmente eliminada pelos rins, aumentando potencialmente a sua semi-vida. É eliminada pelos rins por excreção e uma pequena quantidade é eliminada pelas enzimas hepáticas.
Dados sobre o mercado ilegal
Fornecimento mundial de estimulantes do tipo anfetaminas (ATS)
Em 2020, foi apreendida uma quantidade recorde de mais de 525 toneladas de ATS, o que representa um aumento de 15 por cento em relação ao ano 1 e manteve a tendência ascendente observada no período 2010-2020.Asquantidades de metanfetaminas apreendidas quintuplicaram durante esse período de 10 anos, as quantidades de anfetaminas apreendidas quase quadruplicaram easquantidades de "ecstasy" apreendidas mais do que triplicaram.
O consumo de anfetaminas continuou a aumentar, mas há sinais de diminuição da procura de tratamento em 2020. Principalmente com base em respostas auto-declaradas a inquéritos à população em geral, estima-se que um total de 34 milhões de pessoas com idades compreendidas entre os 15 e os 64 anos, ou seja, 0,7% da população mundial, tenham consumido anfetaminas no último ano e que 20 milhões (0,4%) tenham consumido substâncias do tipo "ecstasy". Alguns destes utilizadores consumiram ambos os tipos de substâncias. As duas anfetaminas mais frequentemente utilizadas são a anfetamina e a metanfetamina.
A estimativa global do consumo de anfetaminas foi semelhante em 2010, com 33 milhões de utilizadores no último ano, ou seja, 0,7% da população com idades compreendidas entre os 15 e os 64 anos. No entanto, estas estimativas devem ser interpretadas com prudência, devido à falta de dados relativos aos principais países consumidores da Ásia, onde outros indicadores de mercado, como as apreensões e os preços, sugerem uma expansão na última década. As informações qualitativas baseadas nas percepções das tendências comunicadas por peritos nacionais ao UNODC revelam um aumento contínuo tanto em termos de consumo de anfetaminas como do número de pessoas em tratamento para o consumo de anfetaminas ao longo da última década. No entanto, os dados relativos a 2020 mostram que esta tendência crescente foi interrompida e que o número de pessoas em tratamento para as anfetaminas pode ter diminuído, o que é coerente com uma diminuição global do tratamento em resultado da pandemia de COVID-19. e As tendências derivadas destas informações qualitativas são coerentes com os indicadores de oferta disponíveis, como os preços e as apreensões, que indicam uma expansão global contínua do mercado das anfetaminas. Este tipo de informação qualitativa sofre de limitações metodológicas, mas tem a vantagem de ter em consideração estudos de pequena escala e observações de peritos relativamente a países onde não são realizados regularmente inquéritos sobre o consumo de droga. As informações qualitativas sobre as tendências do consumo de "ecstasy" foram comunicadas em diferentes categorias pelos países antes da aplicação pelo UNODC do seu novo instrumento de recolha de dados (o questionário do relatório anual atualizado, que entrou em vigor em 2020), pelo que os relatórios qualitativos sobre as tendências do consumo de "ecstasy" se limitam ao período de 2019-2020. Estes relatórios sugerem um aumento moderado a nível mundial. Ao mesmo tempo, estudos de países onde o "ecstasy" é utilizado em contextos recreativos sugerem que o consumo de "ecstasy" diminuiu mais do que o de qualquer outra droga durante a pandemia nesses países. A análise das águas residuais, embora limitada em termos de cobertura geográfica à Europa, à América do Norte e a algumas partes da Ásia e da Oceânia, também sugere que o consumo de "ecstasy" diminuiu entre 2019 e 2020 mais do que o consumo de anfetaminas. Na maioria dos locais analisados, foram identificados níveis crescentes de consumo de MDMA, enquanto numa ligeira maioria desses locais foi detetado um aumento do consumo de anfetaminas e uma diminuição do consumo de metanfetaminas. Os primeiros dados da análise de águas residuais de 2021 sugerem um aumento global do consumo de anfetaminas na maioria dos locais monitorizados pelo grupo Sewage Analysis CORe, a maioria dos quais na Europa, entre 2020 e 2021; um aumento e uma diminuição do consumo de metanfetaminas em aproximadamente o mesmo número de locais; e uma diminuição contínua do consumo de MDMA na grande maioria dos locais.
