Brain
Expert Pharmacologist
- Joined
- Jul 6, 2021
- Messages
- 290
- Reaction score
- 329
- Points
- 63
A psilocibina (3-[2-(Dimetilamino)etil]-1H-indol-4-il dihidrogenofosfato) é um alcaloide da família das triptaminas, derivado fosforilado da psilocina, que possui propriedades psicadélicas. De todas as fontes biológicas de psilocibina, as espécies de cogumelos dos géneros Psilocybe, Panaeolus, Stropharia, Gymnopilus e Inocybe contêm a maior quantidade; no entanto, cerca de 200 outras espécies de cogumelos contêm psilocibina. Uma família de cogumelos que contém psilocibina, conhecida sob o nome de "cogumelos mágicos", tem sido utilizada pelos seus efeitos alucinogénios ao longo da história. No final dos anos 50, Albert Hoffman, da empresa Sandoz Laboratories, isolou e sintetizou os compostos psicoactivos psilocibina e psilocina a partir de fungos que contêm psilocibina. A psilocibina foi vendida pela Sandoz como indocibina para ensaios clínicos psicofarmacológicos e terapêuticos fundamentais. Atualmente, são conhecidas espécies de Psilocybe na Ásia, Austrália, Estados Unidos, Canadá, México, América Central e do Sul, África e Europa. Existem muitas provas de que as espécies que contêm psilocibina tiveram início em África e na Europa, bem como indicações de que o Psilocybe estava presente no Velho Mundo antes do aparecimento dos seres humanos modernos. Os cogumelos com psilocibina podem ser encontrados na natureza ou cultivados num ambiente controlado a partir de esporos. A popularidade da psilocibina cresceu rapidamente na década de 1960. Em 1970, foi incluída na lista I, o que levou a uma redução significativa da investigação sobre a psilocibina. No entanto, estudos preliminares recentes sobre a psilocibina mostraram as perspectivas da sua aplicação no tratamento da perturbação obsessivo-compulsiva, da dependência do álcool, da perturbação depressiva major e da depressão em doentes com cancro terminal. A psilocibina está classificada como substância da lista I nos Estados Unidos, ao abrigo da Lei das Substâncias Controladas de 1971, pelo que só podem ser produzidas quantidades limitadas por ano. Apesar do seu estatuto de substância da lista I, a psilocibina tem sido uma droga recreativa popular desde os anos 60 e, embora o seu uso tenha diminuído desde que se tornou uma substância controlada, o uso recreativo continua. A maioria dos outros países desenvolvidos classificou a psilocibina e os cogumelos que contêm psilocibina como ilegais. A maior exceção a esta generalidade é a Holanda, que tem uma lacuna legal que permite o cultivo, a venda e a ingestão de "trufas" psicoactivas contendo psilocibina. As primeiras provas de utilização por xamãs da América Central e do Sul foram identificadas em vários locais. O estudo moderno começou no final dos anos 1950 com o etnomicólogo R. Gordon Wasson e continuou com os famosos investigadores psicadélicos Timothy Leary, Ralph Metzner e Ram Dass na Universidade de Harvard, Albert Hofmann nos Laboratórios Sandoz, Terrence McKenna e Jonathan Ott nos anos 1960 e início dos anos 1970. O interesse de psiquiatras e psicólogos na década de 1950 seguiu-se devido à perceção do seu potencial como instrumento para encurtar a psicoterapia. A investigação interessada no tratamento psicadélico da dependência começou já na década de 1950. Muitas vezes, foram observados efeitos perspicazes que ajudaram à sobriedade, o que levou Humphry Osmond a cunhar o termo "psicadélico" como forma de descrever as capacidades de "manifestação da mente" desta classe de drogas. A maior parte da investigação clínica foi realizada na década de 1960, utilizando frequentemente a versão sintética indocibina.
Síntese da pcilocibina
Sínteseda pcilocina
A psilocibina foi encontrada em mais de 100 espécies de cogumelos, muitas das quais pertencem ao género Psilocybe. O alcaloide psilocibina na família Inocybeacede aparece entre 10 e 20 mya, e é provável que o aparecimento da psilocibina na família Psilocybe também tenha surgido por volta dessa altura. Atualmente, são conhecidas espécies de Psilocybe na Ásia, Austrália, Estados Unidos, Canadá, México, América Central e do Sul, África e Europa. Há um grande nível de evidência de que as espécies que contêm psilocibina começaram em África e na Europa, bem como indicações de que o Psilocybe estava presente no Velho Mundo antes do aparecimento dos humanos modernos. Os cogumelos que contêm psilocibina podem ser encontrados na natureza ou cultivados num ambiente controlado a partir de impressões de esporos, que são criadas colocando a tampa de um cogumelo conhecido numa folha de papel encerado e permitindo que os esporos caiam sobre o papel, criando uma impressão digital única do cogumelo. Embora esta última seja significativamente mais comum e muito mais segura, alguns utilizadores continuam a procurar "cogumelos mágicos" na natureza. O perigo de identificação incorrecta está sempre presente e é um erro a que até os micologistas mais experientes são susceptíveis. A identificação incorrecta pode levar a um erro a que até os micologistas mais experientes são susceptíveis. A identificação incorrecta pode levar a qualquer coisa, desde um ligeiro desconforto até à morte. A morte abrupta é mais frequentemente observada em micologistas amadores que procuram cogumelos contendo psilocibina e outro tipo de cogumelo psicoativo vulgarmente conhecido como "Fly Agaric" (Amanita muscaria), que é o icónico cogumelo com a tampa pontilhada de vermelho e branco frequentemente visto em contos de fadas (em vez de psilocibina, o A. muscaria contém as drogas psicoactivas muscimol e ácido ibotenio). Infelizmente, várias espécies de Amanita são mortais, incluindo a apropriadamente designada "Capa da Morte" (Amanita phalloides) e o "Anjo Destruidor" (Amanita virosa), que podem parecer muito semelhantes à Amanita muscaria e espécies afins. O legado e a utilização de "cogumelos mágicos" são vistos ao longo da história antiga e continuam na era moderna. Foram identificadas provas antigas de utilização por xamãs da América Central e do Sul em vários locais. O estudo moderno começou no final dos anos 1950 com o etnomicólogo R. Gordon Wasson e continuou com os famosos investigadores psicadélicos Timothy Leary, Ralph Metzner e Ram Dass na Universidade de Harvard, Albert Hofmann nos Laboratórios Sandoz, Terrence McKenna e Jonathan Ott nos anos 1960 e início dos anos 1970. O interesse de psiquiatras e psicólogos na década de 1950 deveu-se à perceção do seu potencial como instrumento para encurtar a psicoterapia. A investigação interessada no tratamento psicadélico da dependência começou já na década de 1950. Foram frequentemente observados efeitos perspicazes que ajudaram à sobriedade, o que levou Humphry Osmond a cunhar o termo "psicadélico" como forma de descrever as capacidades de "manifestação da mente" desta classe de drogas.
A estrutura da psilocibina e de outros alucinogénios de indolealquilamina é semelhante à do neurotransmissor endógeno serotonina, da hormona melatonina e do suposto psicadélico endógeno N, N-dimetiltriptamina. Todas elas derivam do mesmo composto - a triptamina. A psilocibina (O-fosforil-4-hidroxi-N, N-dimetiltriptamina) e o seu metabolito ativo desfosforilado psilocina (N, N-dimetiltriptamina) pertencem estruturalmente ao grupo dos alucinogénios triptamina/indolamina e estão estruturalmente relacionados com a serotonina. Uma dose equimolar de 1 mol de psilocina é 1,4 mol de psilocibina. A substituição do núcleo indole na posição 4 desempenha provavelmente um papel substancial nos seus efeitos alucinogénios. A psilocibina e a psilocina nas suas formas puras são pós cristalinos brancos. Enquanto a psilocibina é solúvel em água, a psilocina, por outro lado, é mais solúvel em lípidos. No entanto, a psilocina também pode ser diluída numa solução aquosa acidificada e em dimetilsulfóxido (DMSO; até 100 mM). Além disso, ambas as substâncias são solúveis em metanol e etanol, mas quase insolúveis em éter de petróleo e clorofórmio. Ambas as drogas são instáveis à luz (em particular na forma de soluções), a sua estabilidade a baixas temperaturas no escuro sob uma atmosfera inerte é muito boa. A psilocibina é um composto termolábil, solúvel em água, metanol e etanol, mas insolúvel em solventes orgânicos. Tem uma atividade extremamente baixa por si só; actua principalmente como um pró-fármaco da psilocina. Os valores de pKa variam entre 1,3 e 6,5. Quando exposto à luz ultravioleta, a sua estabilidade em solução é afetada, o que provoca a oxidação. Solúvel em metanol a 120 partes em ebulição; dificilmente solúvel em etanol; praticamente insolúvel em clorofórmio, benzeno, pressão de vapor - 1,9X10-12 mm Hg a 25 °C. O peso molecular é 285,25; tem um sabor amoniacal, um ponto de fusão de 224 graus Celsius, pH 5,2 em etanol-água a 50%, TDLo 75 mkg/kg quando administrado por via intramuscular no ser humano, TDLo 60 mkg/kg quando administrado por via oral no ser humano, LD50 280 mg/kg quando administrado por via intravenosa em ratos. Considera-se que a psilocibina penetra mal na barreira hemato-encefálica, em comparação com a psilocina. Tal deve-se à diferença nas ligações de hidrogénio, que tornam esta última mais liofílica, facilitando a passagem através da barreira hemato-encefálica. Ao exame visual, é possível distinguir a psilocibina e a psilocina purificadas. Uma tem a aparência de um cristal de agulha branco ou quase branco, a outra forma uma cor oleosa castanha escura a preta.
Estatuto legal.
O governo decretou a proibição da posse de psilocibina e psilocina em 1968. Em 1970, a psilocibina e a psilocina foram listadas como drogas da lista I. Nos EUA, Denver, Oakland, Chicago, Ann Arbor e Santa Cruz descriminalizaram a posse de cogumelos mágicos, mas a venda de cogumelos continua a ser proibida. Em 2020, o Oregon legalizou a psilocibina e o Distrito de Columbia descriminalizou o uso de cogumelos mágicos. É ilegal vender e transportar psilocibina da Áustria. A posse foi descriminalizada e o cultivo é legal, desde que os cogumelos não se destinem ao consumo. As pessoas apanhadas na posse de cogumelos destinados a uso pessoal podem ser obrigadas a submeter-se a terapia gratuita. Em Portugal, os cogumelos com psilocibina são ilegais mas descriminalizados. Os indivíduos apanhados com quantidades destinadas a uso pessoal podem ser obrigados a fazer reabilitação ou terapia. Nos Países Baixos, os cogumelos com psilocibina são legais sob a forma de trufas. De acordo com a política da ONU, a psilocibina é ilegal em Itália; no entanto, os cogumelos psilocibinos são descriminalizados. Os kits de cultivo e os esporos são legais para venda e obtenção, mas punições administrativas, como a perda da carta de condução, podem ser a consequência de ser apanhado com cogumelos. A Espanha descriminalizou a posse e o consumo pessoal de cogumelos com psilocibina, mas a psilocibina em si continua a ser ilegal. O cultivo e a venda são ilegais, e a legalidade dos esporos e dos kits de cultivo é vaga. As Ilhas Virgens Britânicas permitem a posse e o cultivo de cogumelos com psilocibina. No entanto, é ilegal (mas não é aplicada) a sua venda ou transporte. A posse, venda, transporte e cultivo de cogumelos com psilocibina são legais na Jamaica. A Jamaica vende abertamente cogumelos com psilocibina. É legal a posse, venda, transporte e cultivo de cogumelos mágicos no Brasil. A psilocibina e a psilocina estão listadas como ilegais, mas os cogumelos em si não são considerados ilegais. A posse de cogumelos mágicos é ilegal no México, embora não exista fiscalização se os cogumelos mágicos pertencerem a culturas indígenas. O cultivo de cogumelos é ilegal, exceto se os cogumelos forem cultivados na natureza. A venda e o transporte são ilegais. Os cogumelos mágicos são legais em Samoa. A partir de 2018, são ilegais no Vietname.
Atualmente, classificados como substância da Lista I, os investigadores da Universidade Johns Hopkins afirmam que os cogumelos com psilocibina devem ser despromovidos de substância da Lista I para a Lista IV. Em 2019, a cidade de Oakland, CA votou pela descriminalização dos cogumelos mágicos apenas um mês depois de Denver, CO ter decidido fazê-lo. Há um impulso na Califórnia para descriminalizar os cogumelos psilocibinos em nível estadual, com muitos grupos psicodélicos de conscientização e defesa apoiando essa mudança. Além disso, a legislatura do estado do Oregon está a considerar aprovar um projeto de lei para descriminalizar os cogumelos psilocibinos e oferecer licenças para o seu cultivo. Grande parte desta investigação promissora está a acontecer devido à Associação Multidisciplinar de Estudos Psicadélicos (MAPS), que está atualmente a fazer investigação médica com MDMA, psilocibina, LSD, marijuana, ibogaína e ayahuasca. Outra organização, o Heffter Research Institute, especializa-se na investigação da psilocibina. Entre os membros do conselho de administração do Heffter Research Institute encontra-se o cofundador, Dr. David Nichols, um investigador, professor e perito em química de alucinogénios muito conhecido. Outros investigadores incluem o Dr. Dennis McKenna, um escritor estimado, etnofarmacologista, psiconauta e irmão do falecido Terrence McKenna, e o Dr. Roland Griffiths que está a fazer uma investigação fenomenal na Johns Hopkins sobre psilocibina e dependência. Existem também vários estudos sobre a psilocibina atualmente em curso a nível internacional. A Fundação Beckley, sediada no Reino Unido, está a patrocinar algumas das investigações mais avançadas sobre a psilocibina. Fundada em 1996 por Amanda Fielding - uma estimada psiconauta e cientista - a Fundação Beckley está atualmente a patrocinar investigação sobre a neurociência da psilocibina, juntamente com a MAPS e a Heffter. Esta pesquisa está a decorrer no Imperial College de Londres com o Dr. David Nutt e o Dr. Robin Carhart-Harris, ambos os quais já publicaram pesquisas sobre psilocibina no passado, nomeadamente o "Entropic Brain Model". Heffter também está a patrocinar um estudo na Suíça intitulado "Efeitos da Psilocibina na Atenção, Perceção e Cognição". Da mesma forma, a MAPS está a patrocinar um estudo chamado "Estudos Experimentais sobre os Efeitos da Psilocibina na Inversão de Profundidade Binocular, Rivalidade Binocular" na Alemanha.
Farmacocinética e farmacodinâmica.
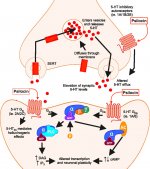
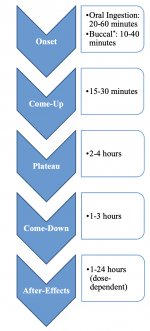
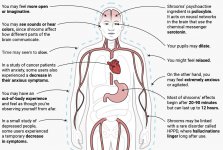
Quando ingerida, a psilocibina sofre uma biotransformação no fígado, onde é desfosforilada em psilocina por uma enzima desconhecida. Depois de entrar no fluxo sanguíneo sistémico, a psilocibina entra no cérebro, onde tem efeito psicoativo. De acordo com outros dados, após administração oral, a psilocibina é rapidamente desfosforilada no ambiente ácido do estômago ou sob a ação da fosfatase alcalina (e outras esterases inespecíficas) no intestino, nos rins e possivelmente no sangue, formando um composto fenólico, a psilocina, que pode facilmente atravessar a barreira hemato-encefálica. É de salientar que a potência relativa da psilocina e da psilocibina é quase idêntica ao rácio do peso molecular destes compostos. O bloqueio da fosfotase alcalina por substratos competitivos de β-glicerofosfato nivela os sintomas de intoxicação. A psilocina é submetida a ambas as fases do metabolismo. A primeira fase do metabolismo inclui a desaminação oxidativa da psilocina em 4-hidroxiindol-3-acetaldeído, catalisada pela monoamina oxidase hepática ou pela aldeído desidrogenase, com a consequente oxidação em ácido 4-hidroxiindol-3-acético, 4-hidroxiindol-3-acetaldeído e 4-hidroxitriptofol. As enzimas que participam neste processo ainda não foram identificadas. É por isso que os inibidores da MAO podem potenciar os efeitos alucinogénios da psilocibina, tal como o etanol pode potenciar a viagem, porque o seu metabolito primário, o acetaldeído, reage in vivo com aminas endógenas, formando assim tetrahidroisoquinolinas e β-carbolinas, inibidores da MAO. Uma vez que a psilocibina induz uma inibição competitiva da MAO (que metaboliza a serotonina), o nível de serotonina no cérebro aumenta e, simultaneamente, a concentração de 5-HIAA diminui. Além disso, em termos de efeitos clínicos, a via metabólica é insignificante, envolvendo oxidação que resulta na formação de um produto azul-escuro, com a estrutura de o-quinona ou iminoquinona. Esta via é catalisada por hidroxiindol oxidases (ceruloplasmina, a oxidase contendo cobre do plasma dos mamíferos, e citocromo oxidase). Os metabolitos acima referidos demonstram uma atividade fisiológica insignificante. Quando a psilocibina é administrada por via parentérica, as fosfatases tecidulares desempenham o mesmo papel, sendo as dos rins as mais activas. Considerando que o bloqueio competitivo da desfosforilação bloqueia a ação psicotrópica da psilocibina, é evidente que a psilocina é o principal metabolito ativo da psilocibina. No prazo de 5 horas após a administração oral de psilocibina, até 80% da psilocina está presente no sangue sob a forma de um conjugado O-glucuronídeo e é excretada na urina sem alterações. A glucuronidação do grupo hidroxilo em psilocinaO-glucuronido é uma fase importante da desintoxicação, razão pela qual a hidrólise enzimática aumenta o tempo de deteção em amostras de urina. Embora a psilocina sofra uma glucoronidação extensiva pelas UDP-glucuronosiltransferases (UGT)1A10 no intestino delgado, a UGT1A9 dá o principal contributo para a glucoronidação após a sua absorção no sangue. Neste caso, a N-glucuronidação não ocorre ao longo do metabolismo. Para além da via acima mencionada, a própria psilocina também sofre metabolismo oxidativo. A desmetilação e desaminação do 4-hidroxiindol-3-il-acetaldeído (4-HIA) com subsequente oxidação (presumivelmente pela aldeído desidrogenase hepática e pela monoamina oxidase) resulta na formação de ácido 4-hidroxiindol-3-acético (4-HIAA) e 4-hidroxitriptofol (4-HT). Estes metabolitos insignificantes (cerca de 4% desintegram-se da forma descrita acima) podem ser detectados no plasma sanguíneo humano. A terceira via de metabolismo da psilocina envolve a oxidação por hidroxiindol oxidases, como já foi referido. A psilocina é distribuída a todos os tecidos, incluindo o cérebro, e é eliminada em 24 horas. A maior parte é eliminada nas primeiras 8 horas (cerca de 65% na urina e 15-20% na bílis e nas fezes). Pode ser detectada na urina durante 2 semanas. As concentrações mais elevadas de psilocina encontram-se no neocórtex, hipocampo, sistema motor extrapiramidal e formação reticular. Nos seres humanos, a psilocibina e a psilocina podem ser detectadas no plasma sanguíneo após 20-40 minutos da administração oral. As concentrações máximas são atingidas em 80-100 minutos e podem ser detectadas em seis horas. O período de meia-vida da psilocina no plasma sanguíneo é de cerca de 2/5 horas após a administração oral e de 1,23 horas após a administração parentérica. Como já foi referido, cerca de 80% da psilocina no plasma encontra-se na forma conjugada. A psilocina (90-97%) e a psilocibina (3-10%) podem ser detectadas na urina inalteradas ou conjugadas com ácido glucorónico. A semi-vida de eliminação é de cerca de 50 minutos e a constante de eliminação é de 0,307/h. A maior parte da substância é eliminada nas primeiras três horas após a administração oral e é completamente excretada na urina em 24 horas. A via metabólica completa da psilocibina foi muito pouco estudada e ainda há muita informação a recolher para determinar os mecanismos exactos envolvidos no seu metabolismo.
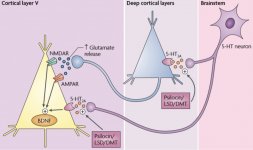
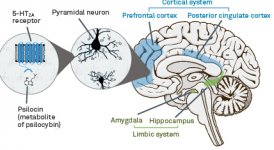
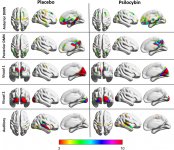
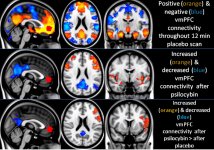
A farmacologia da psilocibina é muito complexa e não foi suficientemente estudada. A psilocibina pode presumivelmente ter uma atividade própria insignificante; no entanto, actua sobretudo como um pró-fármaco da psilocina. Esta última atravessa facilmente a barreira hemato-encefálica e aí exerce o seu efeito psicoativo. Os principais locais de ligação estão resumidos no quadro acima. A psilocina tem a ligação mais forte aos receptores de serotonina: 5-HT1D,2B,2C,5,6,7), tem também um potencial de ligação moderado aos receptores da serotonina (5-HT1A, 1B, 2A). Para além dos receptores de serotonina, a psilocina tem uma certa afinidade para os receptores de histamina do primeiro tipo (H1), para os receptores alfa-2A e -2B e para os receptores de dopamina do terceiro tipo (D3). Nos neurónios que exprimem o recetor 5HT2A, mas não nos knockouts 5HT2A, a psilocibina aumenta a expressão dos genes precoces (erg-1, erg-2, c-fos, jun-B, period-1, gpcr-26, fra-1, N-10, I-κBα) e reduz a expressão da sty-kinase. Escusado será dizer que a via de sinalização precisa que conduz do recetor à ativação dos genes precoces ainda não é conhecida. Dado que uma lisurida não alucinogénica também ativa o c-fos, é provável que a expressão do c-fos reflicta apenas o aumento da atividade neuronal, enquanto a expressão do egr-1/egr-2 é específica do efeito alucinogénico. Gonzales-Meaeso explicou esta seletividade com a "teoria do tráfico agonista da sinalização dos receptores", segundo a qual os alucinogénios activam o heterocomplexo de receptores 5HT2A/mGlu2 e diferentes proteínas G em comparação com os agonistas 5-HT2A não halucinogénicos. Esta hipótese é apoiada por um estudo em que ratinhos com o gene de eliminação do recetor mGlu2 não apresentam qualquer comportamento de contração da cabeça. Está provado que a psilocilina inibe o transportador de serotonina dependente de sódio (SERT), o que leva a um aumento da concentração de serotonina. A serotonina permanece na fenda sináptica após a sua libertação, o que acaba por levar à ativação repetida dos neurónios serotoninérgicos pós-ganglionares. Quanto à avaliação da afinidade de ligação aos receptores, estes são ordenados da seguinte forma: 5HT2B > 5HT1D > D1 > 5HT1E > 5HT1A > 5HT5A > 5HT7 > 5HT6 > D3 > 5HT2C > 5HT1B > 5HT2A. A ligação aos receptores de imidazolina do primeiro tipo também foi comprovada. É interessante notar que a afinidade da psilocibina pelos receptores 5-НТ2А humanos é 15 vezes superior à dos ratos. O agonismo dos receptores 5НТ2А e a ativação de um número excessivo destes receptores e subtipos de receptores são responsáveis pelos efeitos psicadélicos únicos e intensos causados pela psilocibina. Anteriormente, houve muitas discussões sobre se os receptores 5-НТ2А ou 5-НТ2С são responsáveis por alucinações isoladas após a ingestão de cogumelos contendo psilocibina. Os estudos mostraram que os antagonistas de 5-НТ2А suprimem as alucinações, enquanto os antagonistas de 5-НТ2С não têm nem a potenciação das alucinações, nem o efeito de nivelamento sobre elas. Assim, o agonismo dos receptores 5-НТ2А está associado à excitação geral dos neurónios, à melhoria da memória e da aprendizagem, às contracções do tecido muscular liso vascular, do trato gastrointestinal e dos brônquios, a uma certa atividade anti-inflamatória, ao aumento da produção de prolactina e de oxitocina, da hormona adrenocorticotrópica e da renina, aquando da ativação do sistema renina-angiotensina-aldosterona. Quanto à ativação da 5-НТ2С pela psilocina, ocorre a ativação da proopiomelanocortina (precursora da hormona estimulante dos α-, β- e γ-melanócitos e da hormona adrenocorticotrópica) e a libertação de cortisol. Estas hormonas aumentam o apetite, a sensibilidade à insulina, o metabolismo da glicose, a estabilização face a estímulos ansiogénicos e stressantes. A psilocina actua como agonista parcial dos receptores 5-НТ1А, que se expressam principalmente no núcleo da rafe (DRN) e no núcleo mediano da rafe (MRN), localizados perto da linha média do tronco cerebral ao longo de toda a sua extensão rostro-caudal, como autoreceptores somatodendríticos. O MRN promove a ativação dos processos de consolidação da memória e projecta-se para o hipocampo, enquanto o VRN é um dos maiores núcleos serotoninérgicos do cérebro humano, que fornece uma quantidade significativa de inervação serotoninérgica do prosencéfalo; além disso, o MRN tem fibras de projeção na amígdala e no hipotálamo, o que está associado à regulação do ritmo circadiano e de vários tipos de células que produzem catecolaminas e substância-P. O DRN e o MRN são ricos em receptores 5-НТ1А pré-sinápticos, e a psilocina tem um efeito várias vezes (5-6 vezes) mais forte particularmente nos seus sítios pré-sinápticos em comparação com os pós-sinápticos. Esta preferência explica-se por uma elevada densidade de receptores 5-НТ1А, que se encontram nestas zonas. Este determinado tipo de receptores, localizado nos corpos das células serotoninérgicas da zona da rafe, não se encontra, por exemplo, nas membranas pós-sinápticas. Em estudos por fMRI, foi revelado que a psilocibina diminui significativamente o fluxo sanguíneo e a oxigenação venosa no cérebro. Este facto está correlacionado com o seu efeito subjetivo e reduz significativamente a ligação positiva entre dois nós estruturais chave (mPFC и PCC). Está provado que a psilocibina aumenta o metabolismo da glucose no cérebro. Além disso, algumas experiências provaram que a DMN é também crucial para manter a integração cognitiva e as limitações em condições normais. Após a ligação da psilocibina aos receptores pré-sinápticos 5-НТ1А da área DRN, ela suprime os efeitos dessa área, enquanto as células subjacentes permanecem intactas e aumentam a atividade simpática associada ao locus coeruleus. Outras localizações dos receptores 5-НТ2А demonstram uma rápida diminuição na atividade desse recetor e uma diminuição em sua densidade na ativação pela psilocina. Assim, a psilocibina não tem tolerância à ação inibidora da DRN. É importante notar que os agonistas selectivos dos receptores 5-НТ1а não são alucinogénios no seu núcleo, no entanto, têm um papel na influência dos efeitos inibitórios, que são identificados no DRN.
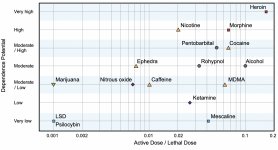
Embora os receptores dopaminérgicos do segundo tipo desempenhem um papel significativo nas alucinações que se formam em várias doenças mentais, presume-se que não têm qualquer relação ativa e indireta com a ação da psilocina. Esta hipótese foi comprovada pela primeira vez por Vollenweider e outros, ao verificarem que a administração de galoperidol (agonista do D2R) não enfraquece os efeitos psicoactivos da psilocina. Embora os efeitos dopaminérgicos da psilocina sejam considerados mínimos, a psilocina tem uma capacidade de ligação relativamente elevada ao recetor D3, em comparação com outros subtipos de receptores de dopamina. Apesar de os efeitos mediados pelo recetor D3 terem sido pouco estudados, presume-se que contribuem para as propriedades psicoactivas características da psilocibina e para a sua capacidade de causar dependência. O precursor químico da psilocibina, a 4-acetoxi-N,N-dimetiltriptamina, tem o grupo fosforiloxi substituído por um grupo acetoxi. É metabolizado da mesma forma que o grupo fosforiloxi, e esta modificação permite contornar alguns processos metabólicos da primeira fase. Apesar de a psilacetina ser uma substituição farmacológica idêntica à psilocibina, muitos utilizadores referem que existe uma diferença insignificante, mas distinguível, entre elas. A psilacetina é frequentemente descrita como uma substância com um início de ação mais rápido, que não envolve ansiedade e náuseas (que estão associadas ao consumo de psilocibina devido à falta de quitina, normalmente contida nos cogumelos) e tem uma duração mais curta. É sabido que a dose letal média em ratos é de cerca de 293 mg/kg, o que indica uma enorme janela terapêutica da psilocibina. A taquifilaxia, uma dessensibilização rápida a uma substância que leva a uma diminuição do efeito fisiológico, é um fenómeno associado ao uso de muitos alucinogénios. A tolerância à psilocibina começa a desenvolver-se logo após a primeira utilização única. O mecanismo envolve uma resposta fisiológica à estimulação excessiva dos receptores 5-НТ2А através da redução rápida dos sítios receptores e da diminuição da densidade dos receptores na célula. Em geral, acredita-se que esses locais receptores retornam a cinquenta por cento do nível original em 3-7 dias desde o uso inicial. Regressam à sua quantidade original em 4 semanas, dependendo da dose e da duração da utilização repetida. Além disso, existe tolerância cruzada entre as classes de alucinogénios indolealquilamina e fenilalquilamina.
Attachments
-
 aDjgnEic18.jpg572.2 KB · Views: 1,641
aDjgnEic18.jpg572.2 KB · Views: 1,641 -
 sRHGpjI9LU.jpg788.9 KB · Views: 1,613
sRHGpjI9LU.jpg788.9 KB · Views: 1,613 -
 TQv018fRJh.jpg128.6 KB · Views: 959
TQv018fRJh.jpg128.6 KB · Views: 959 -
lF1rOfpW8k.jpg2.6 MB · Views: 993
-
 TSkYz5Gq6P.jpg363.8 KB · Views: 1,773
TSkYz5Gq6P.jpg363.8 KB · Views: 1,773 -
 sPlo2QDBMe.jpg551.6 KB · Views: 1,744
sPlo2QDBMe.jpg551.6 KB · Views: 1,744 -
 AxRV2Hfutv.jpg697.8 KB · Views: 1,766
AxRV2Hfutv.jpg697.8 KB · Views: 1,766 -
 b2Ma0wsVTD.jpg607.2 KB · Views: 1,838
b2Ma0wsVTD.jpg607.2 KB · Views: 1,838 -
 QtXjIHo7PJ.jpg438.5 KB · Views: 1,635
QtXjIHo7PJ.jpg438.5 KB · Views: 1,635 -
 rI0YMKgE6z.jpg1.1 MB · Views: 1,777
rI0YMKgE6z.jpg1.1 MB · Views: 1,777 -
 Q1ueUSGlFN.jpg614.4 KB · Views: 1,787
Q1ueUSGlFN.jpg614.4 KB · Views: 1,787
Last edited by a moderator:
