G.Patton
Expert
- Joined
- Jul 5, 2021
- Messages
- 2,659
- Solutions
- 3
- Reaction score
- 2,734
- Points
- 113
- Deals
- 1
Introduktion
Lysergsyra, det grundläggande fragmentet som härrör från ergotalkaloiderna, har syntetiserats i en fjorton sekvens som börjar med 3-beta-karboxietylindol. Utgångsmaterialet omvandlades till intermediären 1-bensoyl-5-keto-1,2,2a-3,4,5-hexahydrobenz-[cd]-indol ( 3), som innehåller tre av de fyra ringar som finns i lysergsyra. Denna keton omvandlades i sin tur till den tetracykliska föreningen, 9-keto-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4.3-fe]-kinolin ( 8), och därifrån till lysergsyra ( 14). Denna syntes är inte enkel och kräver mycket laboratorieerfarenhet och kemikunskap. Dessutom finns det flera manipulationer med farliga ämnen, som måste utföras med strikta säkerhetsåtgärder.
Kokpunkt: 536,2 ± 50,0 °C vid 760 mm Hg;
Smältpunkt: 240 °C;
Molekylvikt: 268,31 g/mol;
Densitet: 1,4 ± 0,1 g/mL;
CAS-nummer: 82-58-6.
Utrustning och glasvaror:
- Hydreringsreaktor av stål 2-3 L;
- Autoklav av stål 500 mL;
- Laboratorieskala (0,01 - 500 g är lämpligt);
- Kolvar med rund botten 100, 200, 500 ml, 5 och 10 l;
- Kompressor för väte (H2) och ursprung;
- Buchnerkolv och tratt (stor) 5 L [Schott-filter kan användas för små mängder];
- Rotovap-maskin (stor);
- Vakuumkälla;
- Skiljetrattar 500 mL och 2 L;
- Kväveballong ~50-70 L (1 bar);
- Septumlock för kolvar;
- Badkar med saltat isvatten;
- 5 L x2, 2 L x2; 1 L x2; 500 mL x2; 100 mL x3; 50 mL x2 Bägare;
- Glasspruta eller pasteurpipett;
- Magnetomrörare eller toppomrörare;
- Uppställning för vakuumdestillation;
- Återflödeskondensor;
- Retortstativ och klämma för att fästa utrustningen;
- Laboratorietermometer (-20 °C till 200 °C) med kolvadapter;
- pH-indikatorpapper;
- Glasstav och spatel;
- 250 watts glödlampa.
Reagenser.
- 3-Indolepropionsyra ( 1), 94,6 g (0,5 mol);
- 9,5 L destillerat vatten (H2O);
- ~400 g natriumhydroxid (NaOH);
- 116 g Raney nickel (Ni);
- 1050 mL saltsyra (HCl) koncentrerad;
- 2 mL svavelsyra (H2SO4 konc.);
- 210 ml 12N natriumhydroxid (NaOH) aq-lösning;
- 180 ml bensoylklorid;
- ~1,5 L metanol (MeOH);
- ~1,6 l etanol (EtOH);
- 201,2 ml tionylklorid (SOCl2)
- 1950 mL koldisulfid (CS2)
- 240 g Aluminiumklorid (AlCl3);
- 2,5 l Bensen;
- 500 mL 2N natriumhydroxid (NaOH);
- ~3,2 L Dietyleter (Et2O);
- 3,3 L isättika (AcOH);
- 352 g (1,1 mol) Pyridinhydrobromid perbromid;
- 5 L Kloroform (CHCl3);
- ~1000 g Magnesiumsulfat (MgSO4);
- 307 g (2,35 mol) Metylaminoaceton etylenketal ( 5);
- 4,5 L Bensen;
- ~500 g Aktivt kol (C);
- ~1 L Aceton;
- ~500 g natriumbikarbonat (NaHCO3);
- 80 mL kall ättiksyraanhydrid (Ac2O)
- 1,5 g natriumborhydrid (NaBH4);
- 75 mL Svaveldioxid (SO2 flytande)
- 40 g Natriumcyanid (NaCN pulver);
- 300 ml Cyanväte (HCN flytande);
- 78 ml 1,5% kaliumhydroxid (KOH) aq. lösning;
- 8,5 g hydratiserat natriumarsenat;
- ~ 50 ml xylen;
- 100 mL Ammoniumhydroxid (NH4OH) utspädd lösning;
- 16,9 g natriummetoxid (MeONa).
Förfarande
1-Benzoyl-3-(beta-karboxietyl)-2,3-dihydroindol (2)3-Indolepropionsyra ( 1), 94,6 g (0,5 mol), löstes i 600 ml vatten som innehöll 20 g natriumhydroxid. Lösningen blandades med ca 100 g Raney nickelkatalysator och hydrogenerades vid RT i en 2-3 L hydrogeneringsbomb av stål vid 3000-4000 psi (207-276 bar) H2-tryck. Reduktionen var vanligtvis fullständig efter 20-30 timmar, varefter katalysatorn filtrerades och tvättades med lite vatten. Koncentrerad HCl-syra, 85 mL, tillsattes till filtratet och lösningen kyldes. Om reduktionen var ofullständig, separerade oreagerad indolpropionsyra vid denna tidpunkt och avlägsnades genom filtrering. Filtratet bensoylerades sedan enligt den vanliga Schotten-Baumann-metoden med 210 ml 12N natriumhydroxid och 180 ml bensoylklorid. Lösningen hölls alkalisk under hela bensoyleringen och temperaturen hölls under 40 °C genom kylning. När bensoylkloriden hade reagerat fullständigt kyldes blandningen och surgjordes med 300 ml koncentrerad HCl-syra. Råprodukten filtrerades och tvättades med vatten, varefter den extraherades med 4 x 1 L portioner varmt vatten för att avlägsna bensoesyran. Denheta sirapsliknande produkten ( 2), efter dekantering av vattenextraktet, kristalliserades från några volymer metanol; utbyte 103 g (70 %), MP: 151-153 °C.
1-Benzoyl-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indol (3)
1-Benzoyl-3-(beta-karboxietyl)-2,3-dihydroindol ( 2), 118 g (0,4 mol), blandades med 200 ml ren tionylklorid. Lösningen fick stå i 30 minuter, varefter den värmdes försiktigt i 15-20 minuter på ångbadet. Överskott av tionylklorid indunstades fullständigt under 30 °C i vakuum och den råa syrakloriden löstes i 200 mL koldisulfid. Lösningen av syrakloriden tillsattes sedan i en tunn ström till en kraftigt omrörd suspension av 240 g aluminiumklorid i 1750 mL koldisulfid i en 5 L kolv (i HOOD!!!). Ett komplex separerades och omrörningen blev svår. Blandningen upphettades under återflöde och omrördes i en timme för att slutföra reaktionen, varefter den sönderdelades mycket försiktigt genom tillsats av 500 g is, 250 mL koncentrerad HCl-syra och 500 mL vatten. Under nedbrytningen upprätthölls omrörningen och kylningen påverkades genom periodisk destillation av koldisulfiden i vakuum, och produkten extraherades med 2 L bensen. Extraktet tvättades noggrant med 500 mL 2N natriumhydroxid i tre portioner och sedan med vatten. Det torkades över magnesiumsulfat och indunstades sedan till liten volym i vakuum. Långsam tillsats av flera volymer eter fick den gula ketonen ( 3) att kristallisera. Den filtrerades och tvättades med eter; utbyte 85,3 g (77 %), MP: 146-147 °C. Ett prov omkristalliserades för analys från benseneter.
1-Benzoyl-3-(beta-karboxietyl)-2,3-dihydroindol ( 2), 118 g (0,4 mol), blandades med 200 ml ren tionylklorid. Lösningen fick stå i 30 minuter, varefter den värmdes försiktigt i 15-20 minuter på ångbadet. Överskott av tionylklorid indunstades fullständigt under 30 °C i vakuum och den råa syrakloriden löstes i 200 mL koldisulfid. Lösningen av syrakloriden tillsattes sedan i en tunn ström till en kraftigt omrörd suspension av 240 g aluminiumklorid i 1750 mL koldisulfid i en 5 L kolv (i HOOD!!!). Ett komplex separerades och omrörningen blev svår. Blandningen upphettades under återflöde och omrördes i en timme för att slutföra reaktionen, varefter den sönderdelades mycket försiktigt genom tillsats av 500 g is, 250 mL koncentrerad HCl-syra och 500 mL vatten. Under nedbrytningen upprätthölls omrörningen och kylningen påverkades genom periodisk destillation av koldisulfiden i vakuum, och produkten extraherades med 2 L bensen. Extraktet tvättades noggrant med 500 mL 2N natriumhydroxid i tre portioner och sedan med vatten. Det torkades över magnesiumsulfat och indunstades sedan till liten volym i vakuum. Långsam tillsats av flera volymer eter fick den gula ketonen ( 3) att kristallisera. Den filtrerades och tvättades med eter; utbyte 85,3 g (77 %), MP: 146-147 °C. Ett prov omkristalliserades för analys från benseneter.
1-Benzoyl-4-bromo-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indole (4)
1-Benzoyl-2,2a,3,4-tetrahydro-4-[metyl-(2-metyl-1,2-dioxolan-2-yl-metyl)-amino]-benz-[cd]-indol-5-(1H)-on (6)
En lösning av 270 g (0,76 mol) 1-bensoyl-4-brom-5-keto-1,2,2a,3,4,5-hexahydrobenz-[cd]-indol (4 ) och 307 g (2,35 mol) metylaminoaceton.35 mol) metylaminoacetonetylenketal ( 5 ) i 4500 mL torr bensen återflödades under kväve i 21 timmar i 10 L RBF med återflödeskylare. Blandningen kyldes och 151 g (93,5 %) metylaminoacetonetylenketalhydrobromid filtrerades, MP: 158-159 °C.
Filtratet tvättades flera gånger med isvatten, varefter det extraherades med 2,5 L kall, utspädd HCl-syra innehållande 150 mL av den koncentrerade syran. Syraextrakten tillsattes omedelbart till ett överskott av iskall utspädd natriumhydroxid. Produkten extraherades med 1 L kloroform och kloroformlösningen torkades över magnesiumsulfat, behandlades med kol och koncentrerades i vakuum. Denkvarvarande ketal-ketonen ( 6) kristalliserades från aceton; MP: och blandning MP: 135-136 °C, utbyte 220 g (71 %).
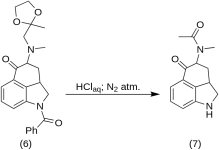
5-Keto-4-[N-metyl-N-acetonylamino]-1,2,2a,3,4,5-hexahydrobenz-[cd]-indol (7)
20 g 1-bensoyl-2,2a,3,4-tetrahydro-4-[metyl-(2-metyl-1,3-dioxolan-2-yl-metyl)-amino]-benz-[cd]-indol-5-(1H)-on ( 6 ) löstes i en blandning av 250 mL koncentrerad HCl-syra och 250 mL vatten, och lösningen hölls under kväve vid 37 °C i 3-5 L RBF i fem dagar. Blandningen kyldes, behandlades med kol, filtrerades och filtratet koncentrerades i vakuum till liten volym. Återstoden behandlades med överskott av natriumbikarbonat; produkten extraherades med kall kloroform och lösningsmedlet avlägsnades i vakuum vid RT. Den råa diketonen ( 7) pulveriserades, slammades upp med ca 75 mL 1:1 benseneter och filtrerades; utbyte 9,8 g (77 %), MP: 105-107 °C. Ett prov för analys omkristalliserades från benseneter eller etanol; MP: 109-110 °C; En monohydroklorid erhölls från utspädd etanol; MP: 200 °C dec.
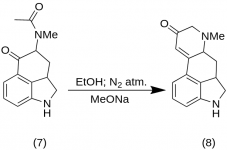
9-Keto-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin (8)
25 g 5-Keto-4-[N-metyl-N-acetonyl]-amino-1,2,2a,3,4,5-hexahydrobenz-[cd]-indol ( 7 ) blandades med 550 ml absolut etanol. Blandningen omrördes under kväve och kyldes till -15 °C i 2-5 L RBF. Därefter tillsattes natriummetoxid, 16,9 g, och blandningen omrördes vid -10 °C till -12 °C i tio minuter. Reaktionsblandningen kyldes till -25 °C och produkten filtrerades i en 6,5-tums buchnertratt och tvättades med lite kall etanol och eter. Med minsta möjliga exponering för luft (innehåller natriummetoxid!) slammades råketonen ( 8) omedelbart upp med lite isvatten och filtrerades på nytt. Den tvättades med isvatten, etanol och eter; utbyte 16,2 g (69 %), MP: 145-147 °C. Ett analytiskt prov omkristalliserades från utspädd etanol; MP: 155-157 °C; Dihydrokloriden framställdes och omkristalliserades från vattenhaltig aceton; MP: 270 °C dec.
4-Acetyl-9-keto-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin (9)
9-Keto-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin ( 8), 24 g, tillsattes till 80 mL kall ättiksyraanhydrid. Blandningen hölls vid 25 °C i 200 mL RBF under ca 5 minuter, varefter den kyldes ordentligt och produkten ( 9) filtrerades och tvättades med eter; utbyte 20,5 g (76 %), mp: 167-170 °C. En andra skörd erhölls genom indunstning av filtratet; detta höjde det totala utbytet till 82%. Ett prov omkristalliserades från aceton-etanol; MP: 169-170 °C; Hydrokloriden framställdes i etanol och omkristalliserades från vattenbaserad etanol; MP: 250 °C dec.
9-Keto-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin ( 8), 24 g, tillsattes till 80 mL kall ättiksyraanhydrid. Blandningen hölls vid 25 °C i 200 mL RBF under ca 5 minuter, varefter den kyldes ordentligt och produkten ( 9) filtrerades och tvättades med eter; utbyte 20,5 g (76 %), mp: 167-170 °C. En andra skörd erhölls genom indunstning av filtratet; detta höjde det totala utbytet till 82%. Ett prov omkristalliserades från aceton-etanol; MP: 169-170 °C; Hydrokloriden framställdes i etanol och omkristalliserades från vattenbaserad etanol; MP: 250 °C dec.
4-Acetyl-9-hydroxi-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin (10)
10 g 4-acetyl-9-keto-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroxindolo-[4,3-fg]-kinolin ( 9 ) tillsattes till en blandning av 150 mL metanol och 10 mL vatten i 500 mL RBF. Natriumborhydrid, 1,5 g tillsattes, och reaktionen fick fortsätta vid RT till liten volym, och en blandning av 15 ml koncentrerad HCl-syra och 60 ml vatten tillsattes. Hydrokloriden ( 10) , som separerades vid kylning, filtrerades och tvättades med metanol, 9,0 g (79 %). Ett prov omkristalliserades från utspädd etanol; MP: 245-246 °C dec.
4-Acetyl-9-klor-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolinhydroklorid (11)
4-Acetyl-9-hydroxi-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolinhydroklorid ( 10), 3.1 g, löstes i 75 mL flytande svaveldioxid i en glasbehållare i en 500 mL stålautoklav. Tionylklorid, 1,2 mL tillsattes, och kärlet förseglades och hölls vid 25 °C i 6 h. Autoklaven ventilerades och reaktionsblandningen avlägsnades. Svaveldioxiden fick avdunsta medan lösningens volym hölls konstant genom långsam tillsats av torr eter. Den amorfa klorhydrokloriden ( 11) filtrerades, tvättades med eter och torkades i vakuum, MP: 130-135 °C dec. Utbyte 3,5 g. Användning av den9-beta-epimeriska alkoholen i denna reaktion gav samma klorid i jämförbart utbyte.
4-Acetyl-9-cyano-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin (12)
Torr, pulveriserad natriumcyanid, 40 g, tillsattes till 300 ml iskall flytande cyanväte. Blandningen omrördes och kyldes i is, och 7,5 g av den råa amorfa 4-acetyl-9-kloro-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo [4,3f/g]-kinolinhydrokloriden ( 11 ) ovan tillsattes. Omrörningen fortsatte i 500 mL RBF under 30 minuter, varefter vätecyaniden snabbt destillerades under reducerat tryck under ca 10 °C. Återstoden blandades med kloroform och isvatten, och den resulterande blandningen filtrerades. Det organiska skiktet separerades och den vattenhaltiga fasen extraherades två gånger med kloroform. De kombinerade extrakten torkades över magnesiumsulfat, avfärgades och lösningsmedlet destillerades i vakuum. Produkten ( 12) kristalliserades från etylacetat; utbyte 3,3 g (54% totalt baserat på alkoholhydrokloriden), m.p. 172-174 °C. Omkristallisering från samma lösningsmedel höjde m.p. till 181-182 °C.
Torr, pulveriserad natriumcyanid, 40 g, tillsattes till 300 ml iskall flytande cyanväte. Blandningen omrördes och kyldes i is, och 7,5 g av den råa amorfa 4-acetyl-9-kloro-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo [4,3f/g]-kinolinhydrokloriden ( 11 ) ovan tillsattes. Omrörningen fortsatte i 500 mL RBF under 30 minuter, varefter vätecyaniden snabbt destillerades under reducerat tryck under ca 10 °C. Återstoden blandades med kloroform och isvatten, och den resulterande blandningen filtrerades. Det organiska skiktet separerades och den vattenhaltiga fasen extraherades två gånger med kloroform. De kombinerade extrakten torkades över magnesiumsulfat, avfärgades och lösningsmedlet destillerades i vakuum. Produkten ( 12) kristalliserades från etylacetat; utbyte 3,3 g (54% totalt baserat på alkoholhydrokloriden), m.p. 172-174 °C. Omkristallisering från samma lösningsmedel höjde m.p. till 181-182 °C.
9-Karbometoxi-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin (13)
Produkten ( 12 ) ovan, 1,0 g, blandades med 15 ml metanol och 0,25 ml vatten. Blandningen kyldes och 2 mL koncentrerad svavelsyra tillsattes långsamt. Lösningen förseglades i ett glasrör under kväve och upphettades vid 100 °C under 23-24 h i 100 mL RBF med återloppskylare. Blandningen behandlades med avkolnat kol och koncentrerades sedan i vakuum till ca 10 mL. Den hälldes på en blandning av kloroform (30 mL), is och 10 g natriumbikarbonat. Kloroformskiktet separerades och den vattenhaltiga fasen extraherades med 3 x 10 mL kloroform. De kombinerade extrakten torkades över magnesiumsulfat, indunstades till torrhet och produkten ( 13) kristalliserades från bensen; utbyte 0,51 g (53 %), MP: 159-160 °C. Den omkristalliserades från etylacetat; MP: 160-161 °C.
Produkten ( 12 ) ovan, 1,0 g, blandades med 15 ml metanol och 0,25 ml vatten. Blandningen kyldes och 2 mL koncentrerad svavelsyra tillsattes långsamt. Lösningen förseglades i ett glasrör under kväve och upphettades vid 100 °C under 23-24 h i 100 mL RBF med återloppskylare. Blandningen behandlades med avkolnat kol och koncentrerades sedan i vakuum till ca 10 mL. Den hälldes på en blandning av kloroform (30 mL), is och 10 g natriumbikarbonat. Kloroformskiktet separerades och den vattenhaltiga fasen extraherades med 3 x 10 mL kloroform. De kombinerade extrakten torkades över magnesiumsulfat, indunstades till torrhet och produkten ( 13) kristalliserades från bensen; utbyte 0,51 g (53 %), MP: 159-160 °C. Den omkristalliserades från etylacetat; MP: 160-161 °C.
Syntetisk dl-lysergsyra (14)
En blandning av 9-karbometoxi-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin ( 13), 3,9 g, och 78 mL 1,5 % kaliumhydroxidlösning återflödades i 30 minuter under kväve. Hydratiserat natriumarsenat, 8,5 g, och Raney-nickel (16 g, vått), som tidigare deaktiverats genom kokning i xylensuspension, tillsattes och blandningen värmdes under återflöde och omrördes i en kväveatmosfär i 20 timmar i 200 mL RBF med återflödeskondensor. Lösningen behandlades med kol och den råa lyserginsyran ( 14) fälldes ut genom neutralisering till pH 5,6. Den filtrerades och tvättades med vatten; utbyte 1,04 g, MP: 240-242 °C dec. En andra skörd, 0,16 g, MP: 233-235 °C dec. erhölls också; totalt utbyte 30%. Syran kunde renas genom att lösa den i utspädd ammoniumhydroxid, behandla med avfärgningskol och återfälla med koldioxid, MP: 242-243 °C dec; en blandning med dl-lysergsyra tillverkad av naturlig d-lysergsyra var likaledes 242-243 °C dec. Den vattenfria syran erhölls genom torkning i vakuum under flera timmar vid 150 °C.
En blandning av 9-karbometoxi-7-metyl-4,5,5a,6,6a,7,8,9-oktahydroindolo-[4,3-fg]-kinolin ( 13), 3,9 g, och 78 mL 1,5 % kaliumhydroxidlösning återflödades i 30 minuter under kväve. Hydratiserat natriumarsenat, 8,5 g, och Raney-nickel (16 g, vått), som tidigare deaktiverats genom kokning i xylensuspension, tillsattes och blandningen värmdes under återflöde och omrördes i en kväveatmosfär i 20 timmar i 200 mL RBF med återflödeskondensor. Lösningen behandlades med kol och den råa lyserginsyran ( 14) fälldes ut genom neutralisering till pH 5,6. Den filtrerades och tvättades med vatten; utbyte 1,04 g, MP: 240-242 °C dec. En andra skörd, 0,16 g, MP: 233-235 °C dec. erhölls också; totalt utbyte 30%. Syran kunde renas genom att lösa den i utspädd ammoniumhydroxid, behandla med avfärgningskol och återfälla med koldioxid, MP: 242-243 °C dec; en blandning med dl-lysergsyra tillverkad av naturlig d-lysergsyra var likaledes 242-243 °C dec. Den vattenfria syran erhölls genom torkning i vakuum under flera timmar vid 150 °C.
Attachments
Last edited: