- Joined
- May 23, 2023
- Messages
- 6
- Reaction score
- 4
- Points
- 3
Introduction :
Un certain vendeur en ligne (que nous ne nommerons pas) semble suggérer une "nouvelle" voie d'accès aux phénéthylamines.
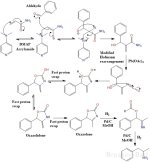
La réaction de l'aldéhyde à l'amine se produit en 3 étapes distinctes :
1) Une réaction de Baylis-Hillman est d'abord utilisée pour coupler un arylaldéhyde avec l'acrylamide en utilisant une base amine tertiaire comme le
DMAP (4-diméthylaminopyridine) ou DABCO/TEDA (triéthylènediamine).
L'acrylamide est un produit chimique industriel utilisé pour fabriquer des polymères, il est également associé aux aliments brûlés.
2) Un réarrangement de Hofmann modifié est ensuite effectué.
Contrairement à la réaction de Hofmann "normale", il est important de noter que le produit final n'est pas une amine.
L'isocyanate intermédiaire ne subit pas d'hydrolyse par l'eau pour former l'acide carbamique qui est ensuite décarboxylé pour donner l'amine.
Au lieu de cela, l'alcool benzylique formé à l'étape 1 subira une cyclisation intramoléculaire formant un cycle carbamate à 5 membres (qui est à la fois un ester et un amide).
Une série d'échanges rapides de protons se produit et isomérise l'oxazolidone non conjuguée en oxazolone conjuguée, plus stable.
3) Dans la dernière étape, une réduction au palladium sur carbone est effectuée en utilisant 3 équivalents d'hydrogène.
Le premier équivalent d'hydrogène est utilisé pour ouvrir le cycle de l'oxazolone, produisant un ester de formate et une imine qui sont ensuite réduits par les deux équivalents d'hydrogène restants.
réduits par les 2 équivalents d'hydrogène restants. L'amine souhaitée est formée avec l'acide formique comme sous-produit.
Ilest possible que cette réaction soit déjà connue des milieux clandestins(bien qu'il s'agisse d'un secret très bien gardé),
Cependant, j'ose dire que la réaction est "nouvelle" parce que je n'ai jamais entendu de discussions/rapports documentés de cette réaction sur des forums similaires ou dans la littérature.
Le mécanisme précis de la réaction est inconnu, bien que j'aie fait de mon mieux pour l'élucider.
Si vous n'êtes pas d'accord avec mes hypothèses mécanistes, veuillez expliquer vos pensées/critiques avec un raisonnement solide dans les commentaires.
Vos commentaires sont très appréciés.
Données bibliographiques :
[1] Pedro Molina, Alberto Tarraga, dans le livre "Comprehensive Organic Functional Group Transformations", 1995, ISBN : 978-0-08-044705-6
"On a découvert que le tétra-acétate de plomb dans la pyridine constituait une procédure douce pour effectuer un réarrangement rapide, à haut rendement, de type Hofmann, des β-hydroxy-amides primaires en 2-oxazolidinones, via le β-hydroxyisocyanate correspondant"
[2] Shinobu Hazama, S. Ichikawa, Fumihiro Yonebayashi, dans le Japanese Journal of Forensic Science and Technology, 2008, DOI : 10.3408/jafst.13.67
"La d-NE a été traitée avec du 1,1-carbonyldiimidazole pour produire le carbamate cyclique correspondant, et le produit a été traité avec de l'hydrure de sodium et de l'iodométhane pour former un dérivé aminé mono-N-méthylé, qui a été traité avec du palladium sur du charbon actif dans une atmosphère d'hydrogène pour une réduction catalytique. Après addition de chlorure d'hydrogène (HCl) aqueux, le l-MA a été obtenu sous la forme de son sel HCl (rendement total de 58 %)"
Mécanisme de la littérature/Schéma de réaction :

Mécanisme/schéma d'action proposé (hypothétique) :

Questions auxquelles il faut encore répondre :
1) Quelles sont les conditions exactes de réaction (température, conc, temps de réaction, etc.) et les réactifs nécessaires pour que cette réaction fonctionne ?
2 ) Quelles sont les conditions de travail requises pour purifier chaque intermédiaire ?
3) Je ne suis pas certain de la quantité de tests et de développements itératifs effectués sur ce forum.
Y a-t-il quelqu'un sur le forum qui dispose d'un laboratoire adéquat et qui est prêt à essayer cette réaction et à donner son avis ? Je n'ai pas les moyens de le tester moi-même.
4) La réaction est-elle valable d'un point de vue mécanique ? La réaction existe-t-elle réellement ou est-ce que je viens de la sortir de mon chapeau ?
5) Existe-t-il déjà une procédure pour cette réaction ? Si oui, où puis-je la trouver ?
6) Le schéma de réaction peut-il être modifié pour inclure également la synthèse de dérivés n-méthylés (similaire à l'exemple que j'ai montré dans la littérature).
7) Est-il possible d'utiliser d'autres réactifs que le tétra-acétate de plomb pour induire l'étape de cyclisation ? J'ai l'impression que
l'hypochlorite ne fonctionnera pas car il oxyderait également l'alcool benzylique en cétone/phénone.
8) D'autres amines tertiaires comme la triéthylamine peuvent-elles être utilisées en plus du DMAP et du DABCO ?
9) Existe-t-ildes réactions secondaires notables qui diminueraient la pureté du produit final ?
10) La réduction produira-t-elle une amine racémique ou favorisera-t-elle un stéréoisomère plutôt qu'un autre ?
Il s'agit de mon premier message sur ce forum, je ne sais donc pas trop à quoi m'attendre.
Je vous remercie de votre lecture.
Un certain vendeur en ligne (que nous ne nommerons pas) semble suggérer une "nouvelle" voie d'accès aux phénéthylamines.
La réaction de l'aldéhyde à l'amine se produit en 3 étapes distinctes :
1) Une réaction de Baylis-Hillman est d'abord utilisée pour coupler un arylaldéhyde avec l'acrylamide en utilisant une base amine tertiaire comme le
DMAP (4-diméthylaminopyridine) ou DABCO/TEDA (triéthylènediamine).
L'acrylamide est un produit chimique industriel utilisé pour fabriquer des polymères, il est également associé aux aliments brûlés.
2) Un réarrangement de Hofmann modifié est ensuite effectué.
Contrairement à la réaction de Hofmann "normale", il est important de noter que le produit final n'est pas une amine.
L'isocyanate intermédiaire ne subit pas d'hydrolyse par l'eau pour former l'acide carbamique qui est ensuite décarboxylé pour donner l'amine.
Au lieu de cela, l'alcool benzylique formé à l'étape 1 subira une cyclisation intramoléculaire formant un cycle carbamate à 5 membres (qui est à la fois un ester et un amide).
Une série d'échanges rapides de protons se produit et isomérise l'oxazolidone non conjuguée en oxazolone conjuguée, plus stable.
3) Dans la dernière étape, une réduction au palladium sur carbone est effectuée en utilisant 3 équivalents d'hydrogène.
Le premier équivalent d'hydrogène est utilisé pour ouvrir le cycle de l'oxazolone, produisant un ester de formate et une imine qui sont ensuite réduits par les deux équivalents d'hydrogène restants.
réduits par les 2 équivalents d'hydrogène restants. L'amine souhaitée est formée avec l'acide formique comme sous-produit.
Ilest possible que cette réaction soit déjà connue des milieux clandestins(bien qu'il s'agisse d'un secret très bien gardé),
Cependant, j'ose dire que la réaction est "nouvelle" parce que je n'ai jamais entendu de discussions/rapports documentés de cette réaction sur des forums similaires ou dans la littérature.
Le mécanisme précis de la réaction est inconnu, bien que j'aie fait de mon mieux pour l'élucider.
Si vous n'êtes pas d'accord avec mes hypothèses mécanistes, veuillez expliquer vos pensées/critiques avec un raisonnement solide dans les commentaires.
Vos commentaires sont très appréciés.
Données bibliographiques :
[1] Pedro Molina, Alberto Tarraga, dans le livre "Comprehensive Organic Functional Group Transformations", 1995, ISBN : 978-0-08-044705-6
"On a découvert que le tétra-acétate de plomb dans la pyridine constituait une procédure douce pour effectuer un réarrangement rapide, à haut rendement, de type Hofmann, des β-hydroxy-amides primaires en 2-oxazolidinones, via le β-hydroxyisocyanate correspondant"
[2] Shinobu Hazama, S. Ichikawa, Fumihiro Yonebayashi, dans le Japanese Journal of Forensic Science and Technology, 2008, DOI : 10.3408/jafst.13.67
"La d-NE a été traitée avec du 1,1-carbonyldiimidazole pour produire le carbamate cyclique correspondant, et le produit a été traité avec de l'hydrure de sodium et de l'iodométhane pour former un dérivé aminé mono-N-méthylé, qui a été traité avec du palladium sur du charbon actif dans une atmosphère d'hydrogène pour une réduction catalytique. Après addition de chlorure d'hydrogène (HCl) aqueux, le l-MA a été obtenu sous la forme de son sel HCl (rendement total de 58 %)"
Mécanisme de la littérature/Schéma de réaction :
Mécanisme/schéma d'action proposé (hypothétique) :
Questions auxquelles il faut encore répondre :
1) Quelles sont les conditions exactes de réaction (température, conc, temps de réaction, etc.) et les réactifs nécessaires pour que cette réaction fonctionne ?
2 ) Quelles sont les conditions de travail requises pour purifier chaque intermédiaire ?
3) Je ne suis pas certain de la quantité de tests et de développements itératifs effectués sur ce forum.
Y a-t-il quelqu'un sur le forum qui dispose d'un laboratoire adéquat et qui est prêt à essayer cette réaction et à donner son avis ? Je n'ai pas les moyens de le tester moi-même.
4) La réaction est-elle valable d'un point de vue mécanique ? La réaction existe-t-elle réellement ou est-ce que je viens de la sortir de mon chapeau ?
5) Existe-t-il déjà une procédure pour cette réaction ? Si oui, où puis-je la trouver ?
6) Le schéma de réaction peut-il être modifié pour inclure également la synthèse de dérivés n-méthylés (similaire à l'exemple que j'ai montré dans la littérature).
7) Est-il possible d'utiliser d'autres réactifs que le tétra-acétate de plomb pour induire l'étape de cyclisation ? J'ai l'impression que
l'hypochlorite ne fonctionnera pas car il oxyderait également l'alcool benzylique en cétone/phénone.
8) D'autres amines tertiaires comme la triéthylamine peuvent-elles être utilisées en plus du DMAP et du DABCO ?
9) Existe-t-ildes réactions secondaires notables qui diminueraient la pureté du produit final ?
10) La réduction produira-t-elle une amine racémique ou favorisera-t-elle un stéréoisomère plutôt qu'un autre ?
Il s'agit de mon premier message sur ce forum, je ne sais donc pas trop à quoi m'attendre.
Je vous remercie de votre lecture.
Attachments
Last edited: