- Joined
- May 23, 2023
- Messages
- 6
- Reaction score
- 4
- Points
- 3
Introduzione:
Un certo venditore online (che non deve essere nominato) sembra suggerire una via "nuova" alle fenetilammine.
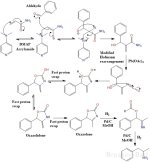
La reazione da aldeide ad ammina avviene in 3 fasi distinte:
1) Una reazione di Baylis-Hillman viene utilizzata per accoppiare un'aldeide arilica con l'acrilammide utilizzando una base amminica terziaria come
DMAP (4-dimetilaminopiridina) o DABCO/TEDA (trietilendiammina).
L'acrilammide è una sostanza chimica industriale utilizzata per la produzione di polimeri, ma è anche associata ai cibi bruciati.
2 ) Viene quindi eseguito un riarrangiamento di Hofmann modificato.
A differenza della "normale" reazione di Hofmann, è importante notare che il prodotto finale non è un'ammina.
L'isocianato intermedio non subisce l'idrolisi da parte dell'acqua per formare l'acido carbamico che viene poi decarbossilato per dare l'ammina.
Invece, l'alcol benzilico formato nella fase 1 subirà una ciclizzazione intramolecolare formando un anello carbammato a 5 membri (che è sia un estere che un'ammide).
Si verifica una serie di rapidi scambi di protoni che isomerizzano l'ossazolidone non coniugato nell'ossazolone coniugato, più stabile.
3 ) Nella fase finale viene effettuata una riduzione con palladio su carbonio utilizzando 3 equivalenti di idrogeno gassoso.
Il primo equivalente di idrogeno viene utilizzato per rompere l'anello dell'ossazolone, producendo un estere formiato e un' imina che vengono poi ridotti dai restanti 2 equivalenti di idrogeno.
che vengono poi ridotti dai restanti 2 equivalenti di idrogeno. Si forma l'ammina desiderata e l'acido formico come sottoprodotto.
È possibile che questa reazione sia già nota all'interno della scena clandestina(sebbene sia un segreto molto ben custodito),
Tuttavia, oserei dire che la reazione è "nuova" perché non ho mai sentito discussioni/documentazioni di questa reazione su forum simili o in letteratura.
Ilmeccanismo preciso della reazione è sconosciuto, anche se ho fatto il mio miglior tentativo di delucidarlo.
Se non siete d'accordo con le mie ipotesi meccanicistiche, vi prego di spiegare i vostri pensieri/critiche con un solido ragionamento nei commenti.
Il vostro feedback è molto apprezzato.
Prove di letteratura:
[1] Pedro Molina, Alberto Tarraga, nel libro "Comprehensive Organic Functional Group Transformations", 1995, ISBN: 978-0-08-044705-6
"Il tetraacetato di piombo in piridina è stato trovato per fornire una procedura semplice per effettuare un riarrangiamento rapido, ad alta resa, simile a quello di Hofmann, di ammidi primarie β-idrossi a 2-ossazolidinoni, attraverso il corrispondente β-idrossi-isocianato"
[2] Shinobu Hazama, S. Ichikawa, Fumihiro Yonebayashi, in Japanese Journal of Forensic Science and Technology, 2008, DOI: 10.3408/jafst.13.67
"Abbiamo sviluppato un metodo nuovo e conveniente per la sintesi della levo-metanfetamina utilizzando la d-norefedrina (d-NE) come materiale di partenza. La d-NE è stata trattata con 1,1-carbonildiimidazolo per produrre il corrispondente carbammato ciclico; il prodotto è stato trattato con idruro di sodio e iodometano per formare un derivato amminico mono-N-metilato, che è stato trattato con palladio su carbone attivo in atmosfera di idrogeno per la riduzione catalitica. Dopo l'aggiunta di cloruro di idrogeno (HCl) acquoso, l'l-MA è stato ottenuto come suo sale di HCl (resa totale 58%)".
Meccanismo di letteratura/schema di reazione:

Meccanismo/schema di reazione proposto (ipotetico):

Domande che necessitano ancora di una risposta:
1) Quali sono le esatte condizioni di reazione (temp, conc, tempo di reazione ecc...) e i reagenti necessari per il funzionamento di questa reazione?
2) Quali sono le condizioni di lavoro necessarie per purificare ogni intermedio?
3 ) Non sono sicuro di quanto i test e lo sviluppo iterativo avvengano su questo forum.
C'è qualcuno sul forum che ha un laboratorio adeguato disposto a provarlo e a dare un feedback? Non ho i mezzi per testarlo personalmente.
4 ) La reazione è meccanicamente valida? La reazione esiste davvero o l'ho tirata fuori dal cilindro?
5) Esiste già una procedura per questa reazione? Se sì, dove posso trovarla?
6) Lo schema di reazione può essere modificato per includere anche la sintesi di derivati n-metilati (simile all'esempio che ho mostrato in letteratura).
7) Si possono usare reagenti alternativi al tetra-acetato di piombo per indurre la fase di ciclizzazione? Mi sembra che
L'ipoclorito non funzionerebbe perché ossiderebbe anche l'alcol benzilico a chetone/fenone.
8) Si possono usare altre ammine terziarie come la trietilammina oltre a DMAP e DABCO?
9) Cisono reazioni collaterali degne di nota che potrebbero diminuire la purezza del prodotto finale?
10) La riduzione produrrà un'ammina racemica o favorirà preferenzialmente uno stereoisomero rispetto all'altro?
Questo è il mio primo post su questo forum, quindi non so quale feedback aspettarmi.
Grazie per aver letto.
Un certo venditore online (che non deve essere nominato) sembra suggerire una via "nuova" alle fenetilammine.
La reazione da aldeide ad ammina avviene in 3 fasi distinte:
1) Una reazione di Baylis-Hillman viene utilizzata per accoppiare un'aldeide arilica con l'acrilammide utilizzando una base amminica terziaria come
DMAP (4-dimetilaminopiridina) o DABCO/TEDA (trietilendiammina).
L'acrilammide è una sostanza chimica industriale utilizzata per la produzione di polimeri, ma è anche associata ai cibi bruciati.
2 ) Viene quindi eseguito un riarrangiamento di Hofmann modificato.
A differenza della "normale" reazione di Hofmann, è importante notare che il prodotto finale non è un'ammina.
L'isocianato intermedio non subisce l'idrolisi da parte dell'acqua per formare l'acido carbamico che viene poi decarbossilato per dare l'ammina.
Invece, l'alcol benzilico formato nella fase 1 subirà una ciclizzazione intramolecolare formando un anello carbammato a 5 membri (che è sia un estere che un'ammide).
Si verifica una serie di rapidi scambi di protoni che isomerizzano l'ossazolidone non coniugato nell'ossazolone coniugato, più stabile.
3 ) Nella fase finale viene effettuata una riduzione con palladio su carbonio utilizzando 3 equivalenti di idrogeno gassoso.
Il primo equivalente di idrogeno viene utilizzato per rompere l'anello dell'ossazolone, producendo un estere formiato e un' imina che vengono poi ridotti dai restanti 2 equivalenti di idrogeno.
che vengono poi ridotti dai restanti 2 equivalenti di idrogeno. Si forma l'ammina desiderata e l'acido formico come sottoprodotto.
È possibile che questa reazione sia già nota all'interno della scena clandestina(sebbene sia un segreto molto ben custodito),
Tuttavia, oserei dire che la reazione è "nuova" perché non ho mai sentito discussioni/documentazioni di questa reazione su forum simili o in letteratura.
Ilmeccanismo preciso della reazione è sconosciuto, anche se ho fatto il mio miglior tentativo di delucidarlo.
Se non siete d'accordo con le mie ipotesi meccanicistiche, vi prego di spiegare i vostri pensieri/critiche con un solido ragionamento nei commenti.
Il vostro feedback è molto apprezzato.
Prove di letteratura:
[1] Pedro Molina, Alberto Tarraga, nel libro "Comprehensive Organic Functional Group Transformations", 1995, ISBN: 978-0-08-044705-6
"Il tetraacetato di piombo in piridina è stato trovato per fornire una procedura semplice per effettuare un riarrangiamento rapido, ad alta resa, simile a quello di Hofmann, di ammidi primarie β-idrossi a 2-ossazolidinoni, attraverso il corrispondente β-idrossi-isocianato"
[2] Shinobu Hazama, S. Ichikawa, Fumihiro Yonebayashi, in Japanese Journal of Forensic Science and Technology, 2008, DOI: 10.3408/jafst.13.67
"Abbiamo sviluppato un metodo nuovo e conveniente per la sintesi della levo-metanfetamina utilizzando la d-norefedrina (d-NE) come materiale di partenza. La d-NE è stata trattata con 1,1-carbonildiimidazolo per produrre il corrispondente carbammato ciclico; il prodotto è stato trattato con idruro di sodio e iodometano per formare un derivato amminico mono-N-metilato, che è stato trattato con palladio su carbone attivo in atmosfera di idrogeno per la riduzione catalitica. Dopo l'aggiunta di cloruro di idrogeno (HCl) acquoso, l'l-MA è stato ottenuto come suo sale di HCl (resa totale 58%)".
Meccanismo di letteratura/schema di reazione:
Meccanismo/schema di reazione proposto (ipotetico):
Domande che necessitano ancora di una risposta:
1) Quali sono le esatte condizioni di reazione (temp, conc, tempo di reazione ecc...) e i reagenti necessari per il funzionamento di questa reazione?
2) Quali sono le condizioni di lavoro necessarie per purificare ogni intermedio?
3 ) Non sono sicuro di quanto i test e lo sviluppo iterativo avvengano su questo forum.
C'è qualcuno sul forum che ha un laboratorio adeguato disposto a provarlo e a dare un feedback? Non ho i mezzi per testarlo personalmente.
4 ) La reazione è meccanicamente valida? La reazione esiste davvero o l'ho tirata fuori dal cilindro?
5) Esiste già una procedura per questa reazione? Se sì, dove posso trovarla?
6) Lo schema di reazione può essere modificato per includere anche la sintesi di derivati n-metilati (simile all'esempio che ho mostrato in letteratura).
7) Si possono usare reagenti alternativi al tetra-acetato di piombo per indurre la fase di ciclizzazione? Mi sembra che
L'ipoclorito non funzionerebbe perché ossiderebbe anche l'alcol benzilico a chetone/fenone.
8) Si possono usare altre ammine terziarie come la trietilammina oltre a DMAP e DABCO?
9) Cisono reazioni collaterali degne di nota che potrebbero diminuire la purezza del prodotto finale?
10) La riduzione produrrà un'ammina racemica o favorirà preferenzialmente uno stereoisomero rispetto all'altro?
Questo è il mio primo post su questo forum, quindi non so quale feedback aspettarmi.
Grazie per aver letto.
Attachments
Last edited: