- Joined
- May 23, 2023
- Messages
- 6
- Reaction score
- 4
- Points
- 3
Wprowadzenie:
Pewien sprzedawca online (którego nazwa nie zostanie podana) wydaje się sugerować "nową" drogę do fenetyloamin.
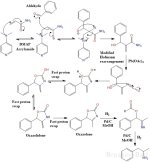
Reakcja od aldehydu do aminy zachodzi w 3 różnych etapach:
1) Reakcja Baylisa-Hillmana jest najpierw stosowana do sprzęgania aldehydu arylowego z akryloamidem przy użyciu trzeciorzędowej zasady aminowej, takiej jak
DMAP (4-dimetyloaminopirydyna) lub DABCO/TEDA (trietylenodiamina).
Akrylamid jest przemysłową substancją chemiczną używaną do produkcji polimerów, jest również kojarzony z przypaloną żywnością.
2) Następnie przeprowadza się zmodyfikowane przegrupowanie Hofmanna.
W przeciwieństwie do "zwykłej" reakcji Hofmanna, należy zauważyć, że produktem końcowym nie jest amina.
Pośredni izocyjanian nie ulega hydrolizie przez wodę, tworząc kwas karbaminowy, który jest następnie dekarboksylowany w celu otrzymania aminy.
Zamiast tego alkohol benzylowy utworzony w etapie 1 ulegnie wewnątrzcząsteczkowej cyklizacji, tworząc 5-członowy pierścień karbaminianowy (który jest zarówno estrem, jak i amidem).
Następuje seria szybkich wymian protonów, które następnie izomeryzują niesprzężony oksazolidon do bardziej stabilnego sprzężonego oksazolonu.
3 ) W ostatnim etapie przeprowadzana jest redukcja palladu na węglu przy użyciu 3 równoważników wodoru.
Pierwszy równoważnik wodoru jest używany do rozerwania pierścienia oksazolonu, tworząc ester mrówczanowy i iminę , które są następnie redukowane przez pozostałe 2 równoważniki wodoru.
redukowane przez pozostałe 2 równoważniki wodoru. Pożądana amina powstaje wraz z kwasem mrówkowym jako produktem ubocznym.
Możliwe,że ta reakcja jest już znana na tajnej scenie(choć jest bardzo dobrze strzeżoną tajemnicą),
Śmiem jednak twierdzić, że reakcja ta jest "nowatorska", ponieważ nigdy nie słyszałem żadnych dyskusji / udokumentowanych raportów na temat tej reakcji na podobnych forach lub w literaturze.
Dokładny mechanizm tej reakcji jest nieznany, chociaż podjąłem najlepszą próbę wyjaśnienia tego mechanizmu.
Jeśli nie zgadzasz się z moimi założeniami mechanistycznymi, proszę wyjaśnij swoje przemyślenia/krytykę z solidnym uzasadnieniem w komentarzach.
Twoja opinia będzie bardzo mile widziana.
Dowody literaturowe:
[1] Pedro Molina, Alberto Tarraga, w książce "Comprehensive Organic Functional Group Transformations", 1995, ISBN: 978-0-08-044705-6
" Stwierdzono, że tetraoctan ołowiu w pirydynie zapewnia łagodną procedurę szybkiego, wysokowydajnego, podobnego do Hofmanna przegrupowania β-hydroksy pierwszorzędowych amidów do 2-oksazolidynonów, poprzez odpowiedni β-hydroksyizocyjanian"
[2] Shinobu Hazama, S. Ichikawa, Fumihiro Yonebayashi, w Japanese Journal of Forensic Science and Technology, 2008, DOI: 10.3408/jafst.13.67
"Opracowaliśmy nową i wygodną metodę syntezy lewamfetaminy przy użyciu d-norefedryny (d-NE) jako materiału wyjściowego. d-NE poddano działaniu 1,1-karbonylodiimidazolu w celu wytworzenia odpowiedniego cyklicznego karbaminianu, a produkt poddano działaniu wodorku sodu i jodometanu w celu utworzenia mono-N-metylowanej pochodnej aminy, którą poddano działaniu palladu na węglu aktywnym w atmosferze wodoru w celu katalitycznej redukcji. Po dodaniu wodnego chlorowodoru (HCl) otrzymano l-MA w postaci soli HCl (całkowita wydajność 58%)".
Literatura Mechanizm/schemat reakcji:

Proponowany (hipotetyczny) mechanizm/schemat reakcji:

Pytania, na które wciąż trzeba odpowiedzieć:
1) Jakie są dokładne warunki reakcji (temperatura, stężenie, czas reakcji itp.) i odczynniki wymagane do przeprowadzenia tej reakcji?
2)Jakie warunki są wymagane do oczyszczenia każdego półproduktu?
3 ) Nie jestem pewien, ile testów i iteracyjnego rozwoju odbywa się na tym forum.
Czy jestktoś na forum z odpowiednim laboratorium, kto chciałby to wyp róbować i wyrazić swoją opinię? Sam nie mam możliwości przetestowania tego.
4) Czy reakcja jest mechanistycznie poprawna? Czy reakcja faktycznie istnieje, czy po prostu wyciągnąłem to z dupy?
5)Czy istnieje już procedura dla tej reakcji? Jeśli tak, gdzie mogę ją znaleźć?
6) Czyschemat reakcji można zmodyfikować tak, aby obejmował również syntezę n-metylowanych pochodnych (podobnie jak w przykładzie, który pokazałem w literaturze)?
7) Czy do wywołania etapu cyklizacjimożna użyć odczynników alternatywnych do tetraoctanu ołowiu? Mam wrażenie, że
podchloryn nie zadziała, ponieważ utleniłby również alkohol benzylowy do ketonu/fenonu.
8) Czy oprócz DMAP i DABCOmożna użyć innych amin trzeciorzędowych, takich jak trietyloamina?
9) Czy istnieją jakieś godne uwagi reakcje uboczne, które zmniejszyłyby czystość produktu końcowego?
10)Czy redukcja spowoduje powstanie racemicznej aminy lub czy będzie preferencyjnie faworyzować jeden stereoizomer nad drugim?
To mój pierwszy post na tym forum, więc nie jestem pewien, jakich opinii się spodziewać.
Dziękuję za przeczytanie.
Pewien sprzedawca online (którego nazwa nie zostanie podana) wydaje się sugerować "nową" drogę do fenetyloamin.
Reakcja od aldehydu do aminy zachodzi w 3 różnych etapach:
1) Reakcja Baylisa-Hillmana jest najpierw stosowana do sprzęgania aldehydu arylowego z akryloamidem przy użyciu trzeciorzędowej zasady aminowej, takiej jak
DMAP (4-dimetyloaminopirydyna) lub DABCO/TEDA (trietylenodiamina).
Akrylamid jest przemysłową substancją chemiczną używaną do produkcji polimerów, jest również kojarzony z przypaloną żywnością.
2) Następnie przeprowadza się zmodyfikowane przegrupowanie Hofmanna.
W przeciwieństwie do "zwykłej" reakcji Hofmanna, należy zauważyć, że produktem końcowym nie jest amina.
Pośredni izocyjanian nie ulega hydrolizie przez wodę, tworząc kwas karbaminowy, który jest następnie dekarboksylowany w celu otrzymania aminy.
Zamiast tego alkohol benzylowy utworzony w etapie 1 ulegnie wewnątrzcząsteczkowej cyklizacji, tworząc 5-członowy pierścień karbaminianowy (który jest zarówno estrem, jak i amidem).
Następuje seria szybkich wymian protonów, które następnie izomeryzują niesprzężony oksazolidon do bardziej stabilnego sprzężonego oksazolonu.
3 ) W ostatnim etapie przeprowadzana jest redukcja palladu na węglu przy użyciu 3 równoważników wodoru.
Pierwszy równoważnik wodoru jest używany do rozerwania pierścienia oksazolonu, tworząc ester mrówczanowy i iminę , które są następnie redukowane przez pozostałe 2 równoważniki wodoru.
redukowane przez pozostałe 2 równoważniki wodoru. Pożądana amina powstaje wraz z kwasem mrówkowym jako produktem ubocznym.
Możliwe,że ta reakcja jest już znana na tajnej scenie(choć jest bardzo dobrze strzeżoną tajemnicą),
Śmiem jednak twierdzić, że reakcja ta jest "nowatorska", ponieważ nigdy nie słyszałem żadnych dyskusji / udokumentowanych raportów na temat tej reakcji na podobnych forach lub w literaturze.
Dokładny mechanizm tej reakcji jest nieznany, chociaż podjąłem najlepszą próbę wyjaśnienia tego mechanizmu.
Jeśli nie zgadzasz się z moimi założeniami mechanistycznymi, proszę wyjaśnij swoje przemyślenia/krytykę z solidnym uzasadnieniem w komentarzach.
Twoja opinia będzie bardzo mile widziana.
Dowody literaturowe:
[1] Pedro Molina, Alberto Tarraga, w książce "Comprehensive Organic Functional Group Transformations", 1995, ISBN: 978-0-08-044705-6
" Stwierdzono, że tetraoctan ołowiu w pirydynie zapewnia łagodną procedurę szybkiego, wysokowydajnego, podobnego do Hofmanna przegrupowania β-hydroksy pierwszorzędowych amidów do 2-oksazolidynonów, poprzez odpowiedni β-hydroksyizocyjanian"
[2] Shinobu Hazama, S. Ichikawa, Fumihiro Yonebayashi, w Japanese Journal of Forensic Science and Technology, 2008, DOI: 10.3408/jafst.13.67
"Opracowaliśmy nową i wygodną metodę syntezy lewamfetaminy przy użyciu d-norefedryny (d-NE) jako materiału wyjściowego. d-NE poddano działaniu 1,1-karbonylodiimidazolu w celu wytworzenia odpowiedniego cyklicznego karbaminianu, a produkt poddano działaniu wodorku sodu i jodometanu w celu utworzenia mono-N-metylowanej pochodnej aminy, którą poddano działaniu palladu na węglu aktywnym w atmosferze wodoru w celu katalitycznej redukcji. Po dodaniu wodnego chlorowodoru (HCl) otrzymano l-MA w postaci soli HCl (całkowita wydajność 58%)".
Literatura Mechanizm/schemat reakcji:
Proponowany (hipotetyczny) mechanizm/schemat reakcji:
Pytania, na które wciąż trzeba odpowiedzieć:
1) Jakie są dokładne warunki reakcji (temperatura, stężenie, czas reakcji itp.) i odczynniki wymagane do przeprowadzenia tej reakcji?
2)Jakie warunki są wymagane do oczyszczenia każdego półproduktu?
3 ) Nie jestem pewien, ile testów i iteracyjnego rozwoju odbywa się na tym forum.
Czy jestktoś na forum z odpowiednim laboratorium, kto chciałby to wyp róbować i wyrazić swoją opinię? Sam nie mam możliwości przetestowania tego.
4) Czy reakcja jest mechanistycznie poprawna? Czy reakcja faktycznie istnieje, czy po prostu wyciągnąłem to z dupy?
5)Czy istnieje już procedura dla tej reakcji? Jeśli tak, gdzie mogę ją znaleźć?
6) Czyschemat reakcji można zmodyfikować tak, aby obejmował również syntezę n-metylowanych pochodnych (podobnie jak w przykładzie, który pokazałem w literaturze)?
7) Czy do wywołania etapu cyklizacjimożna użyć odczynników alternatywnych do tetraoctanu ołowiu? Mam wrażenie, że
podchloryn nie zadziała, ponieważ utleniłby również alkohol benzylowy do ketonu/fenonu.
8) Czy oprócz DMAP i DABCOmożna użyć innych amin trzeciorzędowych, takich jak trietyloamina?
9) Czy istnieją jakieś godne uwagi reakcje uboczne, które zmniejszyłyby czystość produktu końcowego?
10)Czy redukcja spowoduje powstanie racemicznej aminy lub czy będzie preferencyjnie faworyzować jeden stereoizomer nad drugim?
To mój pierwszy post na tym forum, więc nie jestem pewien, jakich opinii się spodziewać.
Dziękuję za przeczytanie.
Attachments
Last edited: