- Language
- 🇺🇸
- Joined
- Nov 16, 2023
- Messages
- 374
- Reaction score
- 291
- Points
- 63
Kan nogen hjælpe mig med at forstå, om det er muligt at bruge generiske næseinhalatorer, der indeholder "levmetamfetamin 50 mg" for at komme til d-meth.
https://bbgate.com/threads/methamphetamine-synthesis-vicks-inhaler.4974/#post-46343 Vil disse instruktioner fungere i teorien?
Eller skal jeg bruge ovenstående racemisering og opløsning leveret af Amphibian? Eller 41Dxflatline osv.?
https://bbgate.com/threads/methamphetamine-synthesis-vicks-inhaler.4974/#post-46343 Vil disse instruktioner fungere i teorien?
Eller skal jeg bruge ovenstående racemisering og opløsning leveret af Amphibian? Eller 41Dxflatline osv.?
Selv om det ville fungere ... nogle af disse kemikalier er svære at få fat i eller kan være farlige som mit brugernavn, bør du i stedet bruge naproxen og bruge pope-peachy med NASID Naproxen. Jeg har lagt hele guiden ud nedenfor
↑View previous replies…
- By azides
Udarbejdelsen er blevet offentliggjort tidligere, men igen
Det er ....
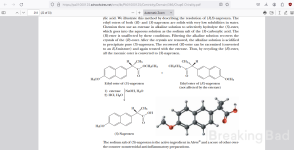
Undersøgelse af mekanismen for den optiske opløsning af N-methylamfetamin via diastereoisomer saltdannelse ved hjælp af Pope-Peachey-opløsningsmetoden som diskuteret af retorten senere
https://sci-hub.wf/10.1016/s0957-4166(00)86170-4
https://www.sciencedirect.com/science/article/abs/pii/S0957416600861704
refencer og noter
I.) Newman,P. Optical Resolution Procedures for Chemical Compounds, vols.l-3, optical Resolution Informztion
Catre, Manhattan College, New York, 1978-84;
2.) Jacques,J.; Collet,A.; Wilen,SH. Enantiomers, Racemates and Resolutions, Wiley and Sons, New York,
1981,378.p.
3.) Fogassy,E.; hs,M.; Faigl,F ; Rohonczy,J, Ecsery,Z. J.Chem.Soc.Perkin Trans.2, 1986, 1881
4.) Pope,W.J.; Peachey,S.J. J.Chem.Soc.,1899,75,1066
5.) 7,84 g (0,0525 mol) racemisk N-methylamfetamin og 9,73 g (0,0525 mol) racemisk N-
methylamfetaminhydrochlorid blev opløst i 70 ml abs. ethanol og 7,91 g (0,0525 mol) R,R-
tartaxinsyre i 56 ml abs. ethanol. Begge stamopløsninger blev opdelt i femten portioner efter volumen med en
burette og reagerede ved 22+1"C Blandingerne stod uforstyrret i 15, 90 minutter og 5, 24, 1 IS
timer, hvorefter bundfaldet blev filtreret og tørret. Fra 0,4 g af hvert salt blev basen frigjort ved hjælp af ccNaOH
og ekstraheret fra den vandige fase med dicblorometbane.
6.) Alle eksperimenter blev udført på den samme arbejdsbænk ved 2Ul'C stuetemperatur. Stamopløsninger af
racematet og opløsningsmidlet blev brugt for at undgå fejl i vægtmålingerne. Alle de anvendte kolber
havde samme størrelse og form.
7.) Indholdet af tartrat og hydrochlorid i saltene blev bestemt ved potenciometri med en RADIOMETER-
85 TTT automatisk titrator med 0,1 N NaOH og 0,1 N AgNO.
8.) De specifikke rotationer blev målt med en Perkin Elmer 241 polarhneter. Den specifikke rotation af
optisk ren R-N-methylamfetamin er [a]: - -18,90 (c 0,1, IN HCI).
9.) Saltene blev ikke vasket ved filtreringen. Den lille mængde hydrochlorid, der findes i saltene, kommer sandsynligvis
fra moderludden, der er klæbet og tørret til saltets overflade.
10.) Dette er i overensstemmelse med resultaterne3, at R-l II er et mere stabilt salt end S-1.11
Hvis du vil have mere, kan du også læse retorten nedenfor, alt skal være i https://sci-hub.wf i det store og hele dog
I stedet bruges der i denne drejning kun en halv ækvivalent chiral amin. I stedet bruges en halv ækvivalent af en billigere, optisk inaktiv aminbase. Det gør ikke kun processen billigere, men resulterer også i en mere dramatisk forskel i opløseligheden. Den konjugerede base af den ønskede (d)-(+)-enantiomer krystalliserer ud med den konjugerede syre af den chirale amin med høj selektivitet. Dette efterlader det mere opløselige saltprodukt af (l)-(-)-naproxen og den achirale amin i opløsning.
Det er ....
Undersøgelse af mekanismen for den optiske opløsning af N-methylamfetamin via diastereoisomer saltdannelse ved hjælp af Pope-Peachey-opløsningsmetoden som diskuteret af retorten senere
https://sci-hub.wf/10.1016/s0957-4166(00)86170-4
https://www.sciencedirect.com/science/article/abs/pii/S0957416600861704
refencer og noter
I.) Newman,P. Optical Resolution Procedures for Chemical Compounds, vols.l-3, optical Resolution Informztion
Catre, Manhattan College, New York, 1978-84;
2.) Jacques,J.; Collet,A.; Wilen,SH. Enantiomers, Racemates and Resolutions, Wiley and Sons, New York,
1981,378.p.
3.) Fogassy,E.; hs,M.; Faigl,F ; Rohonczy,J, Ecsery,Z. J.Chem.Soc.Perkin Trans.2, 1986, 1881
4.) Pope,W.J.; Peachey,S.J. J.Chem.Soc.,1899,75,1066
5.) 7,84 g (0,0525 mol) racemisk N-methylamfetamin og 9,73 g (0,0525 mol) racemisk N-
methylamfetaminhydrochlorid blev opløst i 70 ml abs. ethanol og 7,91 g (0,0525 mol) R,R-
tartaxinsyre i 56 ml abs. ethanol. Begge stamopløsninger blev opdelt i femten portioner efter volumen med en
burette og reagerede ved 22+1"C Blandingerne stod uforstyrret i 15, 90 minutter og 5, 24, 1 IS
timer, hvorefter bundfaldet blev filtreret og tørret. Fra 0,4 g af hvert salt blev basen frigjort ved hjælp af ccNaOH
og ekstraheret fra den vandige fase med dicblorometbane.
6.) Alle eksperimenter blev udført på den samme arbejdsbænk ved 2Ul'C stuetemperatur. Stamopløsninger af
racematet og opløsningsmidlet blev brugt for at undgå fejl i vægtmålingerne. Alle de anvendte kolber
havde samme størrelse og form.
7.) Indholdet af tartrat og hydrochlorid i saltene blev bestemt ved potenciometri med en RADIOMETER-
85 TTT automatisk titrator med 0,1 N NaOH og 0,1 N AgNO.
8.) De specifikke rotationer blev målt med en Perkin Elmer 241 polarhneter. Den specifikke rotation af
optisk ren R-N-methylamfetamin er [a]: - -18,90 (c 0,1, IN HCI).
9.) Saltene blev ikke vasket ved filtreringen. Den lille mængde hydrochlorid, der findes i saltene, kommer sandsynligvis
fra moderludden, der er klæbet og tørret til saltets overflade.
10.) Dette er i overensstemmelse med resultaterne3, at R-l II er et mere stabilt salt end S-1.11
Hvis du vil have mere, kan du også læse retorten nedenfor, alt skal være i https://sci-hub.wf i det store og hele dog
I stedet bruges der i denne drejning kun en halv ækvivalent chiral amin. I stedet bruges en halv ækvivalent af en billigere, optisk inaktiv aminbase. Det gør ikke kun processen billigere, men resulterer også i en mere dramatisk forskel i opløseligheden. Den konjugerede base af den ønskede (d)-(+)-enantiomer krystalliserer ud med den konjugerede syre af den chirale amin med høj selektivitet. Dette efterlader det mere opløselige saltprodukt af (l)-(-)-naproxen og den achirale amin i opløsning.
Last edited: