- Language
- 🇺🇸
- Joined
- Nov 16, 2023
- Messages
- 373
- Reaction score
- 290
- Points
- 63
Kann mir jemand helfen zu verstehen, ob es möglich ist, generische nasale Inhalatoren zu verwenden, die Levmetamfetamin 50mg" enthalten, um an D-Meth zu gelangen.
https://bbgate.com/threads/methamphetamine-synthesis-vicks-inhaler.4974/#post-46343 Werden diese Anweisungen theoretisch funktionieren?
Oder muss ich die oben genannte Razemisierung und Auflösung verwenden, die von Amphibian bereitgestellt wird? Oder 41Dxflatline, usw.?
https://bbgate.com/threads/methamphetamine-synthesis-vicks-inhaler.4974/#post-46343 Werden diese Anweisungen theoretisch funktionieren?
Oder muss ich die oben genannte Razemisierung und Auflösung verwenden, die von Amphibian bereitgestellt wird? Oder 41Dxflatline, usw.?
Auch wenn es funktionieren würde... einige dieser Chemikalien sind schwer zu bekommen oder könnten gefährlich sein, wie mein Benutzername, stattdessen solltest du Naproxen verwenden. Ich habe die vollständige Anleitung unten gepostet
↑View previous replies…
- By azides
Die Ausarbeitung wurde bereits früher veröffentlicht, aber noch einmal
Sie lautet ....
Untersuchung des Mechanismus der optischen Auflösung von N-Methylamphetamin durch diastereoisomere Salzbildung mit der Pope-Peachey-Auflösungsmethode, wie sie später in der Retorte diskutiert wird
https://sci-hub.wf/10.1016/s0957-4166(00)86170-4
https://www.sciencedirect.com/science/article/abs/pii/S0957416600861704
refences und Anmerkungen
I.) Newman,P. Optical Resolution Procedures for Chemical Compounds, Bd.l-3, optical Resolution Informztion
Catre, Manhattan College, New York, 1978-84;
2.) Jacques,J.; Collet,A.; Wilen,SH. Enantiomers, Racemates and Resolutions, Wiley and Sons, New York,
1981,378.p.
3.) Fogassy,E.; hs,M.; Faigl,F ; Rohonczy,J, Ecsery,Z. J.Chem.Soc.Perkin Trans.2, 1986, 1881
4.) Pope,W.J.; Peachey,S.J. J.Chem.Soc.,1899,75,1066
5.) 7,84 g (0,0525 mol) racemisches N-Methylamphetamin und 9,73 g (0,0525 mol) racemisches N-
Methylamphetaminhydrochlorid wurden in 70 ml abs. Ethanol gelöst und 7,91 g (0,0525 mol) R,R-
Tartaxinsäure in 56 ml abs. Ethanol gelöst. Beide Stammlösungen wurden mit einer Bürette in fünfzehn Volumenportionen aufgeteilt
Bürette in fünfzehn Volumenportionen aufgeteilt und bei 22+1 "C zur Reaktion gebracht. Die Mischungen wurden 15, 90 Minuten und 5, 24, 1 IS
Stunden stehen gelassen, dann wurden die Ausfällungen filtriert und getrocknet. Von 0,4 g eines jeden Salzes wurde die Base mit ccNaOH
freigesetzt und mit Dicblorometban aus der wässrigen Phase extrahiert.
6.) Alle Versuche wurden auf demselben Arbeitstisch bei 2Ul'C Raumtemperatur durchgeführt. Stammlösungen von
des Racemats und des Auflösungsmittels wurden verwendet, um Fehler bei der Gewichtsmessung zu vermeiden. Alle verwendeten Kolben
hatten die gleiche Größe und Form
7.)Der Tartrat- und Hydrochloridgehalt der Salze wurde potenziometrisch mit einem RADIOMETER-
85 TTT automatischen Titrator mit 0,1 N NaOH und 0,1 N AgNO, bestimmt.
8.) Die spezifischen Drehungen wurden mit einem Perkin Elmer 241 Polarhneter gemessen. Die spezifische Drehung des
optisch reinen R-N-Methylamphetamins ist [a]: - -18,90 (c 0,1, IN HCI).
9.) Die Salze wurden bei der Filtration nicht gewaschen. Die geringe Menge an Hydrochlorid, die in den Salzen gefunden wurde, stammt wahrscheinlich
Die geringe Menge an Hydrochlorid, die in den Salzen gefunden wurde, stammt wahrscheinlich aus der Mutterlauge, die an der Oberfläche des Salzes klebt und getrocknet ist.
10.) Dies stimmt mit den Ergebnissen3 überein, dass R-l II das stabilere Salz ist als S-1.11
Wenn Sie mehr wollen, können Sie auch die Retorte unten lesen, alles sollte in der https://sci-hub.wf zu finden sein.
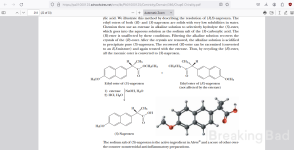
Stattdessen wird in diesem Dreh nur ein halbes Äquivalent eines chiralen Amins verwendet. An seiner Stelle wird ein halbes Äquivalent einer billigeren, optisch inaktiven Aminbase verwendet. Dies macht das Verfahren nicht nur billiger, sondern führt auch zu einem deutlicheren Unterschied in der Löslichkeit. Die konjugierte Base des gewünschten (d)-(+)-Enantiomers kristallisiert mit der konjugierten Säure des chiralen Amins mit hoher Selektivität aus. Das löslichere Salzprodukt von (l)-(-)-Naproxen und das achirale Amin bleiben in Lösung zurück.
Sie lautet ....
Untersuchung des Mechanismus der optischen Auflösung von N-Methylamphetamin durch diastereoisomere Salzbildung mit der Pope-Peachey-Auflösungsmethode, wie sie später in der Retorte diskutiert wird
https://sci-hub.wf/10.1016/s0957-4166(00)86170-4
https://www.sciencedirect.com/science/article/abs/pii/S0957416600861704
refences und Anmerkungen
I.) Newman,P. Optical Resolution Procedures for Chemical Compounds, Bd.l-3, optical Resolution Informztion
Catre, Manhattan College, New York, 1978-84;
2.) Jacques,J.; Collet,A.; Wilen,SH. Enantiomers, Racemates and Resolutions, Wiley and Sons, New York,
1981,378.p.
3.) Fogassy,E.; hs,M.; Faigl,F ; Rohonczy,J, Ecsery,Z. J.Chem.Soc.Perkin Trans.2, 1986, 1881
4.) Pope,W.J.; Peachey,S.J. J.Chem.Soc.,1899,75,1066
5.) 7,84 g (0,0525 mol) racemisches N-Methylamphetamin und 9,73 g (0,0525 mol) racemisches N-
Methylamphetaminhydrochlorid wurden in 70 ml abs. Ethanol gelöst und 7,91 g (0,0525 mol) R,R-
Tartaxinsäure in 56 ml abs. Ethanol gelöst. Beide Stammlösungen wurden mit einer Bürette in fünfzehn Volumenportionen aufgeteilt
Bürette in fünfzehn Volumenportionen aufgeteilt und bei 22+1 "C zur Reaktion gebracht. Die Mischungen wurden 15, 90 Minuten und 5, 24, 1 IS
Stunden stehen gelassen, dann wurden die Ausfällungen filtriert und getrocknet. Von 0,4 g eines jeden Salzes wurde die Base mit ccNaOH
freigesetzt und mit Dicblorometban aus der wässrigen Phase extrahiert.
6.) Alle Versuche wurden auf demselben Arbeitstisch bei 2Ul'C Raumtemperatur durchgeführt. Stammlösungen von
des Racemats und des Auflösungsmittels wurden verwendet, um Fehler bei der Gewichtsmessung zu vermeiden. Alle verwendeten Kolben
hatten die gleiche Größe und Form
7.)Der Tartrat- und Hydrochloridgehalt der Salze wurde potenziometrisch mit einem RADIOMETER-
85 TTT automatischen Titrator mit 0,1 N NaOH und 0,1 N AgNO, bestimmt.
8.) Die spezifischen Drehungen wurden mit einem Perkin Elmer 241 Polarhneter gemessen. Die spezifische Drehung des
optisch reinen R-N-Methylamphetamins ist [a]: - -18,90 (c 0,1, IN HCI).
9.) Die Salze wurden bei der Filtration nicht gewaschen. Die geringe Menge an Hydrochlorid, die in den Salzen gefunden wurde, stammt wahrscheinlich
Die geringe Menge an Hydrochlorid, die in den Salzen gefunden wurde, stammt wahrscheinlich aus der Mutterlauge, die an der Oberfläche des Salzes klebt und getrocknet ist.
10.) Dies stimmt mit den Ergebnissen3 überein, dass R-l II das stabilere Salz ist als S-1.11
Wenn Sie mehr wollen, können Sie auch die Retorte unten lesen, alles sollte in der https://sci-hub.wf zu finden sein.
Stattdessen wird in diesem Dreh nur ein halbes Äquivalent eines chiralen Amins verwendet. An seiner Stelle wird ein halbes Äquivalent einer billigeren, optisch inaktiven Aminbase verwendet. Dies macht das Verfahren nicht nur billiger, sondern führt auch zu einem deutlicheren Unterschied in der Löslichkeit. Die konjugierte Base des gewünschten (d)-(+)-Enantiomers kristallisiert mit der konjugierten Säure des chiralen Amins mit hoher Selektivität aus. Das löslichere Salzprodukt von (l)-(-)-Naproxen und das achirale Amin bleiben in Lösung zurück.
Last edited: